肝细胞癌组织中信号素3F蛋白表达变化及其与患者预后的关系
2014-12-02罗来邦徐志丹丁利民罗文峰龙成美张友福李新长
罗来邦,徐志丹,丁利民,罗文峰,龙成美,张友福,李新长
(江西省人民医院,南昌330006)
肝细胞癌(HCC)作为一种富血管的实体瘤,新生血管的生成对其发生发展及侵袭转移都是必不可少的。信号素3F(SEMA3F)蛋白最初作为一种抑癌基因在肺癌中被发现,目前在多种肿瘤组织中都观察到了SEMA3F基因缺失或SEMA3F蛋白水平下调[1,2],SEMA3F 能够抑制肿瘤的血管生成和侵袭转移[3,4]。但是国内外有关 SEMA3F 基因与 HCC复发转移的关系的相关研究鲜见。2008年5月~2011年9月,我们观察了32例HCC患者癌组织SEMA3F基因表达情况,现分析结果,探讨其在HCC发生发展中的作用。
1 资料与方法
1.1 临床资料 研究对象为2008年5月~2009年9月江西省人民医院经手术病理确诊的32例HCC患者,男29例、女3例,年龄22~70岁,中位年龄47岁;术前均未行介入治疗以及放、化疗。乙肝表面抗原阳性28例,阴性4例;有肝硬化者25例。取32例患者的手术切除标本(肿瘤有包膜结构者16例,无包膜结构者16例;肿块为单结节者16例,结节数≥2个者16例),于肿瘤分界线靠肿瘤侧1 cm内取样为HCC组,分界线另一侧1 cm取癌旁组织作为对照组。全部标本离体后迅速取材,置入液氮速冻后转入超低温冰箱-70℃保存备用。
1.2 两组SEMA3F蛋白表达检测 采用Western blot法,操作按试剂盒说明书进行。按照说明书配制并加入Super Singnal发光试剂显影曝光摄片;所得图像扫描后用图形分析软件(Quantity One)进行图像分析。以出现Quantity One软件可识别的蛋白条带为SEMA3F蛋白表达阳性;其表达量以蛋白条带吸光度和条带面积乘积表示。癌组织与癌旁组织SEMA3F蛋白表达量之比<0.48为低表达,≥0.48为高表达。分析SEMA3F蛋白表达与HCC临床病理特征的关系。
1.3 SEMA3F蛋白表达与肿瘤复发及生存时间的关系的观察 对32例患者采用门诊定期复查、电话、信访等方式随访,自术后开始,截止日期为2011年9月(全部获得随访)计算术后生存时间以及复发时间,患者死亡或失访定为随访结束点。分析SEMA3F蛋白表达与术后复发及生存时间的关系。
1.4 统计学方法 采用SPSS13.0统计软件。计量资料用±s表示,组间比较采用t检验。计数资料的组间比较采用χ2检验和Fisher确切概率法。采用Kapan-Meier法计算术后复发转移率和术后生存率,用Log-rank法比较两组术后复发转移率和术后生存率的差异。P<0.05为差异有统计学意义。
2 结果
2.1 SEMA3F蛋白表达 HCC组及对照组 SEMA3F蛋白表达阳性率分别为84%(27/32)、97%(31/32),差异无统计学意义;SEMA3F蛋白表达量分别为 447.8 ±48.3、618.9 ±61.2;P <0.05。32 例患者SEMA3F蛋白高表达者17例,低表达者15例。
2.2 SEMA3F蛋白表达与HCC临床病理特征的关系 肿瘤有、无包膜者SEMA3F蛋白表达量分别为388.3 ±97.1、254.6 ±61.4,有、无肝硬化者分别为509.6 ±70.1、226.9 ±88.6,单个、多个结节者分别为572.4 ±103.1、323.1 ±52.9。肿瘤有包膜结构者表达量明显高于无包膜结构者,肿瘤为单个结节者表达量明显高于多结节者(P均<0.05)。有、无肝硬化者SEMA3F蛋白表达量差异无统计学意义。
2.3 SEMA3F蛋白表达与HCC复发及预后的关系17例SEMA3F蛋白高表达者及15例低表达者术后各时点复发率见图1,生存时间见图2。由图可见,低表达者复发率显著高于高表达者,生存时间显著短于高表达者(P均<0.05)。
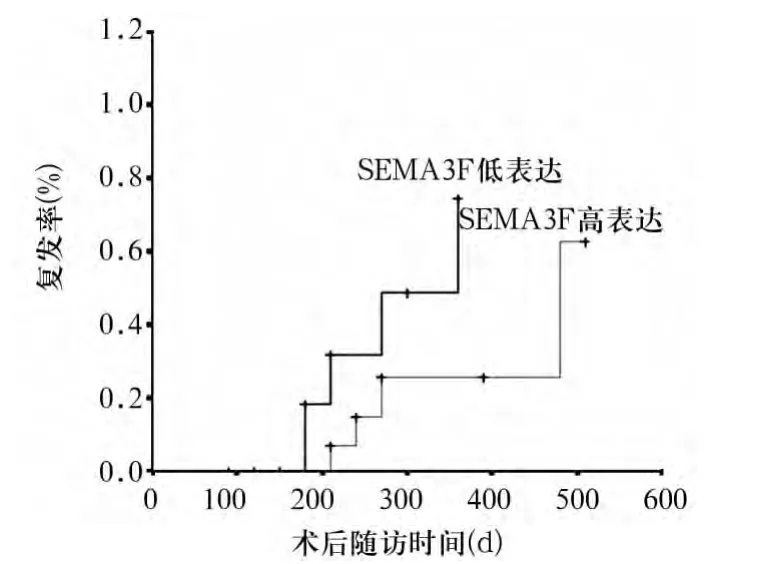
图1 HCC组SEMA3F蛋白低、高表达患者术后复发率比较
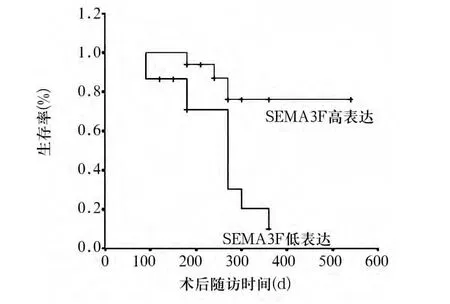
图2 HCC组SEMA3F蛋白低、高表达患者术后生存率比较
3 讨论
HCC恶性程度极高,具有高度的侵袭转移性,极易发生肝内外的转移。随着肝脏外科手术技术的提高以及围手术期处理的不断完善,HCC的手术切除率大大提高[5];但尽管如此,患者的预后情况仍没有根本的改善。术后复发和转移为主要原因[6,7]。肝癌复发转移是多步骤、多种生理及病理因素参与的复杂过程,肿瘤血管生成是其中一个重要步骤[8~11]。SEMA3F 是一种抑癌基因[12]。随着研究的深入,逐步发现其能通过多条途径抑制新生血管的形成;在抑制血管内皮细胞活化、增殖和运动方面均有重要作用。研究发现,在内皮细胞培养时加入外源性的SEMA3F能够有效抑制血管内皮细胞活化以及增殖[3];SEMA3F对于血管内皮细胞存在一种化学排斥作用[4],将分泌SEMA3F的肿瘤细胞和SEMA3F共同培养时,肿瘤细胞周围的内皮细胞被逐渐排开,形成一个空区;将含有SEMA3F基因的质粒转入黑色素瘤细胞,并将细胞植入裸鼠皮下,所形成的肿瘤的微血管数目和侵袭转移能力大大降低。SEMA3F对于血管内皮细胞的作用方式不仅仅局限于其直接影响血管内皮细胞的活化、增殖和定向移动,更能够拮抗一部分促进血管生成的因子的作用。VEGF是目前已知的最强的血管生成促进因子,SEMA3F能够通过直接竞争性的结合其受体—神经纤毛蛋白Neuropilins,抑制VEGF诱导血管生成的信号通路上的效应分子细胞外调节激酶(ERK)的磷酸化,抑制 VEGF所诱导的血管生成[13]。
HCC是典型的富血供恶性肿瘤,临床实践中我们发现存在一种孤立性大肝癌(SLHCC),其特点是直径>5 cm,并有完整的包膜或包膜状结构,具有较好的生物学行为,肿瘤内部血管密度较结节性肝癌低,侵袭转移率也较低,患者预后相对较好[14,15]。这些特点与SEMA3F在其他肿瘤如黑色素瘤中的作用不谋而合。故我们选择SEMA3F作为研究指标,了解其与HCC的临床病理特征,复发转移及预后的关系。
本研究结果显示,HCC癌组织与癌旁组织SEMA3F表达阳性率无显著差异,这与先前发现的SEMA3F在人体内表达较为广泛的特点是一致的。在对表达量的统计分析中我们发现,癌组织SEMA3F蛋白表达量低于癌旁组织,表明SEMA3F蛋白表达在HCC中产生了明显的下调。
研究发现,SEMA3F所在的染色体3p21.3区段在肺癌、肾癌、乳腺癌,卵巢癌以及鼻咽癌中都存在高频的杂合性缺失[1,2];在这些肿瘤中 SEMA3F 的表达均有不同程度的下调。在对SEMA3F同家族成员SEMA3B的研究中也发现,在肝癌组织中染色体3p21.3区段同样存在有一定程度的杂合性丢失[16],这一发现是SEMA3F作为一种抑癌基因的有力佐证。SEMA3F蛋白在HCC中表达下调的原因,不仅仅在于其所在染色体区段的杂合性丢失,也可能是肿瘤细胞中存在的其他细胞因子影响了SEMA3F所在的信号传导通路所致;例如VEGF能够与SEMA3F竞争同一受体Neuropilins。尽管目前二者优先与Neuropilins结合的条件和机制尚不完全清楚,但可以肯定的是,当VEGF表达水平升高时,SEMA3F的表达明显降低[10]。究其原因,可能是VEGF与Neuropilins结合后阻止了SEMA3F对Neuropilins的作用,游离的SEMA3F蛋白被分泌在细胞外基质中,被基质内的蛋白酶迅速降解。VEGF在肝癌中呈过量表达,这也可能是SEMA3F蛋白在HCC组织中表达下调的原因之一。
肿瘤包膜的形成机制目前仍无定论,但大多数学者都倾向于“膨胀学说”,即包膜并非来源于肿瘤本身,而是肿瘤在膨胀性生长中,对周围组织的挤压造成组织缺血,慢性炎症后继发修复伴随细胞外基质沉积而形成[17,18]。包膜是机体抑制肿瘤侵袭转移的重要屏障,具有包膜结构的肿瘤常常有着良好的生物学行为和预后。本研究结果显示SEMA3F蛋白高表达与包膜形成显著相关。这一相关性可以用SEMA3F对血管生成的抑制作用来解释。肿瘤细胞产生的SEMA3F对内皮细胞的化学排斥作用阻止了内皮细胞由肿瘤周围组织向肿瘤内部的迁移,同时抑制了肿瘤内部的血管内皮细胞的活化与增殖,导致肿瘤血管形成的减少;肿瘤因此难以得到充分的营养,生长缓慢,故只能向周围组织膨胀性生长而非浸润性生长;由于肿瘤挤压周围的肝组织,引起慢性炎症并继发纤维修复和胶原沉积,形成包膜结构。由此可见,包膜或包膜结构既是机体阻止肿瘤发生侵袭转移的重要屏障,也是肿瘤具有良好生物学行为的标志。Bielenberg等[4]将含SEMA3F基因的质粒转入高侵袭转移能力的黑色素瘤细胞中,并将转染后稳定表达SEMA3F蛋白的细胞进行裸鼠成瘤试验。结果发现,转染后的黑色素瘤细胞所形成的肿瘤均具有完整的包膜结构。
结节性肝癌除可能为多中心发生外,常常是肝内转移所致[19]。本研究显示,单个结节的HCC组织中SEMA3F表达量高于多结节HCC。通过门脉系统扩散是HCC肝内转移的主要途径,SEMA3F蛋白在单个、多个结节HCC中表达的差异提示其在抑制HCC肝内转移中起到重要作用;肝外转移同样也是导致HCC患者预后不良的原因之一。但在临床病例中,大多数已有肝外转移的患者不再选择手术治疗,因此从已有肝外转移的HCC组织中检测SEMA3F蛋白在标本采集上有一定的困难。已有研究显示,SEMA3F能够降低恶性肿瘤的转移率[9]。结合以上两个方面的研究结果,单个、多个结节HCC中SEMA3F蛋白表达的差异为单个结节HCC可能具有相对良好的生物学行为提供了新的证据。
值得提出的是,SEMA3F蛋白对血管生成抑制作用的主要靶点是血管内皮细胞;而以往对SEMA3F作用于血管内皮细胞的研究所采用的都是外源性的SEMA3F蛋白。这两个特点使得SEMA3F蛋白具有了成为一种抑制血管生成药物的可能。首先,血管内皮细胞暴露于血液中,进入血液循环的药物能够很轻易的作用于这些靶点;其次,外源性的SEMA3F蛋白能够抑制血管内皮细胞的活化、增殖、趋化、运动和聚集。如能将人工合成的SEMA3F导入肿瘤细胞中,使肿瘤细胞自身能够分泌高水平的SEMA3F蛋白,则有可能改变恶性肿瘤的侵袭转移性。由此可见,SEMA3F无论是作为一种传统的药物或是肿瘤基因治疗的研究热点都有着很好的前景。当然,要将SEMA3F作为一种抗血管生成的药物应用于临床,还必须克服很多难题,比如如何消除SEMA3F对其他正常器官的副作用等。
本研究随访资料显示,SEMA3F蛋白低表达者生存时间显著短于高表达者,复发率显著高于高表达者。表明SEMA3F蛋白低表达可促进HCC复发、转移;SEMA3F可作为预警HCC复发转移的有价值的标志物。理论上SEMA3F作为一种分泌型蛋白应能从外周血中检测到,此为临床通过检测SEMA3F蛋白来判断患者的预后提供了便利的条件。
综上所述,SEMA3F蛋白高表达可能通过抑制HCC新生血管形成而抑制HCC的侵袭转移;SEMA3F在HCC癌组织中的表达水平可预测HCC的复发、转移及预后。研究SEMA3F的作用方式和作用特点,对恶性肿瘤的抗血管生成治疗具有积极意义。
[1]Senchenko VN,Liu J,Zabarovsky ER.Discovery of frequent homozygous deletions in chromosome 3p21.3 LUCA and AP20 regions in renal,lung and breast carcinomas[J].Oncogene,2004,23(34):5719-5728.
[2]Senchenko V,Liu J.Deletion mapping using quantitative real-time PCR identifies two distinct 3p21.3 regions affected in most cervical carcinomas[J].Oncogene,2003,22(19):2984-2992.
[3]Kessler O,Shraga-Heled N,Lange T,et al.Semaphorin-3F is an inhibitor of tumor angiogenesis[J].Cancer Res,2004,64(3):1008-1015.
[4]Bielenberg DR,Hida Y.Semaphorin 3F,a chemorepulsant for endothelial cells,induces a poorly vascularize d,encapsulated,nonmetastatic tumor phenotype[J].J Clin Invest,2004,114(9):1260-1271.
[5] Barraud H,Bronowicki JP.Curative treatment of hepatocellular carcinoma[J].Rev Prat Rev,2013,63(2):229-233.
[6]Giannelli G,Antonaci S.Novel concepts in hepatocellular carcinoma:from molecular research to clinical practice[J].J Clin Gastroenterol,2006,40(9):842-846.
[7]阎涛,赵建军.肝细胞肝癌术后预后因素分析[J].中华肿瘤杂志,2013,35(1):54-58.
[8]Zeng L,Yu J,Huang T.Differential combinatorial regulatory network analysis related to venous metastasis of hepatocellular carcinoma[J].BMC Genomics,2012,13(Suppl 8):14.
[9]Yang LY,Lu WQ,Huang GW,et al.Correlation between CD105 expression and postoperative recurrence and metastasis of hepatocellular carcinoma[J].BMC Cancer,2006,(6):110.
[10]Wang W,Yang LY,Huang GW,et al.Genomic analysis reveals RhoCas a potential marker in hepatocellular carcinoma with poor prognosis[J].Br J Cancer,2004,90(12):2349-2355.
[11]Kim JW.Hypoxia-inducible factor 1,hepatocellular carcinoma and angiogenesis[J].Korean J Hepatol,2010 ,16(3):278-279.
[12]Roche J,Boldog F.Distinct 3p21.3 deletions in lung cancer and identification of a new human semaphoring[J].Oncogene,1996,12(6):1289-1297.
[13] Coma S,Shimizu A.Hypoxia induces tumor and endothelial cell migration in a semaphorin 3F-and VEGF-dependent manner via transcriptional repression of their common receptor neuropilin 2[J].Cell Adh Migr,2011,5(3):266-275.
[14]王伟,杨连粤,杨治力,等.RhoC基因在肝细胞癌中的表达及其意义[J].中华普通外科杂志,2003,18(9):558-560.
[15]杨连粤,刘合利,黄耿文,等.孤立性大肝癌的分子病理特征的初步研究[J].中华实验外科杂志,2004,21(1):94-96.
[16]刘晓琼,潘志刚,李满枝,等.3p213区域鼻咽癌相关基因-BLU的抑癌功能[J].癌症,2003,22(2):128-135.
[17]Tischoff I,Markwarth A.Allele loss and epigenetic inactivation of 3p21.3 in malignant liver tumors[J].Int J Cancer,2005,115(5):684-689.
[18]Jackson TL,Byrne HM.A mechanical model of tumor encapsulation and transcapsular spread[J].Math Biosci,2002,180:307-328.
[19]Gish RG.Strategies for hepatocellular carcinoma surveillance and diagnosis[J].Clin Adv Hematol Oncol,2013,5(4):8-14.
