脐带间充质干细胞nestin mRNA表达的研究
2014-12-02侯吉锋姚星宇张国华赵鹏伟杨丽敏
侯吉锋,姚星宇,张国华,赵鹏伟,杨丽敏
(内蒙古医科大学附属医院,呼和浩特010059)
研究发现,脐带中含有丰富的造血及间充质干细胞(MSCs)。神经巢蛋白(nestin)是一种中等纤维蛋白,在哺乳动物神经前体细胞中高表达,是神经前体细胞的标志分子,目前已有关于经定向诱导的脐带间充质干细胞(UC-MSCs)表达神经细胞特有抗原或相关因子的研究报道[1,2]。为探讨未经诱导的脐带MSCs中是否存在神经前体细胞标志物基因表达及其意义,我们于2013年5~12月进行了如下研究。
1 材料与方法
1.1 材料 根据中华人民共和国国务院颁发的《医疗机构管理条例》,经本院伦理委员会批准,实验前告知对方实验方案及风险,产妇家属签署自愿捐献脐带志愿书后,由妇产科医师采集10名健康足月儿的脐带(产妇均无传染病)主要试剂及设备:DMEM/F12(美国GIBCO),胎牛血清(美国GIBCO),双抗(青霉素+链霉素,美国GIBCO公司),台盼蓝(Sigma),PBS(天津化学试剂厂),倒置相差显微镜(Olympus),荧光显微镜(Nikon),高速离心机(RJ-TGL-16B),层流超净工作台(YJ-1450苏州净化设备厂),CO2细胞培养箱(日立),0.22 μm 微孔滤膜滤器(美国 Millipore),25 cm2细胞培养瓶(美国Lincoln)。nestin mRNA引物,由TaKaRa公司提供。
1.2 实验方法
1.2.1 脐带MSCs分离、培养及鉴定 取无菌新鲜脐带标本3 cm,以PBS(pH7.4)反洗清洗并冲洗多次,抽掉血管,剪碎脐带组织,以胶原酶37℃消化2 h,2 500 r/min 离心 10 min,取下层沉淀,以 0.25%胰蛋白酶37℃消化20 min,2 500 r/min离心10 min,取沉淀部分,以PBS吹打使悬浮,100 μm的滤网进行过滤,收集滤过液以2 000 r/min离心10 min,取沉淀部分,以PBS洗涤细胞3遍,每遍1 000 r/min离心 10 min,以 1×105/L的密度接种于DMEM培养基(培养体系为DMEM/F12+10%胎牛血清+双抗)中,置于37℃、5%CO2和100%湿度培养箱培养,每3~4 d半量换液1次,细胞接近80%融合时用0.25%胰蛋白酶消化,收集细胞;采用流式细胞仪鉴定MSCs(MSCs不表达造血干细胞的表面特征,而表达 MSCs的标志,即CD44、CD90及CD105阳性,而 CD34、CD45及 HLA-DR 呈阴性)。传代培养至第六代细胞。
1.2.2 脐带MSCs形态及活性观察 细胞行台盼蓝染色倒置相差显微镜观察细胞形态,计数活细胞,活细胞率 =活细胞数/细胞总数×100%。
1.2.3 脐带MSCs nestin mRNA表达检测 采用实时定量PCR法分别检测脐带MSCs原代细胞及第1代、第2代细胞的nestin mRNA表达。引物设计与合成:Nestin引物根据GenBank公布的基因序列,采用引物设计软件Primer5.0设计。cDNA提取:取未培养的原代细胞与培养传代后的第1代、第2代细胞各3×105个作为样本。根据TaKaRa公司的Trizol总RNA提取试剂盒提取 RNA。将8 μL的RNA加入反转录体系合成cDNA,其中5×Prime-Script RT Master Mix(Perfect Real Time)2 μL,总反应体系为10 μL。置入PCR仪中反转录,反转录条件:37 ℃、15 min,85 ℃、5 s。采用 SYBR Premix Ex TaqⅡ荧光染料法进行实时定量PCR扩增。PCR反应体系为20 μL,包括 SYBR premix Ex TaqⅡ(2 ×)10 μL、PCR Forward Primer 0.8 μL、PCR Reverse Rrimer 0.8 μL、ROX Reference Dye(50 × )or DyeⅡ(50 × )0.4 μL、template 2 μL、蒸馏水 dH2O 6 μL;置于实时荧光定量PCR仪中扩增,反应条件:95℃预变性30 s;95℃变性10 s,56℃退火15 s,72℃延伸10 s,循环35次后,72℃延伸10 min。反应结束后直接得到结果,即nestin和管家基因β-actin的ΔCT值,将ΔCT值进行运算得到均值后,再以nestin的 mean ΔCT 除以管家基因 β-actin 的 meanΔCT,得到的数值即为此样本nestin mRNA的相对表达量。
2 结果
2.1 脐带MSCs形态及活性 每根脐带分离到的MSCs为(4.12~6.35)×105个/L,细胞活性为96.63%~99.70%。倒置相差显微镜观察,新鲜分离出的MSCs胞体呈圆形,接种约48 h左右,约1/4的细胞由圆形变为梭形,细胞开始贴壁;72 h后贴壁细胞数量逐渐增多,细胞形态发生明显变化,呈长梭形,排列紧密;7~8 d后梭形细胞数大量增加,细胞趋向簇状生长;培养10 d后,可见1~2个/HP胞体较大、有数个放射状突触的神经样细胞,且形态各不相同,见图1。培养第30 d(传代至第5代),细胞呈不规律生长,无法从形态判断。

图1 培养中成簇状生长和放射样生长的MSCs
2.2 脐带MSCs nestin mRNA表达 见图2。未培养的原代细胞及传代细胞nsetin mRNA均呈阳性表达,原代细胞snestin mRNA相对表达量为2.64±0.42,第1代细胞为 1.71 ±0.19,第 2 代细胞为0.26 ±0.06。
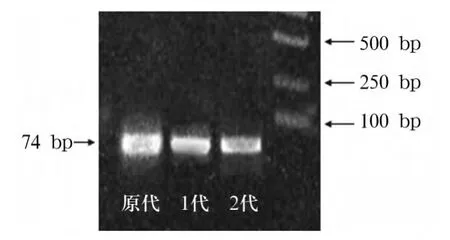
图2 脐带MSCs nestin mRNA表达
3 讨论
国内外研究表明,脐带中的MSCs总量高于血、羊水等组织[3~5],与骨髓血中提取的 MSCs极为相似,同样具备多向分化的潜能[6~8],各国学者关于MSCs分化的机制有许多迥然不同的学说,至今仍然无统一明确的结论[9,10]。nestin属于第Ⅵ型中间丝纤维蛋白,最初被发现普遍存在于神经前体细胞,在增殖能力强、尚未分化的神经前体细胞中高度表达,可调节细胞增殖、分化成熟[11,12]。nestin 在所有中枢神经系统干细胞中均有表达,目前被广泛作为鉴定中枢神经系统干细胞的标记物,以区别分化的神经细胞。然而在很多组织中nestin也有表达,如发育中的肌肉组织、新形成的内皮细胞、胰腺导管的上皮细胞、肝脏的星型细胞等[13]。研究发现,nestin只在一段特定的时间段内表达,然后逐渐减少,最后分别被已分化成神经元的特异中间纤维和星形胶质细胞的胶质纤维酸性蛋白(GFAP)取代[14]。
本研究发现,脐带MSCs呈nestin mRNA阳性表达,其表达量在传代后有明显减少。但表达量的减少并不意味着细胞中神经前体细胞数量的减少,首先,上述变化特点与nestin蛋白在神经前体细胞向神经细胞分化时的变化是一致的;其次,这种变化可能与细胞的横向分化有关,有报道称干细胞具有横向分化特性,造血干细胞在一定条件下也可横向分化为神经干细胞[15],这种不可预测的分化趋势有可能影响nestin mRNA的表达。所以,nestin mRNA表达量的减少可能是上述两种因素的单一或者共同作用。本研究所用基因序列为nestin mRNA引物,可确定这些nstin mRNA表达阳性的细胞中含有神经前体细胞,但其移植后在活体内是否适合作为种子细胞而发挥功能还有待于进一步研究观察。
姚星宇等[16]报道在经诱导的脐血单核细胞中可发现神经样细胞,我们在前期研究发现,相比较而言,如果是相同数量的脐带源细胞与脐血源细胞,脐带中神经样细胞数量较脐血更为丰富,可能与脐血中MSCs含量过少有关。本研究发现,脐带细胞培养8 d后可见少数放射状突起的类似神经样细胞的生长形态,这些突起的形态类似于轴突、树突,传代后仍有类似细胞的出现,但是在传代5次以后,大部分细胞呈上皮样生长或者不规则形态生长,很难再找到神经样细胞,这些神经样细胞除了有放射状突起外,形态各不相同,表明部分MSCs可成长为神经样细胞,不排除MSCs自发分化为神经前体细胞的可能,但这些神经样细胞移植后是否能发挥神经元的功能并不可知。
综上所述,新鲜的脐带组织分离培养的原代细胞有nestin mRNA表达,且传代后该基因仍有表达,提示其存在分化为神经细胞的潜能;尽管传代后表达量有所减少,但仍可作为稳定可靠的细胞供体;同时发现部分MSCs培养时可能出现形态各异的类神经样细胞,说明脐带MSCs中可能存在神经前体细胞,其有可能成为治疗神经系统疾患的种子细胞之一。目前干细胞移植仍有许多不成熟及疑惑之处,首先,未经诱导的MSCs中神经样细胞数量极少,不能达到治疗目的;其次,植入体内的干细胞中nestin基因表达是否会被抑制尚不可知,需动物实验进一步证实。
[1]吴永超,郑启新,谢宗平,等.骨髓间充质干细胞表达神经生长因子和治疗脊髓损伤的研究[J].中华实验外科杂志,2005,22(2):139-141.
[2]王军,范亚珍,陈海,等.脐血单个核细胞诱导的神经干细胞中Foxg1和Nestin基因的表达及其相互关系[J].实用儿科临床杂志,2010,25(11):848-850.
[3]Lee JW,Fang X,Krasnodembskaya A,et al.Concise review:Mesenchymal stem cells for acute lung injury:role of paracrine soluble factors[J].Stem Cells,2011,29(6):913-919.
[4]吴祖泽,贺福初,裴雪涛.造血调控[M].上海:上海医科大学出版社,2000:245.
[5]Kestendjieva S,Kyurkchiev D,Tsvetkova G,et al.Characterization of mesenchymal stem cells isolated from the human umbilical cord[J].Cell Biol Int,2008,32(7):724-732.
[6]Sarugaser R,Lickorish D,Baksh D,et al.Human umbilical cord perivascular(HUCPV)cells:a source of mesenchymal progenitors[J].Stem Cells,2005,23(2):220-229.
[7]Dezawa M,Kanno H,Hoshino M,et al.Specific induction of neuronal cells from bone marrow stromal cells and application for autologous transplantation[J].J Clin Invest,2004,113(12):1701-1710.
[8]齐凯,董丽媛,陈显久.人脐带来源间充质干细胞分离培养方法的优化[J].中国组织工程研究与临床康复,2011,15(23):4220-4224.
[9]Dennis JE,Charbord P.Origin and differentiation of human and murine stroma[J].Stem Cells,2002,20(3):205-214.
[10]Volarevic V,Arsenijevic N,Lukic ML,et al.Concise review:Mesenchymal stem cell treatment of the complications of diabetes mellitus[J].Stem Cells,2011 ,29(1):5-10.
[11]Suzuki S,Namiki J,Shibata S,et al.The neural stem/progenitor cell markernestin is expressed in proliferative endothelial cells,but not in mature vasculature[J].J Histochem Cytochem,2010,58(8):721-730.
[12]冶娟,慕晓玲.人脐带、胎盘间充质干细胞样细胞中“干”性蛋白表达的研究[J].生物医学工程研究,2011,30(4):220-225.
[13]Mokry J,Pudil R,Ehrmann J,et al.Re-expression of nestin in the myocandium of postinfarcted patients[J].VInchows Arch,2008,453(1):33-41.
[14]Lendahl U,Zimmerman LB,McKay RD.CNS stem cells ex-press a new class of intermediate filament protein[J].Cell,1990,60(4):585-595.
[15]Woodbury D,Schwarz EJ,Prockop DJ,et al.Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neuro Res,2000,61(4):364.
[16]姚星宇,张国华,杨丽敏.脐血干细胞中神经样细胞的研究[J].临床神经病学,2013,26(1):41-43.
