大黄牡丹汤含药血清对LPS刺激的小鼠肺巨噬细胞TLR4和MyD88表达的影响
2014-12-02孙燕妮承解静杨晓燕王丽敏
孙燕妮,承解静,杨晓燕,杨 洁,王丽敏,刘 军
(上海中医药大学附属普陀医院,上海200062)
脓毒症是由各种不同病原体及其毒素侵入人体引起的全身炎症反应综合征(SIRS),重症脓毒症的病死率为28%~50%[1]。近年来,中医药对脓毒症炎症介质及其信号转导途径的作用成为重症医学的研究热点。Toll样受体4(TLR4)是G-杆菌脂多糖(LPS)的跨膜受体,目前以LPS-TLR4信号通路为靶点研究其作用的报道不多。2013年1~12月,我们观察了大黄牡丹汤含药血清(以下简称含药血清)对LPS诱导的小鼠肺巨噬细胞TLR4及髓样分化因子88(MyD88)表达的影响,探讨含药血清防治脓毒症的机制。
1 材料与方法
1.1 材料 药物与试剂:大黄牡丹汤[制备方法:取大黄12 g、牡丹3 g、桃仁9 g、冬瓜仁30 g、芒硝9 g;水煎3 次,时间分别为1.5、1 h 和45 min,合并煎煮液后过滤浓缩至高浓度(含生药1.6 g/mL)、中浓度(含生药 0.8 g/mL)、低浓度(含生药 0.4 g/mL),4℃冰箱保存]。LPS购自Sigma公司,TLR4、MyD88多克隆抗体购自Abcan公司,辣根过氧化物酶标记的Ig G购自 Santa cruz公司,Trizol和RTPCR Kit均购自大连TaKaRa生物工程公司。动物与细胞:雄性SD大鼠20只,体质量(250±20)g,由上海西普尔—必凯实验动物中心提供,经普通饲料适应性喂养1周后备用。小鼠RAW 264.7巨噬细胞株购于中科院上海细胞学生物研究所,实验时采用3~5代细胞。
1.2 实验方法
1.2.1 含药血清制备 将20只SD大鼠随机分为正常组及中药高、中、低浓度组,每组5只。中药高、中、低浓度组每天上午 9 时分别予 13.2、6.6 、3.3 g/kg的大黄牡丹汤灌胃,正常组以等量生理盐水灌胃,均连续7 d。末次灌胃(灌药前禁食不禁水12 h)2 h后心脏采血处死,离心后分离血清,合并同组含药血清,56℃水浴30 min灭活,0.22 μm 微孔滤膜除菌过滤后,-80℃保存备用。
1.2.2 细胞分组及干预 将RAW 264.7细胞以1×106个/mL的浓度接种于6孔板中,以含10%FBS的DMEM培养液在37℃ 、5%CO2培养箱中培养18 h,待细胞生长融合成单层后,弃去原培养基,PBS冲冼后分为空白组,模型组及含药血清低、中、高浓度组,每组3个复孔。空白组加入DMEM培养基1 mL;模型组加入DMEM培养基1 mL+LPS 0.5 mL(5 μg/mL);含药血清低浓度组加入含10%低浓度含药血清的DMEM培养基1 mL+LPS 0.5 mL;含药血清中浓度组加入含10%中浓度含药血清的DMEM培养基1 mL+LPS 0.5 mL;含药血清高浓度组加入含10%高浓度药物血清的DMEM培养基1 mL+LPS 0.5 mL。加药后于37℃、5%CO2培养箱中培养24 h,分别收集各组细胞及上清液。
1.2.3 观察项目
1.2.3.1 TLR4、MyD88 mRNA 表达 采用半定量RT-PCR法。所有基因序列均从GenBank中获取,引物用 Primer5.0软件进行设计。Trizol法提取RAW 264.7细胞总RNA,分光光度计测定A260/A280值及其浓度后分别于-80℃保存。MgCl210 μL、dNTP 5 μL、RNase Inhibitor 1 μL、AMV RTase 1 μL、AMV-optimized Taq 1 μL、RNA 模板 1 μg、目的基因上下游引物各 1 μL、GADPH 上下游引物各 1 μL,余以RNase free dH2O补足50 μL反应体系。50℃、30 min,94 ℃、2 min,94 ℃、30 s,56 ℃、30 s,72 ℃、2.5 min,35 个循环,取 RT-PCR 产物20 μL 于1%琼脂糖凝胶上进行电泳分析。采用Flour-S成像仪分析软件测定积分光密度值(IOD值)。
1.2.3.2 TLR4、MyD88 蛋白表达 采用 Western blot法。收集细胞(1×106个/mL),加入1×SDS上样缓冲液裂解细胞,收集细胞蛋白样品,采用BCA法检测蛋白浓度;制备好的蛋白样品置-70℃冰箱保存备用。以60 μg蛋白/泳道上样,行SDS-PAGE电泳分离条带,常规转膜,封闭,TBS/T洗膜,与1∶500稀释的TLR4、MyD88多克隆抗体4℃反应过夜,洗涤,二抗室温下孵育1~2 h,洗涤后X线胶片曝光。图片扫描保存,用凝胶图像处理系统分析每个特异条带的灰度值,计算 TLR4/Beta-actin、MyD88/Beta-actin值(相对表达量)。
1.3 统计学方法 采用SPSS11.0统计软件行统计学分析。数据均用±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1 TLR4、MyD88 mRNA 表达 模型组 TLR4、MyD88 mRNA表达均显著高于空白组;含药血清中、高浓度组表达均显著低于低浓度组及模型组,中、高浓度组间、低浓度组与模型组间表达均无统计学差异。见表1及图1、2。
表1 各组 TLR4、MyD88 mRNA 表达(n=3,IOD 值,±s)

表1 各组 TLR4、MyD88 mRNA 表达(n=3,IOD 值,±s)
注:与空白组比较,★P <0.01;与模型组比较,☆P <0.01;与含药血清低浓度组比较,▲P<0.01;与含药血清中浓度组比较,△P<0.01
TLR4 mRNA MyD88 mRNA空白组 0.331±0.064☆ 0.259±0.021组别☆模型组 0.870±0.062★ 0.776±0.067★含药血清低浓度组 0.779±0.033★ 0.681±0.026★含药血清中浓度组 0.575±0.047★☆▲ 0.483±0.026★☆▲含药血清高浓度组 0.554±0.048★☆▲ 0.469±0.048★☆▲
2.2 TLR4、MyD88蛋白表达 含药血清中、高浓度组TLR4、MyD88蛋白表达均显著低于模型组及低浓度组,中、高浓度组间及低浓度组与模型组间无统计学差异。见表2及图3、图4。
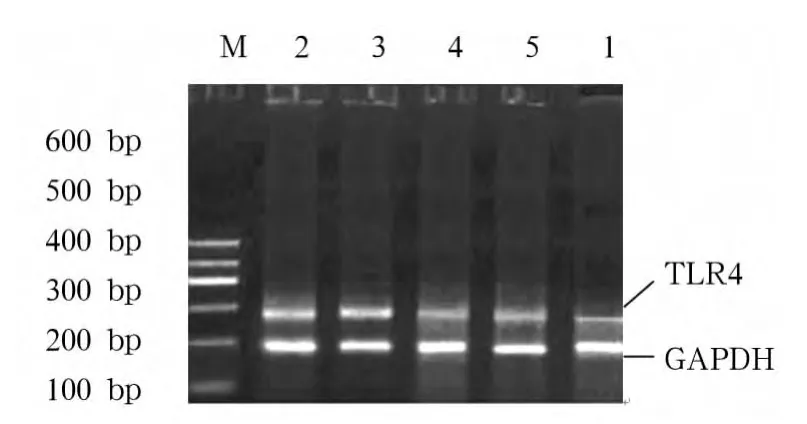
图1 各组TLR4 mRNA表达
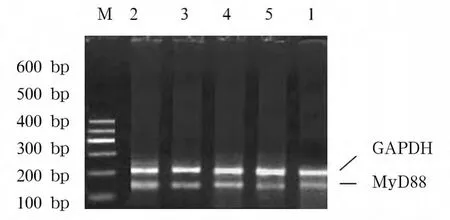
图2 各组MyD88 mRNA表达
表2 各组TLR4、MyD88蛋白表达(n=3,相对表达量, ±s)
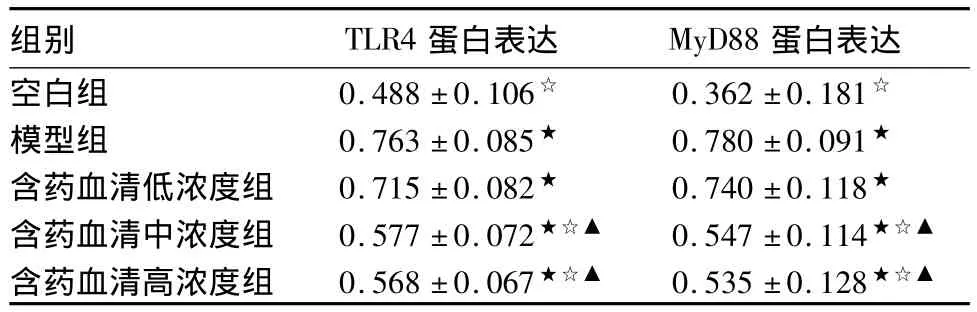
表2 各组TLR4、MyD88蛋白表达(n=3,相对表达量, ±s)
注:与空白组比较,★P <0.01;与模型组比较,☆P <0.01;与含药血清低浓度组比较,▲P<0.01;与含药血清中浓度组比较,△P<0.01
组别 TLR4蛋白表达 MyD88蛋白表达空白组 0.488±0.106☆ 0.362±0.181☆模型组 0.763±0.085★ 0.780±0.091★含药血清低浓度组 0.715±0.082★ 0.740±0.118★含药血清中浓度组 0.577±0.072★☆▲ 0.547±0.114★☆▲含药血清高浓度组 0.568±0.067★☆▲ 0.535±0.128★☆▲
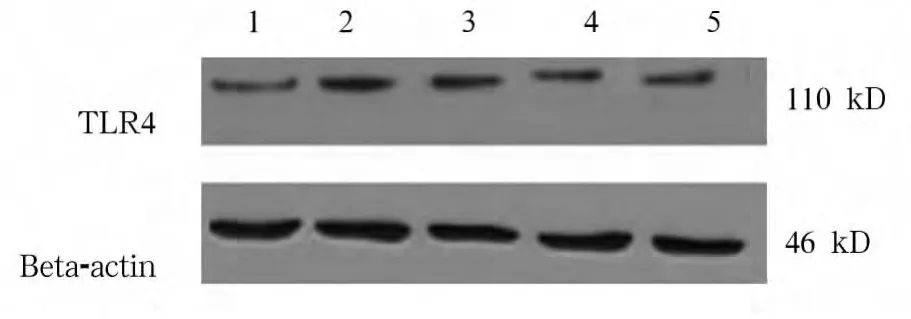
图3 各组TLR4蛋白表达

图4 各组MyD88蛋白表达
3 讨论
严重感染时,病原菌在感染灶大量繁殖并侵入血流形成菌血症,同时释放外毒素及内毒素,后者作用于机体的内皮细胞、中性粒细胞、单核—巨噬细胞、激肽、内啡肽及补体、凝血等系统,诱发多种炎症介质释放,使机体发生炎症反应。在超过50种的炎症介质中,TNF-α、IL-1、IL-6是较为明确的促炎介质,而 IL-4、IL-10、IL-13 及 TGF-β1是较为明确的抗炎介质。炎症反应过强及(或)与抗炎因子的平衡失调及免疫紊乱可导致SIRS发生并逐级放大乃至失控,最终发生严重脓毒症及脓毒性休克[2]。近年来的动物实验表明,TLR4表达量与前炎症因子释放量直接相关,且可通过调控其信号转导通路调节免疫反应,影响脓毒症的发展[3];TLR4作为模式识别受体在自然免疫中发挥重要作用,可识别LPS[4]。研究发现,超过半数的脓毒症为G-杆菌所致[5]。当细菌入血崩解释放内毒素后,其主要成分细胞壁LPS与LPS结合蛋白(LBP)结合,然后通过CD14传递给TLR4/髓样分化蛋白2(MD2)复合体,进一步诱导下游的信号转导[6]。TLR4有两条信号转导通路,即MyD88依赖性反应通路和非MyD88依赖性反应通路。MyD88依赖性途径中参与细胞内信号转导的分子有MyD88、IL-1受体相关蛋白激酶、肿瘤坏死因子受体活化因子6等,最终激活NF-κB;而非MyD88的依赖性途径中参与细胞内信号转导的分子有Toll白介素受体相关调节因子接头分子及Toll白介素受体相关调节因子等,导致干扰素等多种细胞因子的表达,触发一系列瀑布样炎症反应,最终导致SIRS、MODS 的发生[7]。LPS 是 G-菌外膜的主要成分,是TLR4的特异性激动剂,不激动其他TLRs[8],TLR4基因缺失或突变可以导致细胞对LPS的反应性严重缺失[9]。鉴此,本研究采用纯化LPS作为TLR4激动剂刺激RAW264.7。
祖国医学将脓毒症归为“外感热病”范畴,针对其病因、病机提出“菌毒并治”的中西医结合治疗原则,总结了脓毒症治疗的“三证三法”,即血瘀证用活血化瘀法、毒热证用清热解毒法、急性虚证用扶正固本法[10]。大黄牡丹汤源于《金匮要略》,由大黄、芒硝、桃仁、丹皮、冬瓜仁组成,具有泻热破瘀、散结消肿之功效。方中大黄苦寒攻下,泻热逐瘀,荡涤肠中湿热瘀结之邪;丹皮苦辛微寒,能清热凉血、活血散瘀,两药合用,泻热破瘀,共为君药;芒硝咸寒,泻热导滞,软坚散结,助大黄荡涤实热,使之速下;桃仁活血破瘀;合丹皮散热消肿,共为臣药;冬瓜仁甘寒滑利,清肠利湿,引湿热从小便而去,是为佐药。全方合泻下、清热、破瘀于一体,临床上被广泛用于急性阑尾炎、急性胆囊炎,急性胰腺炎,腹膜炎、急慢性盆腔炎等多种炎症性疾病。临床研究发现[11~13],大黄牡丹汤能明显降低急腹症患者外周血内毒素含量,改善预后;能抑制LPS刺激的巨噬细胞过度分泌细胞因子IL-1和TNF-α,打断细胞因子网络的恶性循环,从而达到免疫调节作用;能调节SIRS炎症反应与抗炎症反应系统之间的平衡。本课题组以往证实,大黄牡丹汤可抑制脓毒症肺损伤大鼠血清及肺组织中NF-κB表达;可下调促炎介质TNF-α、IL-6表达,上调抗炎介质IL-10表达,促进免疫平衡;还可抑制肺组织髓过氧化物酶活性,减轻肺组织病理改变,保护肺组织。现代药理学研究证实,大黄素的作用靶点是LPS受体复合物部位。大黄素抑制炎症反应的机制有[14]:①抑制核因子 IκBa、IκKa 和IκKr的磷酸化从而抑制NF-κB的转位,使LPS诱导的炎性因子的表达减少;②抑制MAPKs信号通路的活化,从而影响相关炎性因子的表达;③高剂量时还可抑制JNK的磷酸化。
本研究结果显示,模型组TLR4、MyD88表达均显著高于空白组,含药血清中、高浓度组TLR4和MyD88表达均显著低于模型组,证实抑制TLR4和下游MyD88表达是大黄牡丹汤治疗脓毒症的作用机制之一。
总之,针对G-细菌LPS引起的脓毒性休克可利用分子生物学手段在TLR4胞外段的不同水平阻断Toll激活的信号传递,有望给内毒素休克的治疗带来突破。深入研究细胞信号转导和基因转录水平干预LPS诱导的炎症和损伤效应,提供新的靶点和治疗措施,对于创伤、感染和多器官功能衰竭的研究具有重要意义。
[1]Dellinger RP,Levy MM,Rhodes A,et al.Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock,2012[J].Intensive Careed,2013,39(2):165-228.
[2]高戈,冯拮,常志刚,等.2012国际严重脓毒症及脓毒性休克诊疗指南[J].中华危重病急救医学,2013,25(8):501-505.
[3]Tsujimoto H,Ono S,Efron PA,et al.Role of Toll-1ike receptors in the development of sepsis[J].Shock,2008,29(3):315-321.
[4]Ni H,Zhao W,Kong X,et al.Celastrol Inhibits Lipopolysaccharide-Induced Angiogenesis by Suppressing TLR4-Triggered Nuclear Factor-Kappa B Activation[J].Acta Haematol,2013,131(2):102-111.
[5]Martin GS,Mannino DM,Eaton S,et al.The epidemiology of sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348(16):1546-1554.
[6]Re F,Strominger JL.Separate functionaI domains of human MD-2 mediate Toll-like receptor 4-binding and lipopolysaccharide responsiveness[J].J Immunol,2003,171(10):5272-5276.
[7] Putra AB,Nishi K,Shiraishi R,et al.Jellyfish collagen stimu lates production of TNF-α and IL-6 by J774.1 cells through activation of NF-κB and JNK via TLR4 signaling pathway[J].Mol Immunol,2013,58(1):32-37.
[8]Gioannini TL,Teghanemt A,Zhang DS,et al.Isolation of an endotoxin-MD-2 complex that produces Toll-like receptor 4-dependent cell activation at picomolar concentrations[J].PNAS,2004,101(12):4186-4191.
[9]Poltorak A,Smirnova I.Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice:mutations in tlr4 gene[J].Science,1998,282(5396):2085-2088.
[10]中国中西医结合学会急救医学专业委员会.脓毒症中西医结合诊治专家共识[J].中华危重病急救医学,2013,25(4):194-197.
[11]戚坚永.中西医结合治疗外科急腹症内毒素血症[J].浙江中西医结合杂志,2005,15(5):267-268.
[12]谢艺,崔华雷,王晓晔,等.腹膜炎大鼠肺泡巨噬细胞分泌IL-1、TNF-a的变化及大黄牡丹皮汤的调节作用[J].临床小儿外科杂志,2007,6(2):44-45.
[13]胡宗德,张雅萍,贺卫,等.大黄牡丹皮汤对创伤后全身炎症反应综合征的治疗作用[J].上海中医药杂志,2006,40(12):20-22.
[14]Li D,Zhang N,Cao Y,et al.Emodin ameliorates lipopolysaccharide-induced mastitis in mice by inhibiting activation of NF-κB and MAPKs signal pathways[J].Eur J Pharmacol,2013,705(1-3):79-85.
