两种碘化丙啶染色DNA定量方法检测HL-60细胞凋亡结果的比较
2014-12-02徐晓雪户乃丽孙丽娜
徐晓雪 户乃丽 孙丽娜 孔 璐
(1.首都医科大学医学实验与测试中心,北京100069;2.首都医科大学基础医学院药理学系,北京100069;3.首都医科大学基础医学院生物化学与分子生物学系,北京100069)
碘化丙啶(propidium iodide,PI)是插入性核酸染料,直接插入双链核酸的2个碱基对之间,每5个碱基插入1个荧光分子,与核酸的结合均匀、稳定。细胞经过RNA酶处理后,PI可以与细胞内DNA特异性结合,在流式细胞仪上经488 nm激光激发,发出峰值610~620 nm的荧光,可以准确的反映细胞群体中DNA含量的分布情况,适用于DNA定量检测。根据细胞周期中不同时项DNA的变化来检测细胞周期中DNA合成前期(G0/G1期)、DNA合成期(S期)与DNA合成后期(G2期)各时项的细胞比例。因为PI是适用于所有流式细胞仪的染料,这一染色技术在临床肿瘤诊断和医学科研中被普遍的采用,常规使用的染色方法是包括固定、RNA酶处理、PI饱和染色3个关键步骤的3步法PI染色技术[1]。在一些研究中,当细胞在生理或病理条件下发生了凋亡,DNA损伤,细胞内DNA降低,也可以采用3步法PI染色检测亚G1峰(也称作凋亡峰),用于凋亡细胞比例和特征的分析[2]。但是在实际应用中,由于凋亡时相的不同,当凋亡细胞中DNA损伤部分没有完全脱出细胞时,往往检测不到明确可辨的亚G1峰,敏感度较低。作为细胞凋亡检测的经典方法之一的彗星检测[3],以细胞在电泳移动中DNA的迁移形态作为凋亡的特征指标,此技术中比较关键的一步即采用碱性高渗试剂使凋亡细胞中断裂的DNA碎片脱出细胞,从而在电泳迁移中呈现出彗星尾样的拖痕,本课题组利用类似方法,用高渗缓冲液作用于固定后的悬浮细胞,使凋亡细胞内断裂DNA较彻底的脱出细胞外,再进行DNA定量检测,提高对细胞凋亡的识别度和敏感性[4]。
本实验以DNA合成抑制剂喜树碱作用于对数生长期的HL-60细胞,促进细胞凋亡,并用Annexin V标记流式检测确认细胞凋亡存在,比较了常规PI单色DNA定量检测法与渗透法PI单色DNA定量检测法检测正常和凋亡细胞样品的结果,同时对各组细胞进行了形态学观察。
1 材料和方法
1.1 材料
对数生长期HL-60细胞由首都医科大学化学生物学与药学院化学生物学系提供;1 mmol/L喜树碱溶液(Sigma公司,美国);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)Annexin V染色试剂(BD公司,美国);10×Annexin V结合缓冲液(BD公司,美国);70%(体积分数)乙醇溶液(蒸馏水配制,4℃预冷);磷酸氢钠-柠檬酸缓冲液(DNA抽提缓冲液,pH 7.8,192 mL 0.2 mol/L Na2HPO4,8 mL 0.1 mol/L 柠檬酸,4℃保存);0.002%RNAse溶液(2 mg RNAse,0.1 mL Triton X-100,100 mL PBS,pH 7.2 ~7.4,新鲜配制);0.05%PI染液(5 mg PI,0.1 mL Triton X-100,10 mL PBS,pH 7.2~7.4,于4℃避光保存);EPICS@XL流式细胞仪(贝克曼公司,美国);TIS倒置荧光显微镜(尼康公司,日本)。
1.2 方法
1.2.1 分组
取对数生长期HL-60细胞以1×105/mL的密度接种于3个6孔板,每孔接种1.5 mL,用含体积分数为10%胎牛血清的RPMI-1640培养基在5%(体积分数)CO2,37℃,饱和湿度的细胞培养箱内培养48 h,其中9孔细胞作为正常培养对照,另外9孔细胞中各加入5 μL,1 mmol/L喜树碱溶液,继续培养2 h。分别收集各孔细胞,得到18个同步培养细胞样品,取正常培养和刺激凋亡细胞各1例,进行FITC Annexin V标记凋亡检测,验证凋亡的存在,再将剩余16例样品各自充分混匀后平均分入两管,得两两一对的共32例样品,分为4组,分别是正常培养细胞常规染色组,正常培养细胞渗透染色组,刺激凋亡细胞常规染色组,刺激凋亡细胞渗透染色组。
1.2.2 实验步骤
1)凋亡检测:对正常细胞和刺激凋亡细胞同时进行FITC Annexin V标记凋亡检测。样品离心,弃去上清,细胞计数,各取单细胞悬液含有3×105个细胞,加入5 μL Annexin V-FITC染液,充分混合,避光,室温下孵育10 min,同时取相同量细胞加入5 μL PBS充分混合,避光,室温下孵育10 min,作为未染色对照。再向样本和对照管中分别加入10倍稀释的结合缓冲液500 μL,避光,室温下孵育5 min,全程采用无菌操作,流式细胞仪检测。
2)PI染色DNA含量分析:样品固定:将单细胞悬液充分吹打加入盛有5 mL 4℃ 70%(体积分数)乙醇的离心管中,充分混匀,置于4℃冰箱中固定4 h以上。洗涤:固定细胞离心弃去固定剂。对渗透处理染色组细胞增加磷酸氢钠-柠檬酸缓冲液浸洗步骤:加入1 mL磷酸氢钠-柠檬酸缓冲液,室温孵育10 min,300 g(相对离心力单位,g=9.8 m/s2)离心5 min,弃上清,加入PBS充分混匀。RNA酶处理:将洗涤后弃去上清的各组细胞悬液各加入1 mL RNA酶溶液,37℃反应30 min,置于室温冷却。PI染色:向试管中加入0.1 mL PI染液,染色30 s,流式细胞仪检测,Multicycle软件进行周期分析。
3)显微镜观察:每例PI染色标本在荧光倒置显微镜下进行形态学观察,采集相差和荧光叠加图像,同时显示细胞结构和荧光标记情况。
1.3 统计学方法
各组DNA含量分析所得数据使用SPSS 12.0统计软件进行分析,数据描述采用均数±标准差(±s)表示,将两种不同染色方法检测相同样品得到的结果的百分数值进行配对t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 活细胞凋亡检测结果
以流式细胞仪FITC通道检测Annexin V标记情况,在FITC横坐标荧光直方图中,选取荧光高于对照样品的细胞为阳性细胞群,P2门代表凋亡细胞。对照细胞P2=0.1%,正常细胞样品P2=2.6%,刺激凋亡细胞样品P2=31.7%。结果见图1。

图1 活细胞凋亡检测结果Fig.1 FITC Annexin V apoptosis analyse
2.2 流式DNA含量分析结果
如图2所示,A、B为正常HL-60细胞的两种方法DNA定量结果,C、D为刺激凋亡细胞的两种方法DNA定量结果,各组数据统计分析结果详见表1,对于正常细胞两种方法检测结果差异无统计学意义,对于刺激凋亡细胞两种方法检测结果差异有统计学意义。
2.3 荧光显微镜观察结果
镜下可见(图3)细胞经过RNA酶处理后细胞核形态清晰,PI染色明确。常规染色法:正常细胞组细胞呈聚集分布,胞膜光滑、完整,胞核圆形,染色均匀,可见分裂项,胞质可见;渗透染色法:正常细胞组呈单个分布,胞膜光滑、完整,胞核圆形,染色均匀,可见分裂项;常规染色法:刺激凋亡组细胞呈聚集分布,胞膜褶皱增多,稍不完整,染色较均匀,分裂项形态不清晰;渗透染色法:刺激凋亡细胞组呈单个分布,部分细胞发生胞膜皱缩、包膜破裂,胞核皱缩或松散,核染色变淡或染色区缩小,可见空细胞。
3 讨论
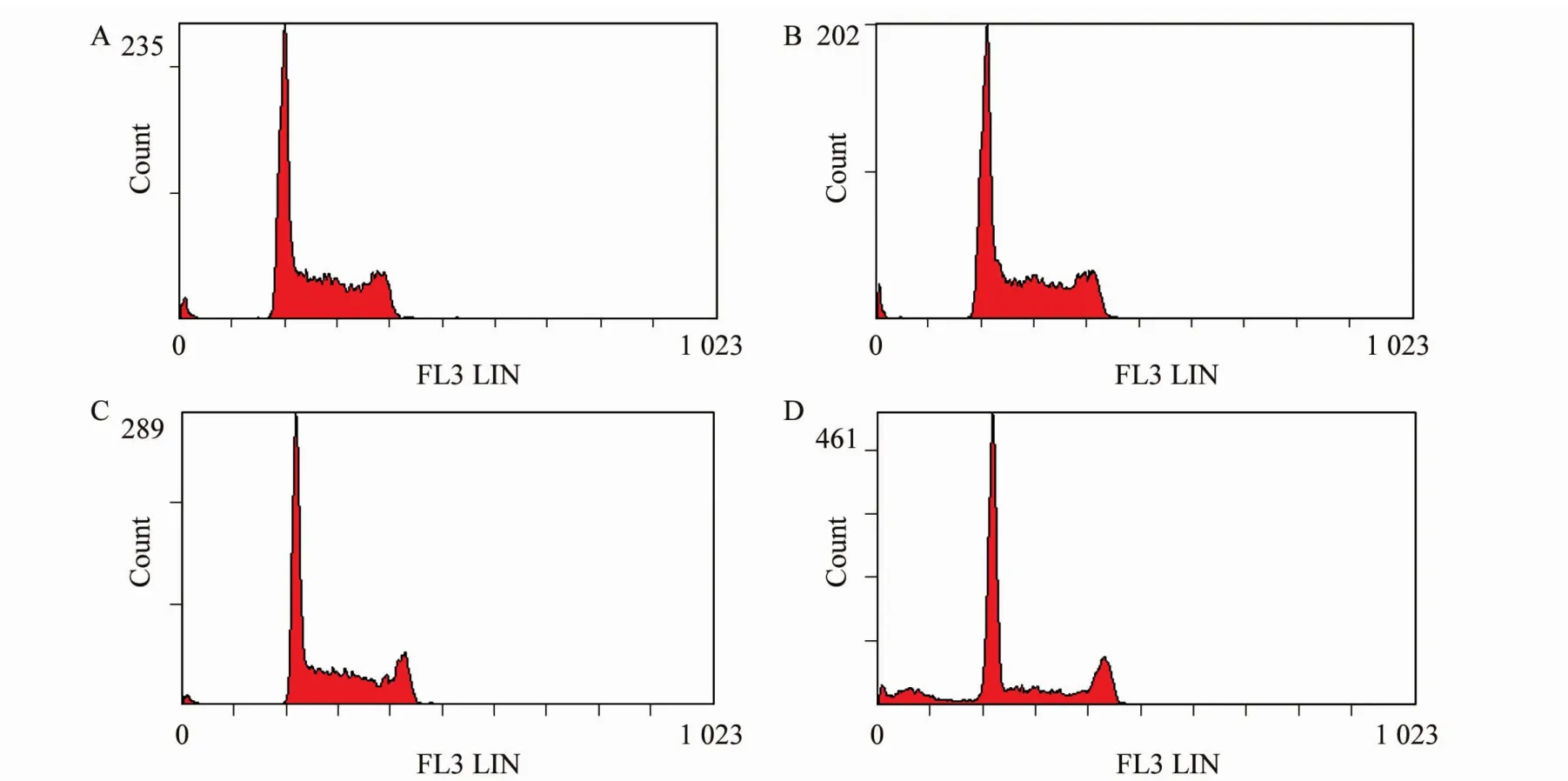
图2 DNA含量直方图Fig.2 DNA content histograms of corresponding
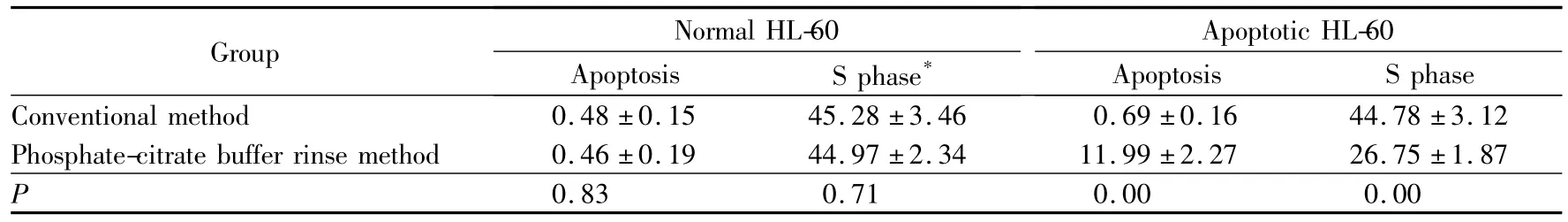
表1 各组DNA含量分析数据统计结果Tab.1 The statistical analysis of the data of DNA content analysis (%)

图3 PI染色HL-60细胞相差与荧光叠加图像Fig.3 Phase contrast and fluorescence overlay photographys of HL-60 cells stained with PI
作为DNA定量检测的经典方法的PI染色法被认为可以作为观察细胞凋亡的重要手段之一,但是由于致凋亡因素、凋亡程度及细胞自身条件的差异,仅采用PI 3步法DNA定量检测难以清晰的呈现凋亡特有的亚G1峰,更多的时候可见凋亡细胞的细胞周期出现不规则变化,主要的原因可能在于经过固定凋亡细胞DNA损伤后的DNA碎片不能自由的脱出细胞外,造成DNA下降不明显,对于发生在S期和G2/M期的凋亡尤其如此,即使是发生在G0G1期的凋亡,也有可能仅表现为G0G1峰的变异度增加,而无法检测到凋亡峰的存在。
为了增加PI染色法对凋亡的敏感程度,人们做过很多尝试[4],其中包括采用延时检测,等待DNA自然脱出细胞后识别亚G1峰的方法,但随意性大、可靠度低,并且无法控制,且受样品凋亡的不同阶段限制,效果不一。本试验中的柠檬酸缓冲液即利用类似渗透原理,作用于固定后的悬浮细胞,经过渗透压的变化,结合洗涤,使凋亡细胞内已断裂的DNA松解后较彻底的脱出细胞外,再进行DNA定量检测,由于其对正常细胞DNA含量没有影响,所以可以明显提高对细胞凋亡的识别度和敏感性。从形态学观察中也看到渗透染色后刺激凋亡组细胞出现了较为多样的改变,这可能和细胞所处周期时项不同及凋亡后变化多样有关,但总体上可以发现细胞的胞膜在处理中都被保存,但细胞的核染色质降低,另外与正常染色组比较胞质明显减少。
本实验中用Annexin V标记活细胞凋亡检测结果高于经磷酸氢钠-柠檬酸缓冲液渗透后的PI染色检测到的凋亡百分比,这可能是由于染色原理不同造成的凋亡检测时项不同,Annexin V特异性与细胞表面磷酯酰丝氨酸结合,在细胞凋亡早期即可出现特征性的膜磷酯酰丝氨酸外翻,较DNA反应更早出现。但是Annexin V标记法更适合于活细胞样品检测,无法对储存样品进行检测,并且试剂价格相对昂贵,操作要求无菌,受结合缓冲液中成分影响较大,结果不可重复[5]。
本文介绍的磷酸氢钠-柠檬酸缓冲液渗透后PI染色DNA定量法具有流式实验快速、准确、定量的特点,并且具有经典PI染色DNA定量分析方法简便、经济、适用范围广,可检测储存样品的优点,不仅适用于科研,也可以用于快速检测临床患者的血液、骨髓等样本,对于化学治疗患者细胞损伤情况的检测有一定意义[4,6-7]。由于采用了渗透抽提断裂DNA的步骤,检测的准确度明显提高,与传统方法比较提高了对凋亡细胞的识别敏感度,又保留了传统DNA定量检测的全部优点。这一DNA抽提的方法与DNA凝胶电泳以及彗星检测的技术原理类似,检测的敏感度相当,所适用的凋亡或DNA损伤程度也相当。实验中需要注意的是有些细胞由于DNA脱出可能形成空细胞,在流式图中表现为细胞群体中DNA含量极低的有形颗粒,这些也应计入凋亡细胞。
此检测方法也有不足,在有些损伤条件下如果原G2M期细胞DNA含量稍许降低后并不一定会出现在低于G1峰的位置,也可能藏于G1-G2M期内,造成凋亡比例的低估,在具体操作中较好的解决方法是对比两种检测方法的检测结果,未经抽提的细胞更多的提示损伤或凋亡细胞所处的周期时相,渗透抽提后发生变化的部分提示凋亡细胞的比例,两者对应可以大体判断凋亡的细胞周期时相和比例。
对于喜树碱致凋亡HL-60细胞模型,经过高渗溶液DNA碎片抽提的PI单色DNA定量检测法能够更为清晰准确的呈现出细胞周期中的凋亡峰,同时对正常细胞DNA定量检测没有明显影响,将两种细胞的检测结果对比可以初步推断本试验中细胞凋亡发生在细胞周期的S期时相。
[1] Darzynkiewicz Z.Critical aspects in analysis of cellular DNA content[J].Curr Protoc Cytom,2011,Chapter 7:Unit 7.2.
[2] Wlodkowic D,Telford W,Skommer J,et al.Apoptosis and beyond:cytometry in studies of programmed cell death[J].Methods Cell Biol,2011,103:55-98.
[3] 晋艺聪,洪帅,焦玉国.单细胞凝胶电泳检测DNA损伤的方法及应用[J].中央民族大学学报:自然科学版,2010,19(4):17-21.
[4] Wlodkowic D,Skommer J,Darzynkiewicz Z.Cytometry of apoptosis.Historical perspective and new advances[J].Exp Oncol,2012,34(3):255-262.
[5] Trahtemberg U,Atallah M,Krispin A,et al.Calcium,leukocyte cell death and the use of annexin V:fatal encounters[J].Apoptosis,2007,12(10):1769-1780.
[6] Zhang H Y,Hormi-Carver K,Zhang X,et al.In benign Barrett's epithelial cells,acid exposure generates reactive oxygen species that cause DNA double-strand breaks[J].Cancer Res,2009,69(23):9083-9089.
[7] 高枫,符兆英.天然产物诱导肿瘤细胞凋亡作用机制的研究进展[J].中华肿瘤防治杂志,2011,18(7):557-560.
