二苯乙烯苷对PD模型小鼠干预作用的观察及机制初探
2014-12-02张如意吴燕川
张如意 张 丽 吴燕川 李 林*
(1.首都医科大学宣武医院药物研究室 北京市老年病医疗研究中心 神经变性病教育部重点实验室,北京100053;2.首都医科大学宣武医院中心实验室,北京100053)
帕金森病(Parkinson’s disease,PD)是最常见的老年神经退行性疾病之一,以震颤、僵直和运动不能为主要临床表现。目前PD的治疗主要为多巴胺(dopamine,DA)替代疗法,但长期应用后药物产生不良反应,疗效随时时间延长而逐渐减弱。随着老龄化社会的进展,PD患者不断增加,研制新的PD防治药物具有重要的现实意义。
二苯乙烯苷(2,3,5,4’-tetrahydroxystilbene-2-O-β-D-glucoside,TSG)是传统中药何首乌的主要有效成分,具有抗氧化、抗衰老、调节细胞凋亡等作用[1-2]。前期的研究[3]发现TSG在体外通过增强线粒体功能、降低氧化应激途径来减少N-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium,MPP+)引起的神经元死亡。鉴于线粒体功能障碍和氧化应激在PD发病中的重要作用,根据前期的细胞实验结果,本研究拟采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)制备拟 PD 小鼠模型,观察TSG对多巴胺能神经元的保护作用,并探讨其可能的作用机制。
1 材料与方法
1.1 药物与试剂
TSG由首都医科大学宣武医院药物研究室自行研制,从何首乌中提取,纯度70%,实验中采用干粉剂量,溶于蒸馏水制成药液,4℃保存。MPTP、辛烷磺酸钠盐(octyl sulfate sodium salt,OSA)、多巴胺(dopamine,DA)、二羟基苯乙酸(dihydroxyphenylacetic acid,DOPAC)、高香草酸(homovanillic acid,HVA)、二羟基苯甲胺(3,4-dihydroxybenzylamine,DHBA)均购自美国Sigma公司。高氯酸购自北京化学试剂公司。甲醇为天津四面体化工厂色谱纯试剂。
1.2 主要仪器
小鼠爬杆测定装置和小鼠自主活动程序仪(CS-2型)购自中国医学科学院药物研究所;小鼠转棒式疲劳仪(YLS-4C型)购自济南益延科技发展有限公司;高效液相色谱仪为美国ESA公司产品;高速冷冻离心机(T21型)为美国杜邦公司产品。
1.3 实验动物及分组
C57BL小鼠,雄性,SPF级,体质量18~22 g,购自北京维通利华实验动物技术有限公司,实验动物许可证号:SCXK(京)2011-0011。MPTP直接溶于无菌0.9%(质量分数)氯化钠注射液中,调节其终质量浓度为3 mg/mL。小鼠应用数字表法随机分为4组。对照组:蒸馏水灌胃2周后,腹腔注射与模型组等容积的0.9%(质量分数)氯化钠注射液5 d;模型组:蒸馏水灌胃2周后,MPTP 30 mg/kg连续腹腔注射5 d;TSG小剂量组和大剂量组:分别灌胃给予TSG 60 mg/kg和120 mg/kg 2周后,MPTP 30 mg/kg连续腹腔注射5 d。
1.4 小鼠爬杆实验
参照秦博文等[4]的方法略作修改:给予MPTP腹腔注射前2 d,先进行小鼠爬杆训练,引导动物10 s内由杆顶爬至杆底,每只每天训练3次。正式测定时,记录给予MPTP腹腔注射1 h后各组小鼠的爬杆时间,连测5 d,取均值。具体测定方法为:持小鼠尾部,将其头向下置于杆顶部(以小鼠双后肢置于球上为准),让其自然爬下,记录小鼠自杆顶至双前肢接触杆底平台所需时间。
1.5 小鼠自发活动记数测定
参照参考文献[5]的方法应用自主活动程序仪测定小鼠自发活动记数。当计算机进入测定程序后,将小鼠放入高13 cm、直径25 cm活动箱中,由计算机自动记录小鼠活动情况,测定每只小鼠5 min内的活动次数。
1.6 小鼠转棒实验
参照Liu等[6]的方法略作修改:测定开始前3 d对小鼠进行转棒训练,每日上、下午各1次,训练时间3 min。正式测定时,给予MPTP腹腔注射后70 min测定小鼠在转棒上的停留时间,测定时间3 min,转速10 r/min,连续测定3 d,取均值进行统计学处理。
1.7 高效液相色谱法对脑组织单胺类神经递质及其代谢产物的测定
小鼠MPTP腹腔注射5 d后,断头处死,取纹状体,冻于-80℃冰箱。参照Rekha等[7]的方法进行样品处理和测定。样品处理:纹状体组织准确称质量,按照1∶10的比例加入0.4 mol/L高氯酸,制备组织匀浆,高速冷冻离心机12 000 g/min,4℃离心15 min。取上清,再次于12 000 g/min,4℃离心15 min。取上清10 μL,应用高效液相色谱电化学法测定各组大鼠纹状体内多巴胺。标准品配制:标准品溶于流动相中,使用时稀释到10 ng/mL,进样量10 μL。色谱条件:安捷伦公司碳十八反相色谱柱,洗脱液:70 mmol/L乙酸钠,50 mmol/L柠檬酸,100 μmol/L乙二胺四乙酸二钠,200 μmol/L辛烷磺酸钠盐,10%甲醇。调pH为4.1,过滤脱气后使用,流量1.0 mL/min。检测器工作电压0.5 V,测定温度29℃。
1.8 免疫组织化学法检测酪氨酸羟化酶(tyrosine hydroxylase,TH)阳性细胞
每个实验组取3只小鼠进行黑质处病理切片实验。小鼠经4%多聚甲醛灌注固定。组织行冠状面切片,片厚40 μm。抗原修复后,组织片用3%H2O2室温孵育10 min,PBS缓冲液充分洗涤。10%羊血清室温孵育30 min,加入一抗(稀释度为1∶1 000),4℃孵育过夜。PBS液充分洗涤。加入生物素标记的兔二抗(稀释度为1∶200),37℃水浴箱中保温2 h,PBS液充分洗涤。加入辣根过氧化物酶标记的三抗(稀释度为1∶200),37℃水浴箱保温60 min,PBS液充分洗涤。DAB显色,梯度乙醇脱水,二甲苯透明,中性树胶封片。阴性对照的设立:以PBS缓冲液代替一抗行免疫组织化学染色,其余步骤同前。
1.9 统计学方法
数据应用SPSS 16.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 TSG对MPTP模型小鼠爬杆时间的影响
爬杆时间反映小鼠的协调运动能力。动物协调性好,则自杆顶向下爬所需时间短。如图1所示,MPTP模型组小鼠爬杆时间与正常对照组相比明显延长(P<0.01),TSG大剂量用药组小鼠爬杆时间比模型组缩短(P<0.01),差异有统计学意义,但与对照组相比差异无统计学意义。TSG小剂量用药组小鼠爬杆时间与对照组相比延长,差异有统计学意义(P<0.01),与模型组相比差异无统计学意义。
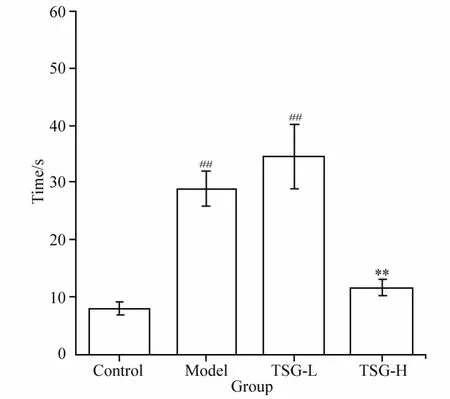
图1 TSG对MPTP模型小鼠爬杆时间的影响Fig.1 Effect of TSG on pole test in MPTP model mice
2.2 TSG对MPTP模型小鼠转棒实验的影响
以转棒实验测试各组小鼠运动协调性。实验结果显示,MPTP模型组小鼠在棒时间较对照组显著缩短(P<0.01),TSG大剂量用药组小鼠与对照组比,其在棒时间缩短(P<0.05),却可延长造模后小鼠的在棒时间(P<0.05),差异有统计学意义,详见图2。TSG小剂量用药不能延长小鼠在棒时间。
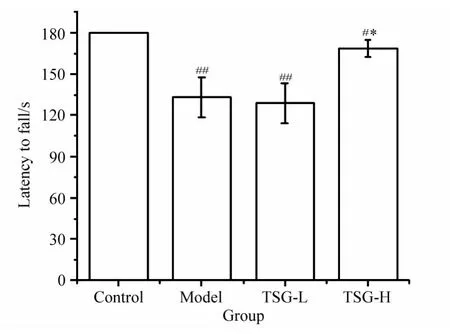
图2 TSG对MPTP模型小鼠转棒实验的影响Fig.2 Effect of TSG on Rota rod test in MPTP model mice
2.3 TSG对MPTP模型小鼠自主活动次数的影响
自主活动次数反映了动物的随意运动能力。如图3所示,MPTP模型组小鼠与正常对照组相比,自主活动次数减少,差异有统计学意义(P<0.01)。TSG高剂量用药组小鼠自主活动虽较对照组减少(P<0.01),但却较模型组增加(P<0.01),差异有统计学意义。
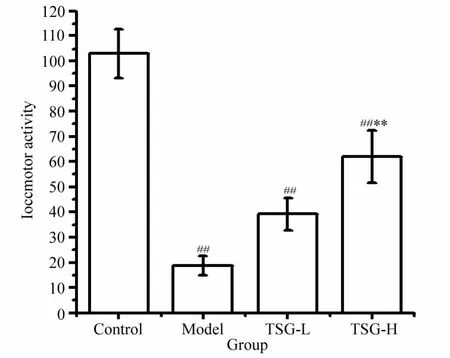
图3 TSG对MPTP模型小鼠自主活动的影响Fig.3 Effect of TSG on spontaneous movement in MPTP model mice
2.4 TSG对MPTP模型小鼠纹状体内多巴胺及其代谢产物含量的影响
应用高效液相色谱电化学法检测小鼠脑纹状体内多巴胺及其代谢产物的质量浓度。如图4所示,MPTP模型组小鼠脑纹状体内DA及其代谢产物DOPAC和HVA的质量浓度较对照组都降低,差异有统计学意义(P<0.01),TSG大剂量用药组与对照组相比,DA和DOPAC的质量浓度虽降低,但与模型组小鼠相比则有增加,差异均有统计学意义(P<0.01,P <0.05)。

图4 TSG对MPTP模型小鼠脑纹状体内多巴胺及其代谢产物含量的影响Fig.4 Effect of TSG on level of dopamine and its metabolites in striatum of MPTP model mice
2.5 TSG对MPTP模型小鼠黑质酪氨酸羟化酶阳性细胞的影响
应用免疫组织化学法检测的结果如图5所示,与正常对照组相比,MPTP模型组小鼠黑质TH阳性神经元数量较对照组减少,差异有统计学意义(P<0.01)。TSG大剂量用药组小鼠黑质处TH阳性细胞数量与对照组相比下降,但较模型组显著增加,差异有统计学意义(P<0.05)。
3 讨论
本研究采用的MPTP腹腔注射模型被公认是理想的PD动物模型之一,已被广泛用于PD发病机制及药物作用机制的研究[8]。本研究中,重复给予MPTP腹腔注射可以引起小鼠的行为异常,模型小鼠出现尾僵直、竖毛、自主活动减少等,其持续时间一般约为4~6 h。而TSG用药组小鼠的症状表现较轻,持续时间较短。为了客观评价药物的作用,本研究采用了爬杆实验、转棒实验和自主活动记数多种行为学联合的检测方法。结果显示,模型组小鼠运动协调性下降,表现为爬杆时间延长,转棒实验中的在棒时间缩短;同时,模型小鼠出现显著的自主活动减少。TSG用药组小鼠的行为学与模型组相比有明显的改善。
PD的主要病理改变是黑质多巴胺能神经元的进行性变性死亡,导致纹状体多巴胺含量降低,乙酰胆碱系统功能相对亢进,丘脑-皮质反馈活动和皮质发出的随意运动受到过度抑制,导致患者出现运动和非运动症状[9]。多巴胺及其代谢产物减少是PD的主要神经生物化学改变指标。中脑黑质纹状体DA的测定是衡量治疗PD是否有效的最客观指标[10]。TH是多巴胺生物合成中的限速酶,被作为多巴胺能神经元的特异性标志物。因此,本研究应用高效液相色谱法检测了DA及其代谢产物,应用免疫组织化学染色法检测黑质处TH阳性神经元的改变,以期评价TSG的神经保护作用。实验结果显示,模型组小鼠黑质处TH阳性神经元的数量较对照组明显减少,纹状体处DA及其主要的降解产物DOPAC和HVA都有显著的下降。以上结果表明,拟PD模型小鼠黑质-纹状体中DA能神经元损伤明显,经黑质-纹状体通路投射到纹状体的DA神经递质减少,从而引起纹状体内DA、DOPAC和HVA降低。TSG用药后,小鼠黑质处TH阳性神经元数量较模型组有明显的增加,纹状体中DA和DOPAC都有增加,HVA有一定程度的升高,但差异无统计学意义。在PD患者残存的DA神经元内,主要通过B型单胺氧化酶(monoamine oxidase B,MAO-B)将DA催化降解成 DOPAC。杨秀伟等[11]的研究显示,何首乌醇提物可能通过抑制MAO-B的活性而影响脑DA降解代谢,从而提高DA及DOPAC的质量浓度。结合本试验结果,笔者推测,TSG可能通过保护和激发残留 DA神经元的功能,抑制MAO-B的活性,提高DA神经元摄取血中的酪氨酸,保护和提高TH的活性,促进DA生成,在此基础上进一步改善模型动物的运动协调性,增强模型小鼠的自主活动能力。

图5 TSG对MPTP小鼠黑质TH阳性细胞的影响Fig.5 Effect of TSG on counts of TH positive neurons in substantia nigra(SN)of MPTP model mice
氧化应激-自由基学说在PD的发病机制中占有重要的地位[12]。目前,在天然药物中寻找减少脑部氧化应激,具有保护神经细胞的抗PD药物成为研究热点[13]。Li等[14]的研究发现 TSG 具有较强的抗氧化作用。本课题组前期的研究[15]表明TSG能够增高老年大鼠海马区神经生长因子及其受体质量浓度,具有神经元保护作用。综上所述,TSG可能具有防治神经退行性疾病如PD的应用价值。
[1] Ryu G,Ju J H,Park Y J,et al.The radical scavenging effects of stilbene glucosides from Polygonum multiflorum[J].Arch Pharm Res,2002,25(5):636-639.
[2] 王蓉,赵志炜,张丽,等.参乌胶囊及其有效成分二苯乙烯苷对老年大鼠海马神经元突触体素表达的影响[J].首都医科大学学报,2010,31(1):60-64.
[3] Sun F L,Zhang L,Zhang R Y,et al.Tetrahydroxystilbene glucoside protects human neuroblastoma SH-SY5Y cells against MPP+-induced cytotoxicity[J].Eur J Pharmacol,2011,660(2-3):283-290.
[4] 秦博文,董丽萍,卢思英,等.育真熄风汤对MPTP诱导PD模型小鼠行为学的影响[J].河北医学,2014,20(9):1482-1485.
[5] Vogel H G,Vogel W H.药理学实验指南-新药发现和药理学评价[M].杜冠华,李学军,张永祥,译.北京:科学出版社,2001:267-325.
[6] Liu J,Wang H,Zhang L,et al.S100B transgenic mice develop features of Parkinson's disease[J].Arch Med Res,2011,42(1):1-7.
[7] Rekha K R,Selvakumar G P,Sethupathy S,et al.Geraniol ameliorates the motor behavior and neurotrophic factors inadequacy in MPTP-induced mice model of Parkinson's disease[J].J Mol Neurosci,2013,51(3):851-862.
[8] 兴桂华,王晓丽,丛欢,等.镇肝熄风汤对帕金森病模型小鼠神经行为学及黑质14-3-3、酪氨酸羟化酶表达的影响[J].中国实验方剂学杂志,2013,19(21):190-193.
[9] 安子薇,李建民,吴庆文,等.帕金森病康复治疗研究新进展[J].中国煤炭工业医学杂志,2013,16(5):851-853.
[10]郝晋东,王梅康,夏红杰,等.天麻素对PD模型大鼠纹状体 DA、DOPAC、HVA 含量的影响[J].北京中医药,2009,28(6):463-465.
[11]杨秀伟.何首乌醇提物对易老化小鼠肝脏和脑单胺氧化酶活性的影响[J].中国中药杂志,1996,21(1):48-50.
[12] Dias V,Junn E,Mouradian M M.The role of oxidative stress in Parkinson's disease[J].J Parkinsons Dis,2013,3(4):461-491.
[13]马成,马龙,RAUSCH Wolf-dieter.大花罗布麻对MPTP型小鼠的多巴胺能神经保护作用研究[J].中国药理学通报,2010,26(3):379-400.
[14]Li X,Li Y,Chen J,et al.Tetrahydroxystilbene glucoside attenuates MPP+-induced apoptosis in PC12 cells by inhibiting ROS generation and modulating JNK activation[J].Neurosci Lett,2010,483(1):1-5.
[15]王蓉,蔡彦宁,赵志炜,等.参乌胶囊及其有效成分二苯乙烯苷对老年大鼠海马区神经生长因子及其受体表达的影响[J].中国比较医学杂志,2013,23(6)16-21.
