人脂肪间充质干细胞体外诱导为肝脏样细胞的试验研究
2014-12-02张云巍徐丽娟王淑芳
张云巍 徐丽娟 王淑芳 阎 丽*
(1.解放军总医院南楼临床部消化内科,北京100853;2.解放军总医院输血科干细胞实验室,北京100853)
我国是一个乙型肝炎大国,肝炎病毒携带率高达10%[1];随着经济发展和生活方式的改变,大量饮酒所致的酒精性肝病呈逐年上升趋势;近年来保健、减肥药物的使用以及药物的滥用,药物性肝病逐年上升;随着环境污染的加重,自身免疫性肝病、遗传性肝病也呈逐年上升趋势。这些数目巨大的肝病患者,在经历一定时间后绝大部分将会发展成为慢性肝病,甚至肝硬化。常规的内科治疗虽能改善其临床症状,却不能逆转肝细胞数量日益减少所导致的肝功能的逐渐减退。目前,原位肝移植(orthotropic liver transplantation,OLT)是治疗该病最有效手段,但由于存在供肝缺乏、免疫排斥、手术风险、费用昂贵等诸多因素,限制了其在临床的广泛应用[2]。干细胞在再生领域所取得的巨大进展为慢性肝病的治疗提供了新的视角。
干细胞是一类具有多向分化潜能的多能干细胞,广泛分布于骨髓[3]、肌肉[4]、脐带血[5]、外周血[6]、脂肪[7-12]等器官和组织中,能跨胚层分化为骨细胞、脂肪细胞、心肌细胞、神经细胞等。Zuk等[13-14]的研究证明人的脂肪组织中含有间充质干细胞,将其称为人脂肪来源的干细胞(human adipose-derived mesenchymal stem cells,hADSCs),根据脂肪间充质干细胞表面标志、基因表达以及多向分化潜能,表明该细胞具有与骨髓间充质干细胞相似的生物特性[14-16]。脂肪间充质干细胞具有取材方便,患者痛苦小,体外扩增迅速等优点,而且在细胞治疗的应用上,在含量[13]及分化能力[17-19]上较骨髓间充质干细胞有一定的优势。2005年,Seo等[20]报道脂肪间充质干细胞在相关生长因子及细胞因子的作用下,于体外能被诱导为具有白蛋白合成功能及分泌尿素功能的肝脏样细胞。这预示着,脂肪间充质干细胞有望成为肝病细胞治疗理想的种子细胞。
本课题通过胶原酶消化离心法从脂肪组织中获取脂肪间充质干细胞,研究其生长特性、表面标志及多向分化潜能,并在体外探索诱导其向肝脏样细胞分化。有望为以细胞治疗为基础的再生医学提供理想的干细胞来源,为生物性人工肝及肝组织工程提供种子细胞,进而为终末期肝病及急性肝衰竭患者的治疗带来新希望。
1 材料和方法
1.1 材料
1)仪器:倒置显微镜为日本Olympus公司产品,流式细胞仪为美国BD公司产品,CO2培养箱为日本Sanyo公司产品。
2)试剂:胰蛋白酶(EDTA)、双抗均为美国 Hyclone公司产品;DMEM(Dulbecco's Mldified Eagle's Medium)培养基、胎牛血清、磷酸盐缓冲液(phosphate buffer solution,PBS)缓冲液、胰岛素转铁蛋白硒(Insulin-Transferrin-Selenium,ITS)均为美国 Gibco公司产品;Ⅰ型胶原酶、地塞米松、胰岛素、吲哚美辛、维生素C、1-甲基3-异丁基-黄嘌呤、β-甘油磷酸钠、油红O染色试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒、二甲基亚砜(dimethylsulfoxide,DMSO)、牛血清白蛋白、庆大霉素、Triton(聚乙二醇辛基苯基醚),山羊血清均为美国Sigma公司产品;人表皮细胞生长因子(human epidermal growth factor,HEGF)为美国Lonza公司产品。激活素A、成纤维细胞生长因子4(fibroblast growth factor-4,FGF-4)、FGF-1、肝细胞生长因子(hepatocyte growth factor,HGF)、抑瘤素(Oncostatin M,OSM)均为美国Peprotech公司产品;中性甲醛为天津生物制药公司产品。鼠抗人CD13-PE单克隆抗体、鼠抗人CD73-PE单克隆抗体、鼠抗人CD34单克隆抗体、鼠抗人CD45-FITC单克隆抗体、鼠抗人HLADRPE单克隆抗体均为美国Chemicon公司产品;鼠抗人HepPar-1单克隆抗体为北京中杉金桥公司产品。
1.2 方法
1)人脂肪干细胞提取:人脂肪组织取自在协和整形外科医院接受腹部吸脂手术和皮肤瘢痕切除术的患者,术前均已签订知情同意书,并经医院伦理委员会通过。干细胞分离方法参考Safford等[21]的实验方法。具体如下:将获取的脂肪组织用75%乙醇泡30 s,足量的含5%双抗的4℃ PBS液彻底洗涤10 min,去除肉眼可见的血管及皮肤组织;眼科剪剪碎<1 mm3。用3倍于脂肪组织的含有1 mg/mLⅠ型胶原酶PBS培养基消化并置于摇床上持续轻轻摇晃2~3 h,加入等量含10%胎牛血清的低糖DMEM终止消化;室温孵育10 min,900 g离心10 min。去掉上清及未完全消化的脂肪组织,用5 mL含10%FBS(fetal bovine serum)的 DMEM重悬,80目尼龙筛网过滤,900 g离心10 min。弃上清,用2 mL PBS重悬沉淀1 min,900 g离心5 min。去掉上清,加入2 mL含10%FBS的DMEM重悬沉淀1 min,再以140目过滤,收集滤液。
2)细胞培养:倒置显微镜下计数细胞,以1×104/cm2的密度接种于25 mm透气培养瓶中,置于5%CO2、37℃、100%饱和湿度的培养箱中培养,第3天首次换液,以后每3~4 d半量换液1次;待细胞生长达90%融合时,用含有EDTA的0.25%胰蛋白酶,并以1∶2密度传代扩增。
3)细胞增生能力、表面抗原及多向分化潜能检测:细胞增生能力检测:取第5代细胞,接种于24孔板,每孔含4×103个细胞;每天用含有EDTA(ethylene diamine tetraacetic acid)的0.25%胰蛋白酶消化3孔,离心后制成细胞悬液,在倒置显微镜下,用细胞计数板计数,取其平均数,以细胞生长的天数为横坐标、细胞数量为纵坐标绘制细胞生长曲线。
细胞表面抗原检测:取生长状态良好的第5代hADSCs,胰酶消化,用PBS制成浓度1×106/mL的细胞悬液。向5个离心管中分别加入100 μL细胞悬液并分别加入大鼠抗人 CD13-PE、CD73-PE、CD34、CD45-FITC、HLA-DRPE 单抗各 10 μL,4 ℃ 避光孵育30 min,流式细胞仪检测。
多向分化潜能检测:取生长良好的第5代hASCs,以1×105/cm2的浓度接种于2个6孔板中,标记为实验组和对照组;加入含10%胎牛血清的hASCs生长培养基2 mL,24 h细胞贴壁后,实验组换成成脂诱导培养基和成骨诱导培养基,对照组仍为hASCs生长培养基,以后每3~4 d换液1次。成脂诱导采用细胞油红O染色方法检测,成骨诱导采用细胞ALP染色方法检测。
4)向肝脏样细胞诱导:取生长良好的第5代细胞,以1×105/cm2的浓度接种细胞,24 h细胞贴壁后,试验组加入含20 ng/mL激活素A(Activin A),20 ng/mL FGF-4的第一阶段培养基,3天后更换为含20 ng/mL EGF,5 μL/mL 庆大霉素,150 ng/mL HGF,100 ng/mL FGF-1,225 ng/mL FGF-4,20 ng/mL 制瘤素 M(OSM),0.35 μL/mL 地塞米松,0.5 mg/mL 牛血清白蛋白,1 μL/mL 1×胰岛素转铁蛋白硒(ITS)的第二阶段培养基,对照组一直使用hASCs生长培养基。
5)RT-PCR法检测诱导细胞的基因表达:收集2组细胞,提取细胞RNA,反转录;RNA反转录体系混匀后,30 ℃ 5 min,42 ℃ 60 min,99 ℃ 灭活5 min,获得的cDNA保存在-20℃。cDNA由特定引物(见表1)按PfuDNA聚合酶试剂盒说明书体系,PCR反应体系如下:10 ×Buffer 2.5 μL,Dntp 0.5 μL,上游引物 1 μL,下游引物 1 μL,PFU 0.3 μL,cDNA 1 μL,水 18.7 μL。反应条件:95℃ 10 min,40循环(95℃ 10 s,60℃ 30 s,72℃ 30 s)最后72℃延伸5 min。结果取5 μL产物,经琼脂糖凝胶电泳分析检测。

表1 RT-PCR所用引物序列及产物Tab.1 The primer sequences and product
6)PAS染色法检测诱导细胞的糖原合成情况:采用PAS染色法检测肝脏样细胞糖原合成功能,具体如下:将制备的爬片用高碘酸氧化10 min;PBS清洗2次,5 min;Schiff试剂染15 min,避光反应;水洗;苏木素复染,镜下观察。
7)细胞免疫组织化学方法:10%的中性甲醛于室温下固定15 min,0.25%的TritonX-100打孔液于室温下通透,PBS清洗3次;然后用10%NGS封闭2 h,滴加第一抗体,4℃冰箱过夜。自冰箱中取出湿盒,室温放置30 min,PBS清洗3次;滴加相应2抗,DAB(1∶20)显色,适时终止,苏木素复染,镜下观察。
2 结果
2.1 原代培养细胞形态
新鲜分离的hADSCs呈较均一的圆形(图1A);24 h后可见少量细胞贴壁(图1B),无明显的形态变化;培养至第3天,可见纺锤状细胞出现(图1C);培养至第4、5、6天,可见纺锤状细胞不断增多(图1D、E、F);培养至第7天,可见原代细胞生长融合达70%(图1G);培养至第8天可见细胞整合达90%以上,细胞呈成纤维细胞样生长,旋涡状、辐射状排列(图1H)。
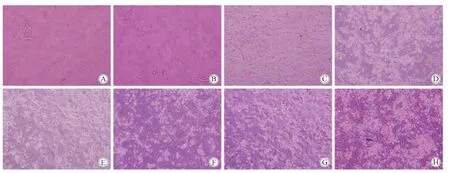
图1 hADSCs细胞形态观察Fig.1 hADSCs cell morphology
2.2 细胞生长曲线
细胞在前2天生长较缓慢,第3天时细胞进入对数生长期,第6天细胞进入生长平台期,继续培养,细胞数量未增加,生长呈停滞状态,细胞计数单位为103个/cm2(图2)。
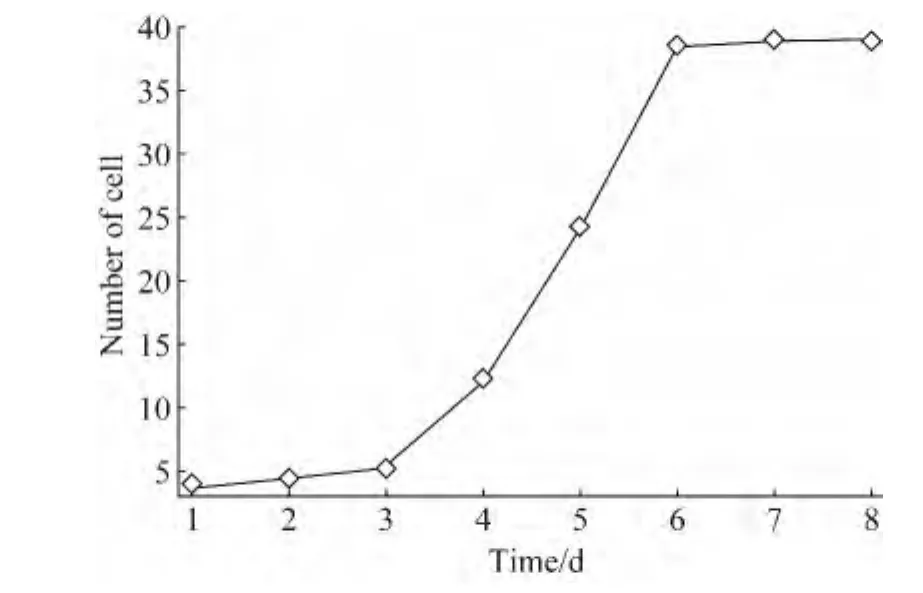
图2 hADSCs生长曲线图Fig.2 hADSCs growth curves
2.3 细胞表面抗原测定
流式细胞仪检测第5代 hADSCs表面抗原,99.7%的细胞表达CD13,99.9%的细胞表达CD73,两个干细胞表面抗原呈高表达状态;而仅有4.0%的细胞表达CD34,0.1%的细胞表达CD45,0.2%的细胞表达HLA-DR(图3)。
2.4 细胞多向分化潜能测定结果
成脂诱导至第3周,绝大部分实验组细胞质被脂滴充满,脂滴经油红O染色后呈鲜红色(图4A),而对照组无阳性表达(图4B);成骨诱导2周,可类似钙结节的物质出现,ALP染色,实验组细胞胞质中出现黑色颗粒(图4C),而对照组无黑色颗粒出现(图4D)。
2.5 诱导细胞的形态学变化
实验组细胞在诱导前呈长梭形、成纤维细胞样生长,第一阶段诱导至第2天,细胞形态开始出现改变(图5A);第一阶段诱导至第3天时,部分细胞逐渐由长梭形变成长椭圆形、类圆形及多角形(图5B),第二阶段诱导至第6、10、13天时,向类圆形细胞转化的细胞逐渐增加,呈肝脏样细胞生长(图5C、D、E),而对照组细胞仍保持成纤维细胞的形态,无形态变化(图5F)。
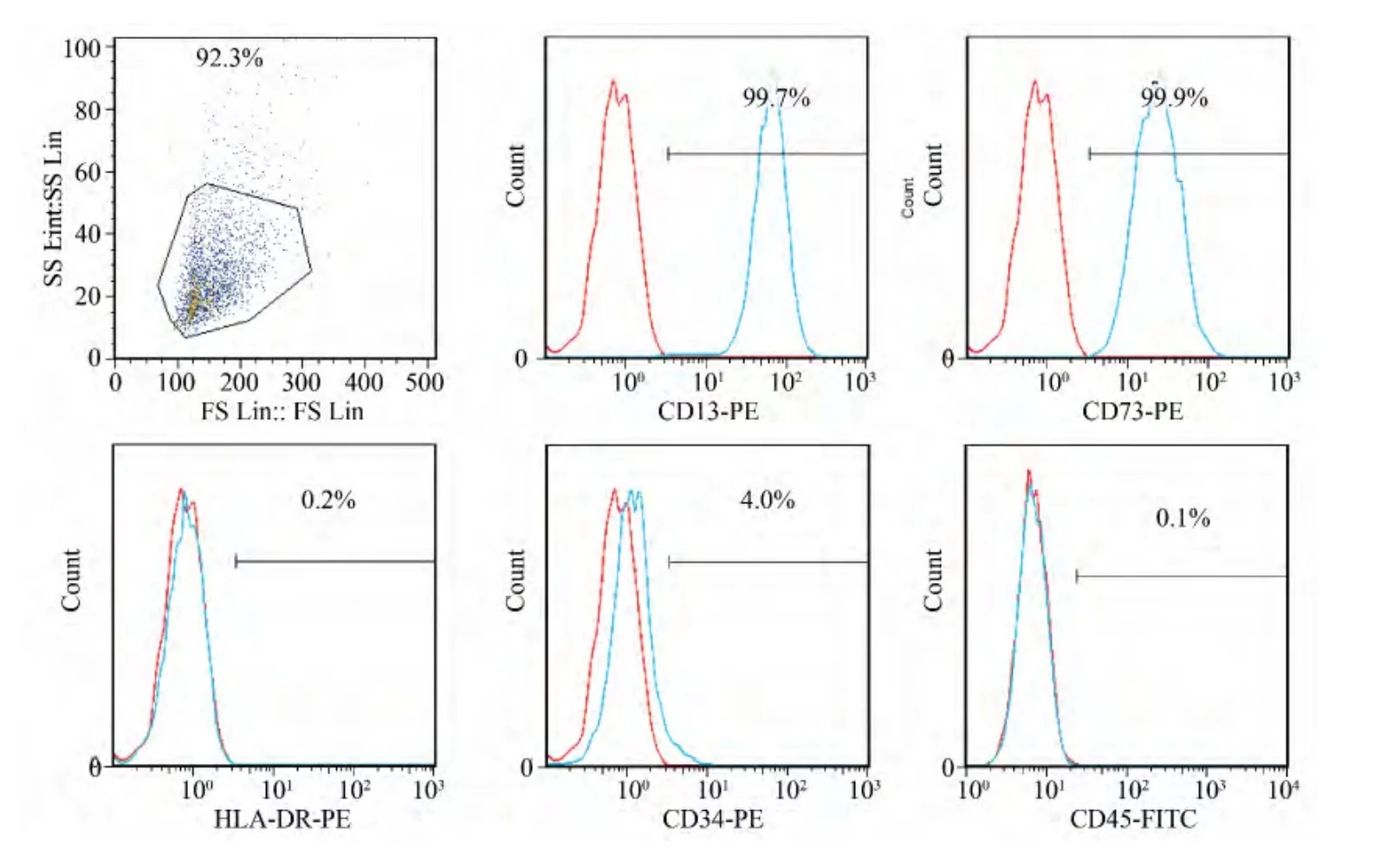
图3 hADSCs表面抗原表达情况Fig.3 hADSCs surface antigen expression
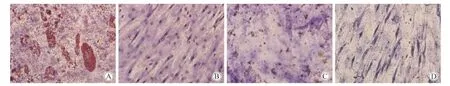
图4 油红O染色及ALP染色Fig.4 Oil red O staining and ALP staining(400 × )

图5 诱导细胞的形态学观察Fig.5 Induced cell morphology(400 × )
2.6 RT-PCR法检测细胞的肝细胞相关基因表达
第二阶段诱导结束时,收集2组细胞RNA,RTPCR法检测,结果发现,实验组肝脏样细胞均检测到AFP、ALB、CYP3A4肝细胞相关基因的表达,而未经诱导的对照组细胞不表达AFP、CYP3A4,但表达ALB,不过表达强度要弱于实验组(图6)。
2.7 细胞免疫组织化学
HepPar-1抗体识别的抗原存在于正常人肝细胞和大多数的肝细胞癌中,绝大多数的肝细胞癌为阳性表达,是肝细胞相关的特异性抗体,也是现今病理科肝脏肿瘤鉴别与研究的重要指标。甲胎蛋白AFP抗体用于检测由肝细胞合成的糖蛋白抗体,可用于标记肝癌细胞;角蛋白CK18、19抗体用于检测肿瘤及细胞是否为上皮源性。这4个抗体的相关抗原,均存在于肝脏样细胞的胞质中。实验组细胞经第二阶段诱导至第13天时,经细胞免疫组化法检测可见胞质中有HepPar-1、AFP、CK18、CK19 抗体表达(图 7A、B、C、D),与阳性对照组的肝癌细胞表达一致(图7E、F、G、H),但阴性对照组细胞则为阴性表达(图 7I、J、K、L)。
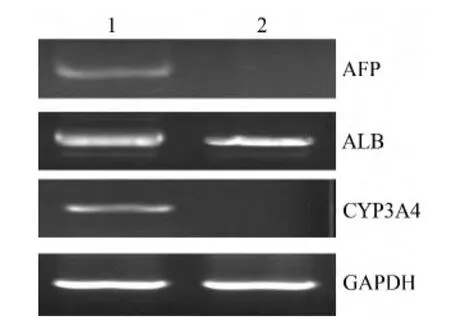
图6 实验组(1)和对照组(2)肝细胞标志物(AFP、ALB、CYP3A4)的 mRNA 表达Fig.6 The mRNA expression of liver cell markers(AFP,ALB,CYP3A4)of the experimental group(1)and the control group(2)
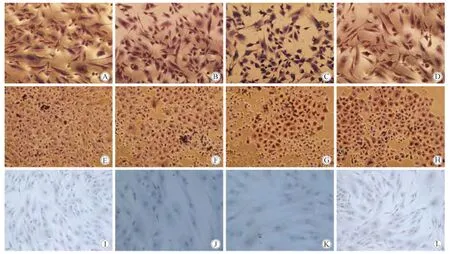
图7 细胞免疫组织化学示肝细胞相关抗原表达情况Fig.7 The liver-associated antigen expression detected by cell immunohistochemistry(200 × )
2.8 PAS染色法检测肝脏样细胞的糖原合成功能
取诱导结束细胞,行PAS染色,可见细胞质被染成红色,胞核为蓝色(图8A),诱导后的肝脏样细胞生成了糖原类的物质,而对照组细胞则呈阴性表达(图8B)。

图8 PAS染色检测细胞的糖原合成功能Fig.8 The glycogen synthesis by capacity detected by PAS staining(200×)
3 讨论
目前,国内外文献[2]报道可获得具有肝脏功能的细胞的途径主要有:①肝细胞的原代培养[22];②胚胎、脐血干细胞体外诱导[23-24];③IPS(induced pluripotent stem cell)细胞体外诱导[25];④成体干细胞经体外诱导[26-29]。然而,上述几种途径既能避免伦理限制、又能通过体外大量扩增获得安全性高的肝脏样细胞的方法只有通过成体干细胞体外诱导。近年来,大量文献[30-35]报道了不同组织来源的成体干细胞体外均能被诱导成肝脏样细胞,包括骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)、外周血单核细胞(peripheral blood mononuclear cell,PBMCs)、脂肪干细胞(adipose tissue derived stem cells,ADSCs)、肝脏原位干细胞(HSL)等。目前仅有少数文献[36-38]报道了脂肪来源干细胞在体外可诱导成肝脏样细胞。
2001年,Zuk等[14]发现在脂肪组织中含有一种与BMSCs来源于同一胚层的,具有相近生物学性质的间充质干细胞,可以发育成正常的软骨和肌肉细胞等,并将这种细胞称为脂肪源性间充质干细胞(adipose tissue derived stem cells,ADSCs)。与其他成体干细胞相比,ADSCs取材容易,损伤小,可多次抽取;细胞数量多,体外增生速度快,且具有稳定的倍增能力、低水平衰老。目前获得hADSCs方法主要采用Ⅰ型胶原酶密度梯度离心法。本研究参考上述试验方法,将脂肪组织与含有1 mg/mLⅠ型胶原酶PBS混合后,在室温下,置于摇床上持续轻轻摇晃2~3 h,而并非于37℃下摇晃1 h;离心后得到大量成纤维样细胞。结果显示细胞数量并无明显减少,而且体外培养显示细胞生长良好,很大程度上降低了分离hADSCs的试验要求,扩大了应用范围。
在肝脏再生过程中起重要作用的细胞因子很多,目前应用最广泛的是 HGF[39-40]和 FGF-4[9,20]。HGF主要在肝脏枯否细胞(Kupffer)与肝窦内皮细胞中产生。当其浓度小至1 ng/mL时,对肝细胞就有促进有丝分裂作用,是正常肝细胞最强的促有丝分裂剂;它的另一重要作用就是能增加细胞的能动性[20]。Wang等[41]、张刚庆等[42]分别用 HGF 诱导大鼠骨髓 MSC,分化,均证明较高浓度HGF可诱导大鼠骨髓间充质干细胞分化为肝样细胞。Schwartz等[43]观察了许多细胞因子(包括 aFGF、bFGF、FGF-4、HGF、FGF-7和OSM等),发现只有FGF-4和HGF能诱导骨髓来源干细胞向肝细胞分化,认为FGF-4也许在内皮特化方面起重要作用,而HGF则能诱导非活跃增生状态的肝细胞分化,通过二者的共同调控,HMSC的分化被激活从而分化为肝脏样细胞。本研究采用二阶段培养法,采用 HGF、FGF-4作为诱导剂,联合应用 EGF、OSM、DMSO等因子,促脂肪间充质干细胞在体外向肝脏样细胞分化,在诱导第3天时,部分细胞开始出现形态学的改变,由长的梭形生长成为类圆形或多角形;在诱导至第13天时,类圆形细胞进一步增多,经鉴定诱导的细胞具有肝脏样细胞的功能。
本研究找到了一种经济简便的实验室分离培养脂肪干细胞的方法,为以后探索hADSCs的大量培养、纯化的最佳条件和定向分化诱导提供实验基础。尽管对诱导分化的肝细胞的功能尚需进一步检测,但从本研究的实验结果,笔者初步认定ADSCs具有向肝脏样细胞分化的能力。ADSCs体外培养、诱导分化的成功,可以通过体外单纯的培养环境,研究肝脏干细胞分化过程的调控机制,认识其发生发育规律,为肝病的细胞治疗提供细胞来源。本课题通过Ⅰ型胶原酶密度梯度离心法从脂肪组织中分离脂肪间充质干细胞,研究其形态特点、表面标志及多向分化潜能,并研究诱导成功的肝脏样细胞的生物学功能及表面标志。有望为生物性人工肝及肝组织工程提供种子细胞,为以细胞治疗为基础的再生医学提供理想的干细胞来源,进而为终末期肝病及急性肝衰竭患者的治疗带来新希望。
[1] Liu J,Fan D.Hepatitis B in China[J].Lancet,2007,369(9573):1582-1583.
[2] Dhawan A,Puppi J,Hughes R D,et al.Human hepatocyte transplantation:current experience and future[J].Nat Rev Gastroenterol Hepatol,2010,7(5):288-298.
[3] Okura H,Komoda H,Saga A,et al.Properties of hepatocyte-like cell clusters from human adipose tissue-derived mesenchymal stem cells[J].Tissue Eng Part C Methods,2010,16(4):761-770.
[4] Zaret KS,Grompe M.Generation and regeneration of cells of the liver and pancreas[J].Science,2008,322(5907):1490-1494.
[5] Terry C,Hughes R D,Mitry R R,et al. Cryopreservationinduced nonattachment of human hepatocytes: role of adhesionmolecules[J]. Cell Transplant, 2007, 16( 6) : 639-647.
[6] Thomson J A,Itskovitz-Eldor J,Shapiro S S,et al.Embryonic stem cell lines derived from human blastocysts[J].Science,1998,282(5391):1145-1147.
[7] Gallicano G I,Mishra L.Hepatocytes from induced pluripotent stem cells:a giant leap forward for hepatology[J].Hepatology,2010,51(1):20-22.
[8] Lee K D,Kuo T K,WhangPeng J,et al.In vitro hepatic differentiation of human mesench-ymal stem cells[J].Hepatology,2004,40(6):1275-1284.
[9] Snykers S,Vanhaecke T,Papeleu P,et al.Sequential exposure to cytokines reflecting-embryogenesis:the key for in vitro differentiation of adult bone marrow stem cells into functional hepatocyte-like cells[J].Toxicol Sci,2006,94(2):330-341,discussion:235-339.
[10] Lee M J,Jung J,Na K H,et al.Anti-fibrotic effect of chorionic plate-derived mesenchymal stem cells isolated from human placenta in a rat model of CCl(4)-injured liver:potential application to the treatment of hepatic diseases[J].J Cell Biochem,2010,111(6):1453-1463.
[11] Shin K S,Lee H J,Jung J,et al.Culture and in vitro hepatogenic differentiation of placenta-derived stem cells,using placental extract as an alternative to serum[J].Cell Prolif,2010,43(5):435-444.
[12] Lagasse E,Connors H,Al-Dhalimy M,et al.Purified hematopoietic stem cellscandifferentiate into hepatocytes in vivo[J].Nat Med,2000,6(11):1229-1234.
[13] Zuk P A,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[14]Zuk P A,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[15] di Bonzo L V,Ferrero I,Cravanzola C,et al.Human mesenchymal stem cells as a twoedged sword in hepatic regenerative medicine:engraftment and hepatocyte differentiation versus profibrogenic potential[J].Gut,2008,57(2):223-231.
[16] Chen Y,Dong X J,Zhang G R,et al.In vitro differentiation of mouse bone marrow stromal stem cells into hepatocytes induced by conditioned culture medium of hepatocytes[J].J Cell Biochem,2007,102(1):52-63.
[17] Matsunaga T,Sakamaki S,Kohgo Y,et al.Recombinant human granulocyte Colony-stimulating factor can mobilize sufficient amounts of peripheral blood stem cells in healthy volunteers for allogeneic transplantation[J].Bone Marrow Transplant,1993,11(2):103-108.
[18]Kasai M,Kiyama Y,Kawamura A.Application of peripheral blood stem cells(PBSC)mobilized by recombinant human granulocyte colony stimulating factor for allogeneic PBSC transplantation and the comparison of allogeneic PBSC transplantation and bone marrow transplantation[J].Transfus Apher Sci,2002,26(2):121-127.
[19] Conget P A,Min guell J J.Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells[J].J Cell Physiol,1999,181(1):67-73.
[20] Seo M J,Suh S Y,Bae Y C,et al.Differentiation of human adipose stromal cells into hepatic lineage in vitro and in vivo.Biochem[J].Biophys Res Commun,2005,328:258-264.
[21]Safford K M,Hicok K C,Safford S D,et al.Neurogenic differentiation of murine and human adipose-derived stromal cells[J].BiochemBiophys Res Commun,2002,294:371-379.
[22]Lee R H,Kim B,Choi Iet al.Characterization and expression analysis of mesenchymal stem cells from human bone mar-row and adipose tissue[J].Cell Physiol Biochem,2004,14(4-6):311-324.
[23] Katz A J,Tholpady A,Tholpady S S,et al.Cell surface and transcriptional characterization of human adipose-derived adherent stromal(hADAS)cells[J].Stem Cells,2005,23(3):412-423.
[24]Gronthos S,Franklin D M,Leddy H A,et al.Surface protein characterization of human adipose tissue-derived stromal cells[J].J Cell Physiol,2001,189(1):54-63.
[25]Kern S,Eichler H,Stoeve J,et al.Comparative analysis of mesenchymal stem cells from bone marrow,umbilical cord blood or adi-pose tissue[J].Stem Cells,2006,24(5):1294-1301.
[26]Strem B M,Hicok K C,Zhu M,et al.Multipotential differentiation of adipose tissue-derived stem cells[J].Keio J Med,2005,54(3):132-141.
[27] Dicker A,Le Blanc K,Astrom G,et al.Functional studies of mesenchymal stem cells derived from adult human adipose tissue[J].Exp Cell Res,2005,308(2):283-290.
[28] Im G I,Shin Y W,Lee K B.Do adipose tissue-derived mesenchymal stem cells have the same osteogenic and chondrogenic potential as bone marrow-derived cells?[J].Osteoarthritis Cartilage,2005,13(10):845-853.
[29]Safford K M,Hicok K C,Safford S D,et al.Neurogenic differentiation of murine and human adipose-derived stromal cells[J].BiochemBiophys Res Commun,2002,294(2):371-379.
[30]Secco M,Moreira Y B,Zucconi E,et al.Gene expression profile of mesenchymal stem cells from paired umbilical cord units:cord is different from blood[J].Stem Cell Rev,2009,5(4):387-401.
[31]王晓辉,惠玲,杨霄鹏,等.人脐带间充质干细胞体外培养、鉴定及其诱导分化的研究[J].解放军医药杂志,2013,25(10):11-15,30.
[32]Ruhnke M,Ungefroren H,Nussler A,et al.Differentiation of in vitro modified human peripheral blood monocytes into hepatocytelike and pancreatic isletlike cells[J].Gastroenterology,2005,128(7):1774-1786.
[33] Izadpanah R,Trygg C,Patel B,et al.Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue[J].J Cell Biochem,2005,99(5):1285-1297.
[34] He Z,Feng M.Activation,isolation,identification and culture of hepatic stem cells from porcine liver tissues[J].Cell Prolif,2011,44(6):558-566.
[35] Yan L,Han Y,Wang J,et al.Peripheral blood monocytes from patients with HBV related decompensated liver cirrhosis can differentiate into functional hepatocytes[J].Am J Hematol,2007,82(11):949-954.
[36]尹鹏,梁庆威.外源性骨形态发生蛋白7联合血管内皮生长因子诱导大鼠脂肪干细胞向成骨细胞分化的实验研究[J]. 中国医科大学学报,2011,(10):897-901.
[37]Banas A,Teratani T,Yamamoto Y,et al.Adipose tissuederived mesenchymal stem cells as a source of human hepatocytes[J].Hepatology,2007,46(1):219-228.
[38]Aurich H,Sgodda M,Kaltwasser P,et al.Hepatocyte differentiation of mesenchymal stem cells from human adipose tissue in vitro promotes hepatic integration in vivo[J].Gut,2009,58(4):570-581.
[39]Fiegel H C,Lioznov M V,Cortes-Dericks L,et al.Liver-Specific gene expression in cultured human hematopoietic stem cells[J].Stem Cells,2003,21(1):98-104.
[40]Takeda M,Yamamoto M,Isoda K,et al.Availability of bone marrow stromal cells in three-dimensional coculture with hepatocytes and transplantation into liver damaged mice[J].J Biosci Bioeng,2005,100(1):77-81.
[41] Wang P P,Wang J H,Yan Z P,et al.Expression of hepatocyte-like phenotypes in bone marrow stromal cells after HGF induction[J].Biochem Biophys Res Commun,2004,320(3):712-716.
[42]张刚庆,方驰华,池达智.肝细胞生长因子诱导骨髓间充质干细胞向肝细胞分化的实验研究[J].中华外科杂志,2005,43(11):716-720.
[43]Schwartz R E,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[J].J Clin Invest,2002,109(10):1291-1302.
