重型弥漫性颅脑损伤大鼠海马区Homer1a表达与神经细胞丢失的关系
2014-12-02李建民赵雅宁马荣丽陈长香李淑杏
李建民,赵雅宁,马荣丽,窦 娜,陈长香,李淑杏,张 盼
0 引 言
弥漫性颅脑损伤(diffuse brain injury,DBI)成为儿童和青少年死亡或残疾的最常见病因[1],其病理机制包括兴奋性氨基酸毒性作用、氧化应激、钙离子超载、炎性反应、电解质代谢紊乱及神经细胞凋亡等所造成的脑组织继发性损害[2]。研究显示通过减少颅脑损伤病理过程中有害因子的产生可对脑组织产生一定的保护作用[3]。Homer是一种主要存在于中枢神经系统的信号转导蛋白,其家族大致可分为Homer1、Homer2和 Homer3等 3个类型,其中Homer1a第1个被认识,其受多种刺激因素调控,可选择性阻断Homerlb/c与代谢型谷氨酸受体的结合,调节细胞内钙离子的释放,从而影响突触的可塑性。近期有学者研究发现Homer1a参与脑损伤的病理过程[4-5]。目前关于DBI后Homer1a与神经细胞丢失之间的关系尚不清楚。本研究建立大鼠DBI模型,观察DBI大鼠海马区Homer1a蛋白表达变化、凋亡神经细胞动态变化,以探讨重型DBI大鼠海马区Homer1a蛋白表达与神经细胞丢失的关系。
1 材料与方法
1.1 动物分组和模型制备 健康清洁级SD成年雄性大鼠,104只,体重310 ~350 g、平均(328 ±10)g,由河北联合大学动物中心提供,合格证号:SCXK(京)2002-003。随机数字法分为对照组(n=35)和DBI组(n=69)。每组又分为 1、6、24、48、72 h 5 个时间点亚组。DBI组:参照文献[6]制作大鼠DBI模型。对照组只进行乙醚麻醉而不致伤。模型制作过程中DBI组死亡动物34只,死亡率49.3%。
1.2 脑组织形态结构观察 光镜:各组在规定时间点按随机数字列表法取3只大鼠,以0.4%戊巴比妥纳麻醉动物,开胸、暴露心脏,4%多聚甲醛行心脏灌流,断头取脑,在视交叉后1mm和6mm处冠状面切开,取中间块入4%多聚甲醛固定液固定,石蜡包埋,切片(片厚5 μm),进行HE染色。存活神经细胞密度定量分析:每个标本取5张切片,在光学显微镜(×200)下观察海马区神经元形态,将海马区平均分为3份,每个等份选取一个相同部位,应用Motic-6.0图像采集及图像分析系统分别计数其中每个视野(×200)下存活神经元数量及总细胞数量,计算存活神经细胞百分率(%)。电镜:每组各时间点取1只大鼠。迅速断头取脑,冰台上分离大脑海马区组织,切成1 mm×1 mm×1 mm组织块,立即以4%戊二醛固定,0.1 mol/L二甲砷酸缓冲液冲洗2遍,1%四氧化锇固定,再经缓冲液冲洗,逐级丙酮脱水,环氧树脂浸透,包埋,超薄切片,醋酸铀枸橼酸铅染色。透射电镜(H-7650,日本)观察脑组织超微结构的变化。
1.3 免疫组化法检测Homer1a蛋白 切片(组织切片来源与光镜组织相同)常规脱蜡,枸橼酸盐微波修复,滴加Homer1a抗体(1∶200),湿盒中4℃过夜,IgG抗体-HRP多聚体(PV二步法),37℃温箱30 min,DAB显色,脱水、透明、封固。以PBS代替一抗作阴性对照。镜下观察并摄片。阳性率的定量分析:每个标本取5张切片,在有测微尺的光学显微镜(×200)下观察Homer1a阳性细胞数量,具体方法:将海马区平均分为5份,每份选取相同部位,应用Motic-6.0图像采集及图像分析系统分别观察海马区阳性细胞变化并计数(×200)倍视野下的阳性细胞数量及总细胞数量,计算阳性细胞百分率(%)表示。
1.4 免疫印迹法检测Homer1a蛋白 每组规定时间点3只大鼠,致死后迅速取双侧海马区组织,称量为0.6g,4℃ PBS充分洗涤,加入3倍体积的4℃全细胞裂解液,冰浴中匀浆,以离心半径20 cm、12 000 r/min,4℃离心5 min,取上清。考马斯亮蓝法测各样本的蛋白含量,样本贮存于-80℃备用。检测步骤:蛋白样品50 μg与等体积上样缓冲液混合,煮沸10 min,100 g/L十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭液室温下震荡2~3h,加入Homer1a抗体(1∶2000),4℃孵育过夜,TBST 洗膜,标记的二抗,37℃孵育1 h,TBST洗膜,ECL显色,用图像分析仪测定光密度,作定量分析。
1.5 原位缺口末端标记法(in situ nick-end labeling,TUNEL)原位检测细胞凋亡 切片(组织切片来源与光镜组织相同)常规脱蜡至水,滴加蛋白酶K,湿盒中37℃孵育30 min,滴加TUNEL混合溶液(购于 Roche公司),50 μL/片,湿盒中 37℃ 孵育60 min,滴加转化剂 AP,50 μL/片,湿盒中 37 ℃ 孵育30 min,DAB显色,脱水,透明,封固。阳性率的定量分析:每个标本取5张切片,应用Motic-6.0图像采集及图像分析系统分别观察海马区阳性细胞变化并计数(×200)倍视野下的阳性细胞数量及总细胞数量,计算海马区神经细胞凋亡指数(apoptoticindex,AI),AI=凋亡细胞数/总细胞数×100%。
1.6 统计学分析 采用SPSS 17.0软件进行统计分析,定量资料以均值±标准差(±s)表示,采用t检验以及Pearson方法两两相关分析,以P≤0.05为有统计学意义。
2 结 果
2.1 脑组织形态结构变化 DBI组大鼠脑组织可见出血点,但无明显挫裂灶,光镜下可见脑组织广泛水肿,血管腔扩大、充血;DBI组6 h可见散在变性坏死的神经元,神经细胞胞体收缩呈三角形,细胞质嗜色性减弱,核皱缩浓染,细胞周围出现空隙;DBI组72 h视野内可见有核溶解及神经元细胞空泡样变,细胞间隙显著增宽。与对照组比较,DBI组海马区各时间点存活神经细胞百分率下降,差异有统计学意义(P <0.05)。见图1,表1。
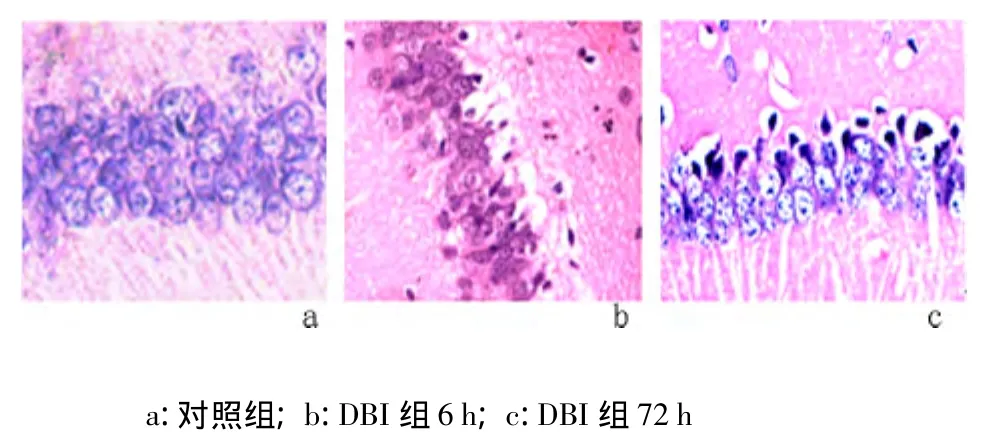
图1 大鼠海马区HE染色结果(×200)Figure 1 HE staining of the cerebral hippocampus in different groups(×200)
电镜下对照组神经元神经细胞形状规则,细胞质内线粒体丰富,细胞核形状规则,核膜完整,染色质均匀;对照组轴索排列整齐,结构完成;DBI组24 h神经细胞外形不规则、核膜断裂,染色质聚集靠边;轴索排列紊乱、肿胀,髓鞘泡鼓、内折、分层,此外还可观测到毛细血管周围水肿,肿胀变性神经元中大量细胞器堆积等等。结合动物死亡率和组织形态改变,本实验动物模型制作成功[6]。见图2。
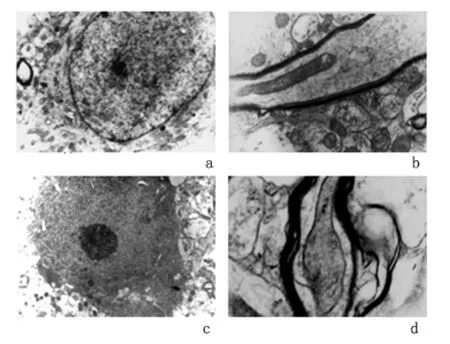
图2 大鼠海马区电镜结果(×200)Figure 2 Electron of the cerebral hippocampus in different groups(×200)
2.2 免疫组化法及免疫印迹法检测Homer1a蛋白结果 Homer1a阳性表达主要位于神经元的细胞质或突起的棕黄色颗粒。对照组大鼠海马区只有极少量的阳性细胞。与对照组比较,DBI组Homer1a阳性反应细胞数目增多,6 h出现峰值,高表达状态持续至24 h、48 h和72 h虽有下降,但仍明显高于对照组(P <0.05),见图3,表1。
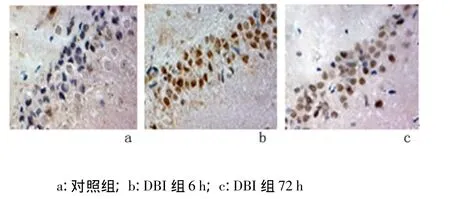
图3 免疫组化检测海马区Homer1a表达(×200)Figure 3 Results of Homer1a immunohistochemistry in hippocampus in different groups(×200)
免疫印迹:Homer1a条带清晰,以β-actin的吸光度值作为内参照,对各组条带的吸光度值进行校正和半定量分析。与对照组比较,DBI组中各时间点Homer1a蛋白均增高,6 h出现峰值,高表达状态持续至24 h,48 h和72 h下降,但仍高于对照组,差异有统计学意义(P<0.05)。见图4,表2。

图4 Western blot检测各组大鼠海马区Homer1a表达Figure 4 Results of Homer1a Western blot in hippocampus in different groups
2.3 神经细胞凋亡变化 凋亡神经细胞表现细胞核固缩呈棕黄色。对照组海马区只有极少数阳性细胞。与对照组比较,DBI组从伤后6 h TUNEL阳性细胞逐渐增多,72达高峰,与对照组比较,差异有统计学意义(P <0.05)。见图5,表2。
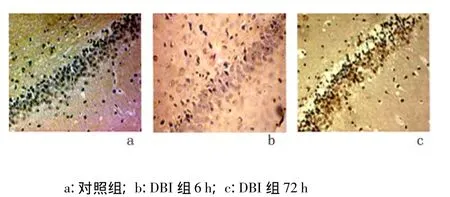
图5 大鼠海马区TUNEL检测结果(×200)Figure 5 Results of TUNEL in hippocampus in different groups(×200)
表1 大鼠海马区存活神经细胞百分率及Homer1a阳性细胞百分率比较(±s,%,n=3)Table 1 Comparison of the survival rate of survival nerve cells in hippocampus(±s,%,n=3)
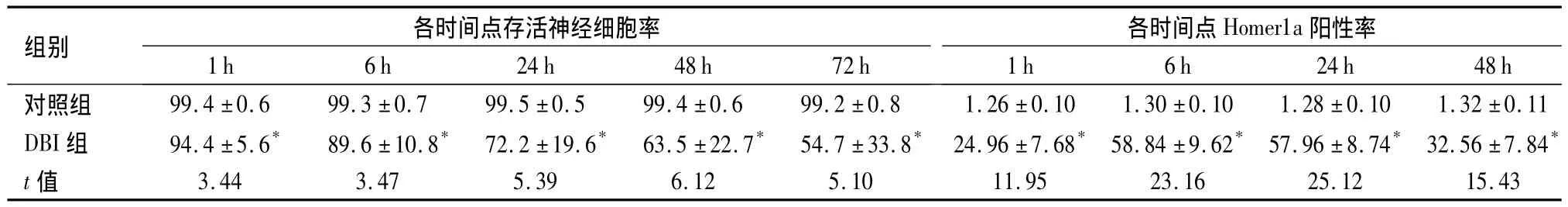
表1 大鼠海马区存活神经细胞百分率及Homer1a阳性细胞百分率比较(±s,%,n=3)Table 1 Comparison of the survival rate of survival nerve cells in hippocampus(±s,%,n=3)
与对照组比较,*P <0.05
组别 各时间点存活神经细胞率各时间点Homer1a阳性率1 h 6 h 24 h 48 h对照组 99.4 ±0.6 99.3 ±0.7 99.5 ±0.5 99.4 ±0.6 99.2 ±0.8 1.26 ±0.10 1.30 ±0.10 1.28 ±0.10 1.32 ±0.11 1 h 6 h 24 h 48 h 72 h DBI组 94.4 ±5.6* 89.6 ±10.8* 72.2 ±19.6* 63.5 ±22.7* 54.7 ±33.8* 24.96 ±7.68* 58.84 ±9.62* 57.96 ±8.74* 32.56 ±7.84*t值 3.44 3.47 5.39 6.12 5.10 11.95 23.16 25.12 15.43
表2 大鼠海马区Homer1a蛋白表达及神经细胞凋亡指数比较(±s,n=3)Table 2 Comparison of the Homer1a protein expression in hippocampus(±s,n=3)
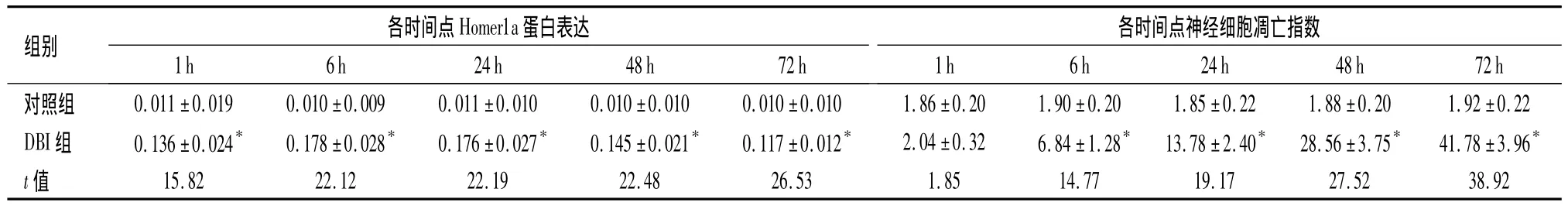
表2 大鼠海马区Homer1a蛋白表达及神经细胞凋亡指数比较(±s,n=3)Table 2 Comparison of the Homer1a protein expression in hippocampus(±s,n=3)
与对照组比较,*P <0.05
组别 各时间点Homer1a蛋白表达各时间点神经细胞凋亡指数1h 6h 24h 48h 72h对照组 0.011±0.019 0.010±0.009 0.011±0.010 0.010±0.010 0.010±0.010 1.86±0.20 1.90±0.20 1.85±1h 6h 24h 48h 72h 0.22 1.88±0.20 1.92±0.22 DBI组 0.136±0.024* 0.178±0.028* 0.176±0.027* 0.145±0.021* 0.117±0.012* 2.04±0.32 6.84±1.28* 13.78±2.40* 28.56±3.75* 41.78±3.96*t值 15.82 22.12 22.19 22.48 26.53 1.85 14.77 19.1727.52 38.92
2.4 相关分析结果 相关分析显示1~24h Homer1a蛋白表达与存活神经细胞百分率呈负相关(r=-0.726,P <0.05),24 ~72h Homer1a 蛋白表达与存活神经细胞百分率呈正相关(r=0.842,P <0.05);1~24h Homer1a蛋白表达与TUNEL阳性细胞数量呈正相关(r=0.738,P <0.05),24 ~72 h Homer1a蛋白表达与TUNEL阳性细胞数量呈负相关(r=-0.898,P <0.05)。
3 讨 论
颅脑创伤可导致神经细胞的坏死和凋亡。研究认为相对于重型脑损伤,轻型颅脑损伤后神经细胞更倾向于凋亡[7]。本研究应用HE染色观察海马区神经细胞病理形态变化,并动态分析了存活神经细胞百分率及凋亡神经细胞情况,结果显示重型DBI后海马区早期(24 h内)存活神经细胞百分率显著降低,6 h和24 h可检测到凋亡神经细胞,虽然高于对照组,但凋亡率在10%左右,而到伤后72 h凋亡率在40%多,说明重型DBI早期神经细胞丢失以神经细胞坏死为主,后期神经细胞凋亡逐渐占主导地位。本研究采用Marmarou's法建立的重型DBI模型,打击的直接暴力、蛛网膜下腔出血及血块、组织水肿等压迫引起微血管断裂塌陷、闭塞,造成微血循环断流,甚至造成“缺血区”[8];继发的弥漫性脑肿胀、脑组织缺血缺氧导致神经细胞死亡。
中枢神经系统内Homer1a的诱导激活可由神经元兴奋性活动导出[9-10]。Homer1a激活后的主要作用包括:①选择性阻断Homerlb/c与代谢型谷氨酸受体的结合,调节代谢型谷氨酸在突触部位的分布及受体信号传递效率,防止细胞过度兴奋[11];②减少N-甲基-M-天冬氨酸受体聚合物数量及膜表面α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体水平,减轻钙离子超载[12];③和其他信号如丝裂原活化蛋白激酶信号交互作用,调节受损细胞的凋亡[13]。目前多数学者认为Homer1a表达上调对脑损伤有保护作用[5]。本研究结果显示重型DBI后海马区Homer1a与神经细胞丢失存在一定内在联系,表现为Homer1a伤后1 h表达增多,6 h达峰值,高表达状态持续至24 h,此阶段存活神经细胞百分率波动在80%左右,48h和72h持续下降,存活神经细胞率迅速下降、神经细胞凋亡率显著的波动并增加。我们认为DBI早期诱导的Homer1a短期增多,可增强神经细胞对增多钙离子的调控能力,因而此阶段大部分神经细胞存活状态;但增多Homer1a不足以对抗钙超载带来的神经损伤,特别是在较为严重的颅脑创伤时,即使在Homer1a表达较多时,亦会出现较为明显的死亡的神经细胞;随创伤时间的延长,Homer1a下降,钙超载以及由此启动其他损伤因素的叠加作用,导致创伤24 h后大量细胞凋亡[14]。本研究的相关分析结果也说明重型DBI后Homer1a动态表达在一定程度上反映了神经细胞的丢失。DBI后Homer1a表达与神经细胞死亡特别是凋亡的关系及机制尚需深入研究。
[1] Graham DI,McIntosh TK,Maxwell WL,et al.Recent advances in neurotrauma[J].J Neuropathol Exp Neurol,2000,59(8):641-651.
[2] Werner C,Engelhard K.Pathophysiology of tramautic brain inju-ry[J].Br Anaesth,2007,99(1):4-9.
[3] 郭芮兵,田利丽,吕秋石,等.神经生长因子经鼻靶向治疗创伤性脑外伤后大鼠认知功能障碍[J].医学研究生学报,2012,25(2):471-475.
[4] 张 磊,刘 伟,刘文博,等.大鼠脑缺血再灌注损伤后皮层Homer1a蛋白改变及意义[J].临床神经外科杂志,2009,6(1):1-3.
[5] 费 舟,章 翔,黄卫东,等.体外培养大鼠皮城神经元机械性损伤后mGluR1a及Homer蛋白的表达及意义[J].第四军医大学学报,2003,24(22):2060-2062.
[6] Marmarou A,Foda MA,van den Brink W,et al.A new model of diffuse brain injury in rats.Part I:Pathophysiology and biomechanics[J].J Neurosurg,1994,80(2):291-300.
[7] Ng I,Yeo TT,Tang WY,et al.Apoptosis occurs after cerebral contusions in humans[J].Neurosurgery,2000,46(4):949-956.
[8] 陈火明,邹咏文.颅脑创伤后血脑屏障的改变[J].中华创伤杂志,2008,19(2):90.
[9] Potschka H,Krupp E,Ebert U,et al.Kindling-induced overexpression of Homer 1A and its functional implications for epileptogenesis[J].Eur J Neurosci,2002,16(11):2157-2165.
[10] Sakagami Y,Yamamoto K,Sugiura S,et al.Essential roles of Homer-1a in homeostatic regulation of pyramidal cell excitability:a possible Link to clinical benefits of electroconvulsive shock[J].Eur J Neurosci,2005,21(12):3229-3239.
[11] Sato M,Suzuki K,Nakanishi S.NMDA receptor stimulation and brain-derived neurotrophic factor upregulate Homer1a mRNA via the mitogen-activated protein kinase cascade in cultured cerebellar granule cells[J].J Neurosci,2001,21(11):3797-3805.
[12] Salm EJ,Thayer SA.Homer proteins accelerate Ca2+clearance mediated by the plasma membrane Ca2+pump in hippocampal neurons[J].Biochem Biophys Res Commun,2012,424(1):76-81.
[13] Wang Y,Fei Z,Ma YH,et al.VEGF upregulates Homer1a gene expression via the mitogen-activated protein kinase cascade in cultured cortex neurons[J].Neurosci Lett,2012,515(1):44-49.
[14] 史铁钧,费 舟,章 翔,等.大鼠弥漫性脑损伤后Homer蛋白的表达及其意义[J].第四军医大学学报,2005,24(26):2209-2211.
