活化Caspase 9在牛磺酸保护神经细胞中的保护作用
2014-12-02王李瑶张庆华夏鹤春
刘 阳,王李瑶,张庆华,夏鹤春 ,孙 涛
0 引 言
脑出血、脑外伤、神经退行性疾病、脑肿瘤等疾病都与神经细胞的凋亡有着密切联系。研究表明Caspase在神经系统疾病细胞凋亡进程中起到的很重要的作用[1-2]。Caspase通过外源性途径或内源性细胞凋亡途径激活介导了细胞的凋亡,通过释放线粒体细胞色素C到细胞质,活化Caspase 9和随后其他Caspases,其中Caspase 9处于凋亡有序级联反应的上游可激活下游Caspase3,进而诱导蛋白水解酶作用于关键调解蛋白和结构蛋白最终使细胞凋亡[3-4]。
牛磺酸(taurine)是人体内含量较高的游离氨基酸,是一种条件必需氨基酸,在细胞中发挥着多种作用,如渗透压调节、细胞质钙水平的调节、生长发育营养因子等。研究表明牛磺酸对神经系统有较强的保护作用[5]。本实验通过体外培养小鼠海马神经元细胞,采用谷氨酸诱导细胞凋亡,观察不同浓度牛磺酸对海马神经元凋亡的抑制作用,研究牛磺酸对神经系统的保护作用。
1 材料与方法
1.1 材料与试剂 小鼠永生性海马神经元细胞株HT_22购自北京北納创联生物技术有限公司。Caspase 9抗体购自cell signal technology公司,谷氨酸、牛磺酸购自Sigma公司,BetaActin、DAPI购自博奥森公司,二抗、FITC标记二抗购自北京中杉金桥公司,MTT试剂盒购自trevigen公司。
1.2 实验方法
1.2.1 细胞培养及分组 将小鼠永生性海马神经元细胞株HT_22置于37℃、5%CO2的培养箱,用含10%胎牛血清(FBS)的DMEM高糖培养基培养,取生长良好的第5~8代处于对数生长期且细胞活性>80%的细胞进行实验。
将细胞密度调整为1×105个/mL,按以下条件进行分组:正常HT_22细胞为对照组;HT_22细胞加入终浓度为4 mmol/L谷氨酸为损伤凋亡组;HT_22细胞加入终浓度为4 mmol/L谷氨酸和0.5 mmol/L牛磺酸为低剂量保护组;HT_22细胞加入终浓度为4 mmol/L谷氨酸和2 mmol/L牛磺酸为高剂量保护组。各组继续培养24 h后终止。
1.2.2 细胞生长状态观察 各组干预培养24 h后,倒置显微镜下选择5个视野,观察细胞数量,细胞形态,以及神经元间网络的形成。
1.2.3 MTT检测各组细胞生长活力 将细胞密度调整为1×105个/mL,每孔100 uL接种于96孔板。生长24h后,按各个分组加入相应干预后将96孔板培养24 h,漂洗细胞2次后加入90 μL新鲜培养液。再加入5 g/L MTT 10 μL,继续培养4 h后去上清。每孔加入110 μL Formazan溶解液,置摇床上低速振荡10 min,使结晶物充分溶解。490 nm处检测各孔吸光度(A)值。实验结果取每组6个复孔平均值。计算公式:
A值=(1-实验组A值)/对照组A值×100%
1.2.4 细胞免疫化学荧光检测Caspase 9表达细胞生长24 h后,将处于对数生长期的细胞,无血清培养6 h。吸出培养基,按以上设计方法进行分组干预。按分组接种在12孔板中的无菌盖玻片上。加入谷氨酸及牛磺酸干预后24 h,4%多聚甲醛固定液固定 30 min,TritonX-100,37℃渗透 30 min,10%山羊血清封闭30 min,添加一抗4℃孵育12~16 h,滴加1∶200的 FITC 标记的二抗,37℃温箱孵育1 h,甘油封片10 min。荧光显微镜观察到适宜亮度且图像清晰的细胞染色,拍照,进一步分析图像表达结果。
1.2.5 Western blot检测Caspase 9蛋白的表达 提取不同处理组的细胞总蛋白,计算50 μg蛋白上样量。电泳(5%浓缩胶,80 V,30 min;10%分离胶120 V,90 min)。湿转,260 mA,90 min,封闭 1 h 后一抗(1∶500),4℃孵育过夜。二抗(1∶1000),室温孵育1 h,进入暗室曝光。实验结果在凝胶成像系统进行扫描和密度分析,以所测目的蛋白与β-actin的比值作为该目的蛋白的定量指标。
1.3 统计学分析 采用SPSS 11.5软件进行统计分析,计量资料以均数±标准差(±s)表示。多组均数的比较采用单因素方差分析(One-Way ANOVA),组间两两比较视方差齐性检验(以0.1作为检验水准进行Levene检验)结果进行不同的选择,当方差齐同时,选择LSD检验,当方差不齐时,选择Tamhane's T2检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 细胞生长形态观察 在倒置相差显微镜下观察,对照组细胞数量多,海马神经元胞体多呈不规则椭圆形或三角形,有细长的突起且互相连接成网;损伤凋亡组细胞数量少,神经元样细胞突起短,网络稀疏;牛磺酸保护组较损伤组细胞数量较多,生长状态良好,细胞突起长。见图1。
2.2 MTT监测细胞存活力 对照组、损伤凋亡组、低剂量保护组、高剂量保护组MTT相对A值分别为0.643 ±0.013、0.102 ±0.025、0.504 ±0.072和0.452±0.029,损伤凋亡组细胞活力较对照组和低、高剂量保护组明显下降,差异有统计学意义(P <0.05)。

图1 倒置显微镜下海马神经元细胞生长形态(×400)Figure 1 Morphology of the neuronal cells(×400)
2.3 免疫荧光检测Caspase 9表达 免疫荧光结果显示损伤凋亡组Caspase 9的阳性表达(A值为61386.8±10 083.6)较对照组(A 值为 4 502.2 ±2518.1)明显增高,差异有统计学意义(P <0.05)。低、高剂量保护组Caspase 9的阳性表达(A值分别为20077.4 ±4187.5和 13976.2 ±7044.1)比损伤凋亡组明显降低,差异有统计学意义(P<0.05)。见图2。
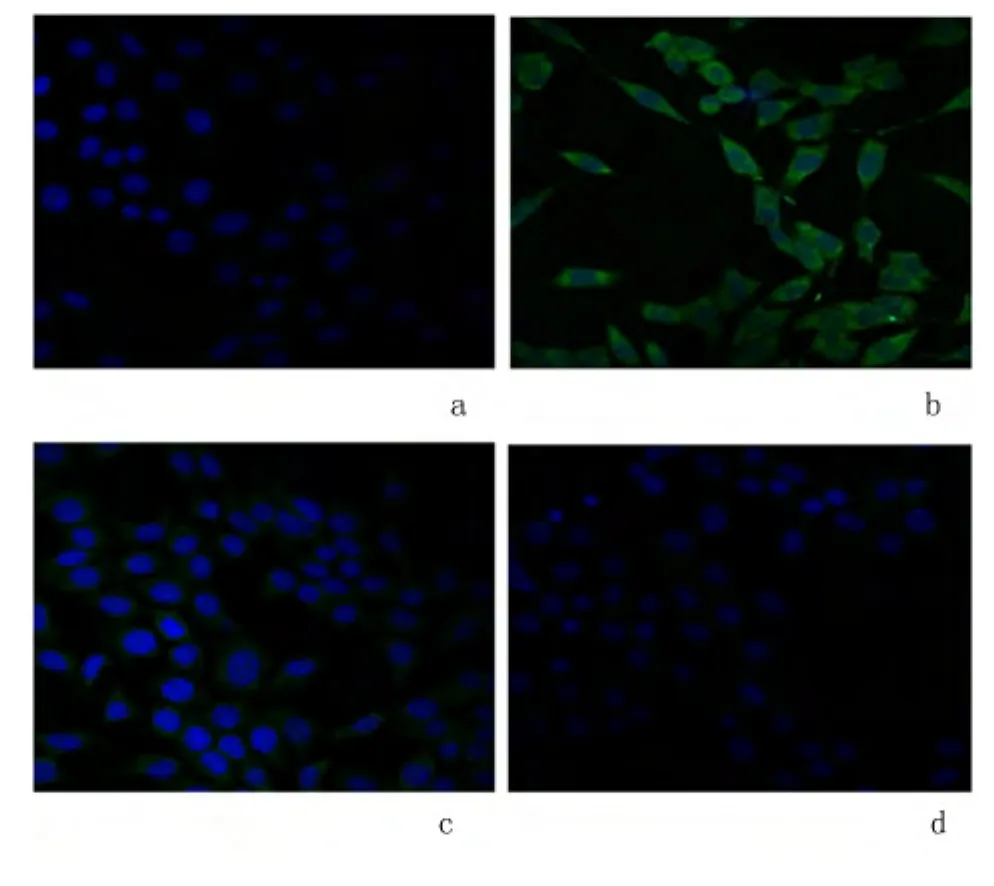
图2 Caspase 9免疫荧光图(×400)Figure 2 Expression of Caspase 9 in different groups detected by immunofluorescence(×400)
2.4 Western blot检测Caspase 9在各组中的表达与免疫荧光各组表达同步,在损伤凋亡组Caspase 9的阳性表达(A值为1.23)较对照组(A值为0.17)明显增高。低、高剂量保护组Caspase 9的阳性表达(A值分别为0.21和0.19)比损伤凋亡组明显降低。见图3。
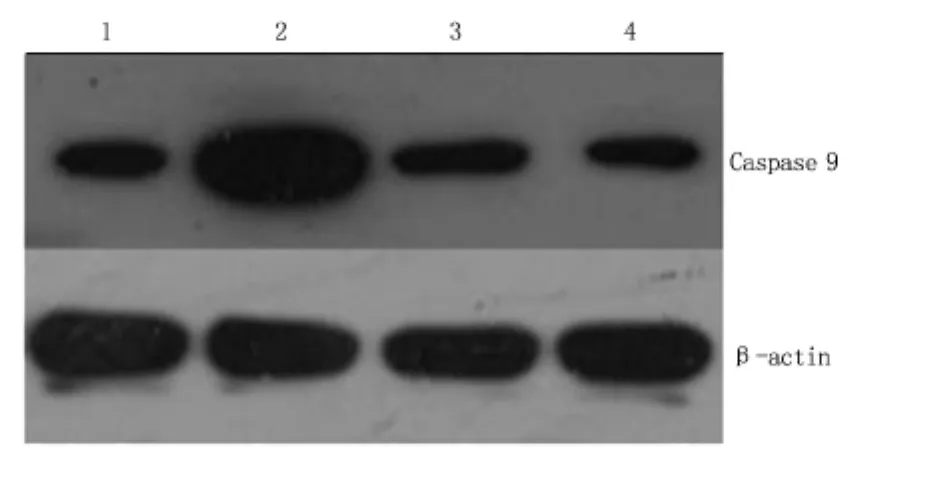
图3 Caspase 9在各组中的表达Figure 3 Expression of Caspase 9 in different groups detected by Western blot
3 讨 论
Caspases被认为是一个调节细胞死亡的蛋白酶家族,在神经系统发育中,半胱天冬酶在神经系统中逐渐下调,但继续履行重要的非凋亡功能与神经发生和突触可塑性相关。在神经退行性疾病,异常神经元死亡是一个突出的特点,同时伴随是Caspase活性的增加,研究表明Caspase介导的细胞凋亡在神经退行性疾病、脑缺血、脑肿瘤等疾病中发挥了重要作用[6]。正常状态下Caspase家族蛋白酶以无活性的酶原存在,它的活化主要有外源性途径和内源性途径。其中Caspase 9介导的是细胞凋亡中的内源途径也叫线粒体途径。线粒体直接或间接释放凋亡因子1(apoptosis protease-activating factor-1,Apaf-1)和细胞色素C。在细胞质内,细胞色素C与Apaf-1聚合Caspase 9,这导致了Caspase 9的活化,活化的Caspase 9激活下游的Caspase 3,后者直接引起细胞凋亡。活化的Caspase 3可以激活核因子、细胞骨架蛋白及DNA修复酶等,促使染色质凝聚和核酶激活,最终导致细胞凋亡[7-9]。Caspase 3是细胞凋亡的最终执行者,Caspase 9在凋亡起始中具有重要作用[10]。在本实验中采用经典损伤模型,既谷氨酸诱导海马神经元的凋亡,损伤组较对照组明显生长不良,凋亡率升高同时免疫荧光和蛋白印迹监测Caspase 9的表达明显升高,可见Caspase 9的活化与海马神经元的凋亡密切相关。
牛磺酸是一种含硫的非蛋白氨基酸,在体内以游离状态存在,不参与体内蛋白的生物合成,具有广泛的细胞保护作用。研究表明牛磺酸与中枢神经系统正常生理功能的维持有密切关系,其在大脑皮质、海马和小脑等区域特异性分布,具有促进神经系统生长发育、增殖分化、增强记忆、延缓衰老等作用[11]。牛磺酸对神经系统细胞的保护作用尚未完全明确,可能是以下几个机制的综合作用:①牛磺酸在中枢神经系统内作为一种抑制性氨基酸可对抗兴奋性氨基酸,如谷氨酸、天冬氨酸等,通过包括防止膜去极化,抑制神经细胞的兴奋性毒性和线粒体能量衰竭,保护目标包括细胞膜,线粒体,内质网膜[12-13]。②牛磺酸阻止细胞内自由基的过氧化,拮抗细胞内氧化还原损伤。③牛磺酸有调节细胞内游离钙水平的功能,通过抑制钙离子内流,减弱细胞的去极化趋势,保护细胞的结构和功能[14-15]。通过以上作用降低了细胞线粒体的损伤及其各种蛋白酶的稳定,抑制了Caspase 9介导的线粒体途径的凋亡进程。在本实验中通过在损伤模型中加入不同剂量牛磺酸干预后,可见神经细胞生长状态明显好转,MTT测得凋亡率明显下降,免疫荧光和蛋白印迹检测Caspase 9的表达量明显下降,可见牛磺酸可明显降低Caspase 9的活化从而抑制神经细胞的凋亡进程起到了很好的神经保护作用,为牛磺酸在神经系统疾病中的应用提供了理论支撑。
[1] 岳原亦,张 扬,张一奇.Caspase家族与细胞凋亡[J].中国医疗前沿,2011,6:25-26.
[2] 徐祖才,王学峰,雷显泽,等.丙戊酸钠对大鼠海马神经元癫痫样放电后细胞外信号调节激酶磷酸化水平的影响[J].医学研究生学报,2012,25(11):1124-1127.
[3] Allan LA,Clarke PR.Apoptosis and autophagy:Regulation of Caspase 9 by phosphorylation[J].FEBS J,2009,276(21):6063-6073.
[4] 卢娜娜,刘 琪,顾立刚,等.疏风宣肺方和解表清里方干预流感病毒性肺炎小鼠细胞凋亡的研究[J].医学研究生学报,2013,26(11):1134-1137.
[5] Kumari N,Prentice H,Wu JY.Taurine and its neuroprotective role[J].Adv Exp Med Biol,2013,775:19-27.
[6] Troy CM,Akpan N,Jean YY.Regulation of caspases in the nervous system implications for functions in health and disease[J].Prog Mol Biol Transl Sci,2011,99:265-305.
[7] Robert M,Friedlander MD.Apoptosis and caspases in neurodegenerative diseases[J].N Engl J Med,2003,348(14):1365-1375.
[8] Riedl SJ,Salvesen GS.The apoptosome:signal-ling platform of cell death[J].Nat Rev Mol Cell Biol,2007,8(5):405-413.
[9] Taylor RC,Cullen SP,Martin SJ.Apoptosis:controlled demolition at the cellular level[J].Nat Rev Mol Cell Biol,2008,9(3):231-241.
[10] LeBlanc AC.Natural cellular inhibitors of caspases[J].Prog Neuropsycho-pharmacol Biol Psychiatry,2003,27(2):215-229.
[11] Chesney RW,Helms RA,Christensen M.The role of taurine in infant nutrition[J].Adv Exp Med Biol,1998,442:463-476.
[12] Wu JY,Wu H,Jin Y,et al.Mechanism of neuroprotective function of taurine[J].Adv Exp Med Biol,2009,643:169-179.
[13] Chen WQ,Jin H,Nguyen M.Role of taurine in regulation of intracellular calcium level and neuroprotective function in cultured neurons[J].J Neurosci Res,2001,66(4):612-619.
[14] Ye HB,Shi HB,Yin SK.Mechanisms underlying taurine protection against glutamate-induced neurotoxicity[J].Can J Neurol Sci,2013,40(5):628-634.
[15] Ahmad MK,Khan AA,Mahmood R.Taurine ameliorates potassium bromate-induced kidney damage in rats[J].Amino Acids,2013,45(5):1109-1121.
