褐藻多糖硫酸酯对脂多糖诱导大鼠肾小球系膜细胞 NO产生量的影响
2014-12-02王雪妹张全斌
王雪妹 , 王 晶 张全斌
(1. 中国科学院 海洋研究所 海洋生物技术工程研究发展中心, 山东 青岛 266071; 2. 中国科学院大学, 北京100049)
褐藻多糖硫酸酯是来源于褐藻细胞壁的一种主要由硫酸化的岩藻糖组成的结构复杂多变的杂多糖。褐藻多糖硫酸酯具有多种生物活性, 主要有抗病毒、抗肿瘤、抗凝血和抗血栓、抗炎症和增强机体免疫功能等, 且随着他们的化学组分不尽相同, 其生物活性也有很大差异[1]。研究发现[2], 褐藻多糖硫酸酯在动物肾脏损伤模型中具有很好的肾脏保护作用, 可缓解慢性肾衰, 且已在临床得到了应用。褐藻多糖硫酸酯在慢性肾衰中对肾脏的保护作用表现在可降低尿蛋白、血清肌酐和尿素氮水平, 改善肾脏功能[3]。对于褐藻多糖硫酸酯抗肾衰的机制已有一些研究, 褐藻多糖硫酸酯对肾脏的保护作用与其抗氧化能力相关[3], 褐藻多糖硫酸酯可抑制阿霉素肾病肾硬化大鼠肾脏中TGF-β1表达, 并减少细胞外基质中Ⅳ型胶原蛋白和纤连蛋白的合成[4], 褐藻多糖硫酸酯可抑制肾小管上皮细胞间充质细胞转化[5]。但是褐藻多糖硫酸酯抗肾衰的机制尚不明确, 有待进一步的研究。
NO是哺乳动物体内一种重要的信号分子, 与机体的炎症反应密切相关。LPS是革兰氏阴性细菌细胞壁中的一种成分, 对宿主是有毒性的, 是一种细菌内毒素。LPS可诱导人肾小球系膜细胞的炎症反应, 包括 NO含量的增加[6]。研究证明, 分子质量对多糖活性有重要影响, 本研究制备了两种不同分子质量褐藻多糖硫酸酯, 选取大鼠肾小球系膜细胞作为实验材料, 以 LPS诱导炎症反应作为模型, 探讨不同分子质量褐藻多糖硫酸酯是否能够抑制LPS诱导的细胞培养液中 NO含量的增加, 从而抑制细胞的炎症反应。通过实验结果探究褐藻多糖硫酸酯抗炎效果与其分子质量之间的关系, 从而对不同分子质量的褐藻多糖硫酸酯抗肾衰效果的研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞
大鼠肾小球系膜细胞(HBZY-1)购于中国典型培养物保藏中心(China Center for Type Culture Colle-ction, CCTCC)。
1.1.2 实验药物
从海带(Laminaria japonica)中提取褐藻多糖硫酸酯[7], 标记为F1。由F1降解得到低分子质量褐藻多糖硫酸酯[8], 标记为F2。
1.1.3 实验试剂
DMEM(Dulbecco’s Modified Eagle’s Medium)高糖(4500 mg/L Glucose)培养基(Hyclone公司); 胎牛血清(Fetal Bovine Serum, FBS, Hyclone公司); 脂多糖(Lipopolysaccharide, LPS, 美国Sigma公司); 胰蛋白酶(含 EDTA, Solarbio公司); MTT(美国 Sigma公司); 一氧化氮检测试剂盒(碧云天生物技术研究所)。
1.2 实验方法
1.2.1 褐藻多糖硫酸酯化学组成的测定
褐藻多糖硫酸酯分子质量用高效凝胶色谱法以葡聚糖作为分子质量标准进行测定。岩藻糖含量用半胱氨酸盐酸盐法(Gibbons法)以岩藻糖为标准进行测定[9]。硫酸根含量用明胶氯化钡法以硫酸钾为标准进行测定[10]。糖醛酸含量用咔唑比色法以葡萄糖醛酸为标准进行测定[11]。单糖含量组成用PMP柱前衍生-HPLC法进行测定[12]。
1.2.2 大鼠肾小球系膜细胞HBZY-1的培养
大鼠肾小球系膜细胞 HBZY-1的培养条件为:90%DMEM高糖培养基, 10%胎牛血清, 青链霉素混合液(青霉素的工作浓度为100 U/mL, 链霉素的工作浓度为0.1 g/L), 37℃, 5%CO2培养箱中培养。传代时间为2 d, 消化液为含0.25%EDTA的胰蛋白酶溶液。
1.2.3 MTT法测定细胞活力
待细胞生长至对数期时, 消化收集细胞, 调整细胞悬液的浓度, 使细胞浓度为5×104个/mL。铺96孔板, 每孔加入100 µL细胞悬液, 细胞数目为5×103个/孔。过夜培养至细胞贴壁, 换0.5%FBS的DMEM培养基, 培养24 h, 使细胞处于G0期。换10%FBS的DMEM完全培养基, 正常组和模型组不加任何药物, 药物组加入药物F1或F2使其终浓度为12.5、25、50、100 mg/L, 处理1 h后, 模型组和药物组加入LPS使其终浓度为 0.5 mg/L, 继续培养 24 h。每孔加入20 µL 5g/L MTT(避光), 培养 4 h。吸去培养液, 每孔加入 150µL DMSO, 低速摇床振荡 10 min, 酶标仪490 nm测各孔吸光值。
1.2.4 细胞培养液中NO含量的测定
待细胞生长至对数期时, 消化收集细胞, 调整细胞悬液的浓度, 使细胞浓度为3×104个/mL。铺24孔板, 每孔加入 1 mL细胞悬液, 细胞数目为 3×104个/孔。过夜培养至细胞贴壁, 换0.5%FBS的DMEM培养基, 培养24 h。换10%FBS的DMEM完全培养基, 正常组和模型组不加任何药物, 药物组加入药物 F1 或 F2 使其终浓度为 12.5、25、50、100 mg/L, 处理 1 h后, 模型组和药物组加入 LPS使其终浓度为0.5 mg/L。培养24 h, 取培养液200 μL, 继续培养24 h,取培养液200 μL, Griess法测培养液中NO含量。
用完全培养基稀释标准品 NaNO2, 使标准品的浓度依次为 0、1、2、5、10、20、40、60、100 μmol/L。按50 μL/孔, 在96孔板中加入样品(设3个平行)及标准品, 在各孔中加入室温Griess Reagent I 和Griess Reagent II 各 50 μL。10 min 后, 540 nm 测定吸光度。
1.2.5 统计学方法
所有数据均采用(x±s)表示, 采用SPSS13.0进行成组间方差分析, P<0.05为差异有统计学意义。
2 实验结果
2.1 褐藻多糖硫酸酯化学组成测定结果
来源于海带的褐藻多糖硫酸酯及其低分子质量产物(F1和 F2)的化学组成测定结果见表 1。结果表明, F1的分子质量为 87 305 Da, F2的分子质量为6 500 Da, F1分子质量明显高于F2。F1和F2的主要化学成分均为岩藻糖和硫酸根, 另外均含有较多的半乳糖。F2与F1相比, F2岩藻糖和硫酸根含量略低于F1, 且F2含有较多的半乳糖。
2.2 MTT法测定细胞活力
MTT法测定各组细胞活力结果如图 1(以 F2为例)所示。结果表明, 各组间细胞活力无显著性差异。因此, 在此基础上测定其他指标是可行的, 可排除因各组间细胞活力差异导致的其他指标的变化。
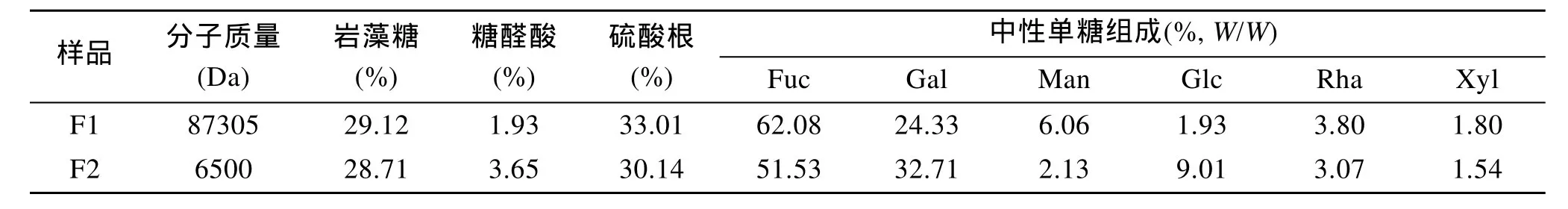
表1 来源于海带的褐藻多糖硫酸酯(F1和F2)的化学组成Tab.1 Chemical composition of fucoidan (F1 and F2) from Laminaria japonica
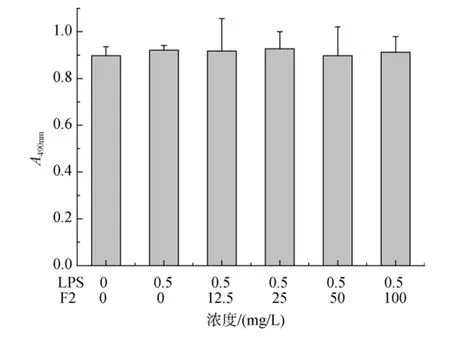
图1 MTT法测定各组细胞活力(以F2为例)Fig.1 The cell viability of each group detected by MTT method (taking F2 as the example)
2.3 细胞培养液中NO含量的测定
细胞培养液中NO含量测定结果见图2及图3。由图2可知, F1可以抑制LPS引起的大鼠肾小球系膜细胞NO产生量的增加, 24 h时, 25、50、100 mg/L三个药物组与模型组相比 NO含量有显著性差异,48 h时, 12.5、25、50、100 mg/L四个药物组与模型组相比NO含量均有显著性差异。由图3可知, F2可以抑制LPS引起的大鼠肾小球系膜细胞NO产生量的增加, 24 h时, 50、100 mg/L两个药物组与模型组相比NO含量有显著性差异, 48 h时, 12.5、25、50、100 mg/L四个药物组与模型组相比NO含量均有显著性差异。
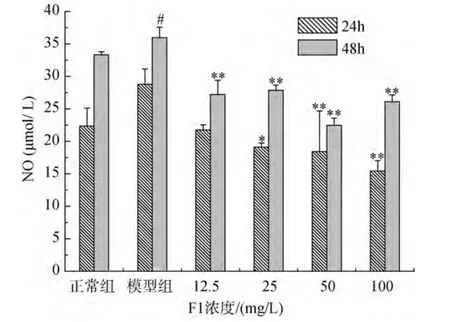
图2 F1对LPS诱导HBZY-1 NO产生量的影响(24 h和48 h)Fig.2 The effect of F2 on NO production by HBZY-1 cells induced by LPS (24 h and 48 h)
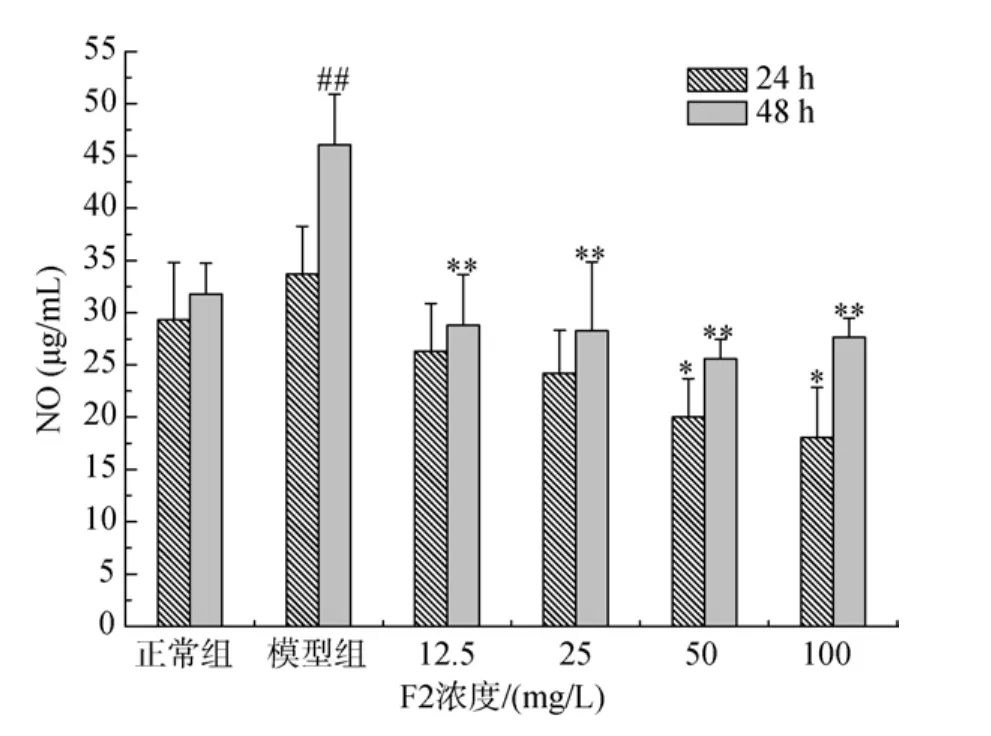
图3 F2对LPS诱导HBZY-1 NO产生量的影响(24 h和48 h)Fig.3 The effect of F2 on NO production by HBZY-1 cells induced by LPS (24 h and 48 h)
为了比较F1和F2抑制LPS诱导大鼠肾小球系膜细胞 NO产生的效果大小, 选取作用时间为 48h,药物浓度为 25 mg/L的组别与对应的模型组进行比较, 结果如表2所示。由表2可知, F1和F2的作用剂量为 25 mg/L时, 与模型组相比, 细胞培养液中NO含量下降比例分别为 22.52%和 38.65%, 药物抗炎效果为F2>F1。
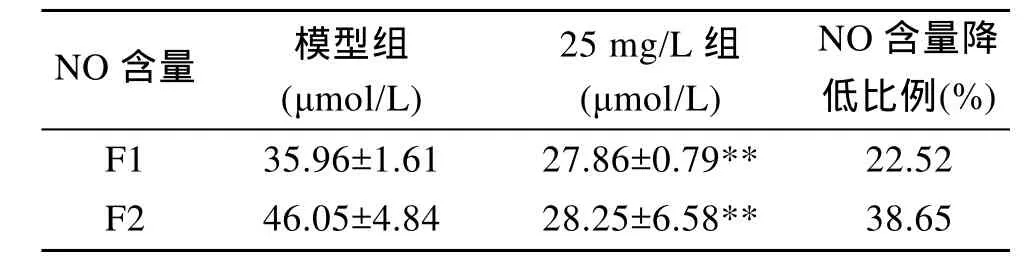
表2 F1和F2抑制LPS诱导大鼠肾小球系膜细胞NO产生的效果比较Tab.2 Comparison of inhibitory effect of F1 and F2 on NO production induced by LPS
3 讨论
褐藻多糖硫酸酯具有抗炎和抗肾衰的活性, 且其抗肾衰活性已在临床的得到了应用。虽然对于褐藻多糖硫酸酯肾脏保护作用的机制有一定的研究,但是其肾脏保护机制尚不明确。在慢性肾衰的进程中伴随着炎症反应的发生, 研究褐藻多糖硫酸酯抗炎作用对于褐藻多糖硫酸酯抗肾衰效果及机制的研究具有一定的意义。肾小球系膜细胞是肾脏中三种固有细胞之一, 对于肾脏炎症、慢性肾衰的进程中起到重要的作用。本文研究结果表明, LPS可引起大鼠肾小球系膜细胞NO产量的增加, F1和F2均可在一定程度上抑制细胞的 NO的产生, 从而降低细胞的炎症反应。
由F1和F2化学组成及其抑制LPS诱导的大鼠肾小球系膜细胞 NO产生的效果可知, F2抗炎作用(NO含量降低比例为 38.65%)显著高于 F1(22.52%),且 F2分子质量(6 500 Da)明显低于 F1(87 305 Da),由此可推断分子量较低时抗炎效果更好, 可能是由于分子量较低时更易被细胞吸收, 从而更易起到抗炎的作用。在以后的研究工作中, 可通过研究不同化学组成的褐藻多糖硫酸酯的抗肾衰效果, 通过对褐藻多糖硫酸酯抗肾衰效果与抗炎效果进行比较, 从而确定褐藻多糖硫酸酯抗肾衰是否与其具有抗炎作用有一定的关系。
NO是以精氨酸作为底物在NO合酶的作用下生成的, 在部分炎症反应中, 会有NO合酶含量的升高从而导致NO生成量的增加。因此, 褐藻多糖硫酸酯可能通过某种方式影响 NO合酶的含量或活性, 从而对 NO的产生过程产生一定的影响。为了探究褐藻多糖硫酸酯影响 NO产生的原因和途径, 在接下来的研究工作中, 可通过研究 NO合成酶含量的变化来探究褐藻多糖硫酸酯对于 NO含量产生影响的途径。
[1] Berteau O, Mulloy B. Sulfated fucans, fresh perspectives: structures, functions, and biological properties of sulfated fucans and an overview of enzymes active toward this class of polysaccharide [J]. Glycobiology,2003, 13(6): 29R-40R.
[2] Zhang Q, Li Z, Xu Z, et al. Effects of fucoidan on chronic renal failure in rats [J]. Planta Medica, 2003,69(06): 537-541.
[3] Wang J, Zhang Q, Jin W, et al. Effects and mechanism of low molecular weight fucoidan in mitigating the peroxidative and renal damage induced by adenine [J].Carbohydrate Polymers, 2011, 84(1): 417-423.
[4] 王兆华. 褐藻多糖硫酸酯对阿霉素肾病肾硬化大鼠肾脏的保护作用[D]. 济南: 山东大学硕士学位论文,2005.
[5] 刘建春. 褐藻多糖硫酸酯对腺嘌呤致大鼠肾间质纤维化的作用及其机制探讨[D]. 中国协和医科大学硕士学位论文, 2006.
[6] Wu F, Zhang W, Li L, et al. Inhibitory effects of honokiol on lipopolysaccharide-induced cellular responses and signaling events in human renal mesangial cells [J]. European Journal of Pharmacology, 2011,654(1): 117-121.
[7] Wang J, Zhang Q, Zhang Z, et al. Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica [J]. International Journal of Biological Macromolecules, 2008, 42(2): 127-132.
[8] Wang J, Wang F, Zhang Q, et al. Synthesized different derivatives of low molecular fucoidan extracted from Laminaria japonica and their potential antioxidant activity in vitro [J]. International Journal of Biological Macromolecules, 2009, 44(5): 379-384.
[9] Gibbons M N. The determination of methylpentoses [J].Analyst, 1955, 80(949): 268-276.
[10] Kawai Y, Seno N, Anno K. A modified method for chondrosulfatase assay [J]. Analytical Biochemistry,1969, 32(2): 314-321.
[11] Bitter T, Muir H M. A modified uronic acid carbazole reaction [J]. Analytical Biochemistry, 1962, 4(4): 330-334.
[12] Honda S, Akao E, Suzuki S, et al. High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl5-pyrazolone derivatives [J].Analytical Biochemistry, 1989, 180(2): 351-357.
