CeF3分解制备CeO2/CeF3催化剂的丙烷氧化脱氢性能
2014-12-01贾纬华陈明树万惠霖
贾纬华,陈明树,万惠霖
(厦门大学 化学化工学院,固体表面物理化学国家重点实验室,醇醚酯化工清洁生产国家工程实验室,福建 厦门361005)
CeO2及铈基复合氧化物(CexMyOz)是常用的氧储放剂,在温度高于350℃,Ce3+、Ce4+氧化还原循环能够促进萤石晶格中氧的储存和释放,是理想的直接氧化载体,如汽车三效催化剂[1]、燃料电池[2].相对于其他氧化物,CeO2的氧缺陷位能够快速形成和消除,有非常高的氧储存能力,其在水汽变换[3-5]、氢气氛中CO 选择氧化(PROX)[6]、氧化脱氢反应[7-8]中作为催化剂载体被广泛应用.
近年来,CeO2的表面结构、氧空位迁移机制、氧空位的形成和氧化机制、以及CeO2(111)薄膜的边界性质等已被广泛研究.如Nilius等[9]研究了Ru(0001)上CeO2(111)薄膜的台阶位及边界性质,依赖于制备方法的不同,形成三角形和六边形的CeOx岛,其台阶位的取向为(211)和(110),台阶及边缘位的电子性质与体相CeO2存在明显的差异.Boizumault-Moriceau等[10]用共沉淀法制备了不同Ni含量的CeNiO3催化剂,在反应温度为300℃时即有丙烷氧化脱氢(ODHP)的活性和选择性,可以得到11%的丙烯收率,由于Ni原子的掺杂,使CeO2晶格形成更多的氧空位,进而使吸附的分子氧活化形成活性氧物种.
烷烃选择氧化是一个复杂的反应过程,涉及到分子氧的活化、烷烃的活化和脱氢等多个步骤.目前报道的烷烃选择氧化的催化剂一般多为多组分、多功能的催化剂.在课题组前期的研究中,通过机械混合法,在CeO2中加入CeF3调变后,其丙烯选择性提高,随着CeF3含量增加,丙烷氧化活性有所降低,丙烯选择性却相应提高[11-12].由于 CeF3在空气中高温焙烧时会发生分解,CeO2/CeF3在焙烧前后配比发生变化,故CeO2/CeF3的起始原料配比与ODHP性能未能很好关联.系列催化剂中,3%Cs2/CeO2/2CeF3表现出优越的活性,丙烯收率高达33%[12],但该催化剂的制备再现性较差,可能与焙烧环境和温度等影响有关.
Shen等[13]使用LaF3和CeF3作为F-浓度测定的离子敏感电极,X-光电子能谱(XPS)分析结果表明使用后的电极CeF3晶面含有Ce4+氧化物,可能是CeF3与溶液中OH-作用形成了CeO2,其形成可能是导致电极性能下降的原因.因此,我们选择CeF3作为前驱物,通过直接分解从CeF3制备一系列含不同比例的 CeO2/CeF3催化剂,结合 X-射线粉末衍射(XRD)、低能离子散射(LEIS)和Raman等手段对催化剂进行了详细表征,并考察和关联其ODHP反应性能.
1 实 验
1.1 催化剂的制备
称取一定质量的CeF3于烧杯中,加入一定量的去离子水,然后放入100℃硅油浴中,搅拌蒸干水分.将干燥的催化剂转移至坩埚中,于马弗炉中(空气气氛)焙烧,焙烧温度分别为600,625,650,675,700℃,升温速率为10℃/min,焙烧时间均为2h.单组分CeO2采用硝酸亚铈(含结晶水)为前驱体,采用上述相同的步骤制备得到CeO2催化剂,焙烧温度为650℃.
1.2 催化剂的表征
催化剂的体相组成和结构用XRD测定,实验在Philips公司的多晶粉末X-射线衍射仪Panalytical X′pert Pro上进行,以 Cu-Kα (λ=0.154 06nm)作辐射源,采用石墨单色器滤光,管压40kV,管电流30mA,扫描区间为10°~80°,步长0.016 8°.
LEIS在ION-TOF公司的Qtac100进行,采用He+和Ne+作为离子源,剖析的深度通过离子源类型、离子束的密度及时间来控制.离子枪中He气源压力2×10-3Pa,加速电压3kV,电流6nA;Ne气源压力2×10-3Pa,加速电压5kV,电流1.6nA.LEIS可以获得催化剂最表面一个原子层的化学成分,为催化剂构效关系的建立提供更直接的证据.
显微Raman光谱实验是在Renishaw 1000型Raman光谱仪上进行,激发光源为固体激光器.该仪器配备三维高精度自动平台,Leica显微系统,CCD检测器,仪器分辨率约为4cm-1.实验采用的激发光波长为785nm,激光器的输出功率为23mW,曝光时间为10s.仪器校正时参考硅片在520.6cm-1处的特征峰.
1.3 催化剂的性能评价
催化剂的反应性能评价在常压固定床微型反应装置上进行,反应管由直径为5mm的石英管制成,催化剂用量为100mg(40~80目).原料气(V(C3H8)∶V(O2)∶V(N2)=1∶1∶4)和产物用两台气相色谱仪在线分析,反应尾气在进入色谱取样阀之前保温在120℃以上,以免产物冷凝.烃组分和C2、C3等含氧有机物经GDX-103柱(柱温150℃)分离后由FID检测,除去含氧有机物后的尾气 (CO,CO2,CH4,C2H4,C2H6,C3H6,C3H8等)则经由涂渍角鲨烷的Al2O3柱(柱温120℃)和碳分子筛柱(柱温70℃)分离后由TCD检测.
2 结果与讨论
图1(a)是CeF3在不同温度焙烧制备得的CeO2/CeF3催 化 剂 XRD 图,衍 射 峰 27.902°,44.052°和45.211°可归属于CeF3(111),(300)和(113)晶面的衍射峰[14](JCPDS No.01-085-1343),28.681°,47.835°,56.783°分别归属于CeO2(111),(220)和(311)晶面的衍射峰[15](JCPDS No.01-081-0792).450 ℃焙烧的催化剂并未出现明显的CeO2晶相衍射峰,随着焙烧温度的 升 高 出 现 可 归 属 于 CeO2(28.59°,47.56°和56.43°)的特征衍射峰并逐渐增强,CeO2和CeF3相的最强峰的强度比值逐渐升高(图1(b)),这说明随着焙烧温度的升高,CeF3催化剂分解程度不断加大.
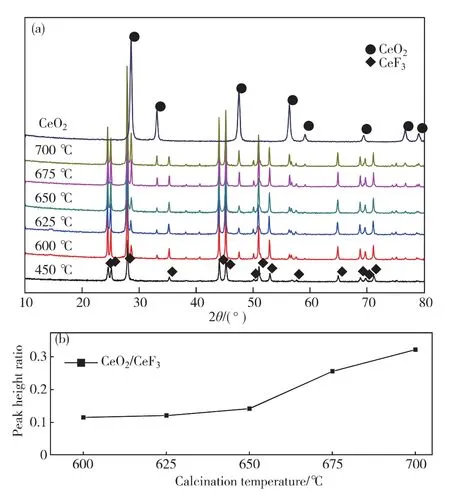
图1 CeO2催化剂和CeF3在不同温度焙烧制得的CeO2/CeF3 催化剂的 XRD图(a),CeO2/CeF3最强峰高度比随温度的变化(b)Fig.1 XRD patterns of CeO2catalyst and CeF3calcinated at various temperatures(a),and the peak height ratio of the most intense peaks for CeO2and CeF3 as a function of the calcined temperatures(b)
图2是CeF3在650℃焙烧的CeO2/CeF3催化剂的LEIS图,LEIS是对最表面一个原子层灵敏的一种分析手段.采用He+和Ne+离子对650℃焙烧的催化剂交替溅射/分析,每次溅射120s后进行LEIS测试,相应的测试谱线按先后顺序排列.实验结果发现,起始阶段催化剂表面能检测到O、F和Ce 3种组分,随着Ne+离子束溅射次数的增加催化剂表面的Ce和F信号强度显著增强,而O的强度逐渐减弱乃至消失.这些结果表明经高温焙烧的CeF3粒子表面生成CeO2,内核还是CeF3,表明CeF3的分解首先从表面开始(即分解由外而内),表面区域仍检测到F的信号可能是CeO2没有完全覆盖CeF3,或是由于内核CeF3的调变有部分F迁移到表面,形成F修饰的CeO2表面.

图2 CeF3在650℃焙烧的CeO2/CeF3催化剂在不同Ne+溅射时间后的LEIS图Fig.2 LEIS spectra of CeO2/CeF3prepared from CeF3 calcined at 650℃ with different Ne+sputtering times
图3是CeF3在不同温度焙烧制得的CeO2/CeF3催化剂的Raman光谱图.当激光波长为785nm时,CeF3的特征峰主要为在1 000~1 800cm-1之间的多个峰,CeO2的特征峰主要为在464cm-1的峰,CeO2的强度随CeF3焙烧温度的增加而逐渐增强.用等摩尔比的CeO2和CeF3混合物做内标,CeO2和CeF3的摩尔比可用相应振动峰的强度比ICe-O/ICe-F来表示,如图3的插图所示,当焙烧温度从600℃升到700℃时该摩尔比由0.067增加到0.18,与常规XRD和LEIS检测结果相吻合.
图4为CeF3在不同温度焙烧制得的CeO2/CeF3催化剂在575℃时的ODHP反应性能.650℃焙烧的催化剂在反应温度为575℃时,丙烷的转化率为33.8%,丙烯的选择性为 50.7%,丙烯的收率为17.1%,COx的选择性仅为3.2%.焙烧温度从600℃升到700℃,丙烯的选择性则由56.3%降低到42.2%,而COx的选择性维持在5%以内,这可能是由于随焙烧温度的升高表面CeO2增多使表面F/O摩尔比下降,F-隔离活性位的作用减弱所致.CeO2的丙烯选择性仅有16.9%,COx的选择性却高达48.4%,最终丙烯的收率为5.4%.这说明没有F-时,CeO2上丙烷主要发生深度氧化导致丙烯的选择性迅速下降.
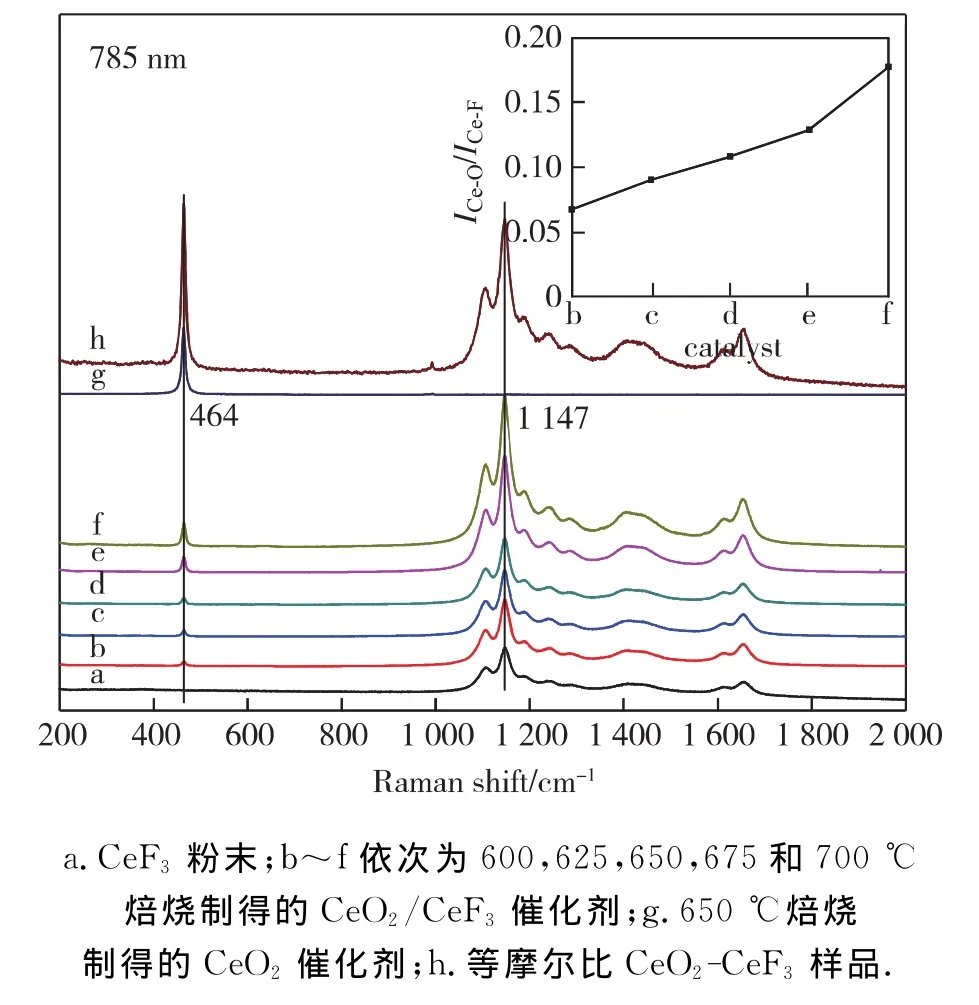
图3 CeF3不同温度焙烧制得的CeO2/CeF3的Raman谱图Fig.3 Raman spectra of CeO2/CeF3prepared from CeF3calcined at different temperatures
图5为CeF3在650℃焙烧制得的CeO2/CeF3催化剂(a)和CeO2催化剂(b)不同温度时的ODHP反应性能.从图中可以看出,随着反应温度的升高,丙烷的转化率逐渐升高,丙烯的选择性逐渐下降.650℃焙烧的CeO2/CeF3催化剂丙烯选择性在50%以上,而CeO2催化剂的丙烯选择性在20%以下,COx的选择性达到50%以上.通过对比不同温度时2种催化剂的丙烯选择性,进一步说明F-可隔离CeO2表面的活性氧物种,进而显著提高丙烯的选择性,避免丙烯深度氧化到COx.
CeO2晶体具有萤石结构,其(111)晶面由O—Ce—O三层堆叠而成[16].计量比的CeO2是绝缘体,禁带宽度为6.0eV.当氧空位[17-20]出现后,表面空位处的Ce4+变成Ce3+,其电子态对催化反应起到重要影响[21-22].氧空位通常能强吸附和活化分子氧[23],是键断裂的活性 位[20,24-25].本 课 题 组 前 期 工 作[11-12]发 现在高温反应条件下,F-的存在使CeO2表面活性氧浓度降低,因而引起催化剂ODHP反应活性以及选择性的差异.我们通过直接分解法制备出CeO2覆盖在CeF3核上的催化剂,控制焙烧温度等制备条件,实现催化剂表面F/O摩尔比的调控,进而有效改善了ODHP反应的产物选择性.结合催化剂的ODHP反应性能及结构表征,认为直接控制CeF3的分解程度,进而调变催化剂覆盖层的活性相及表面F/O摩尔比,是获得更好ODHP催化活性的重要途径.

图4 CeF3不同温度下焙烧制得CeO2/CeF3催化剂的ODHP反应性能Fig.4 Catalytic performance for ODHP of CeO2/CeF3 prepared from CeF3calcined at different temperatures
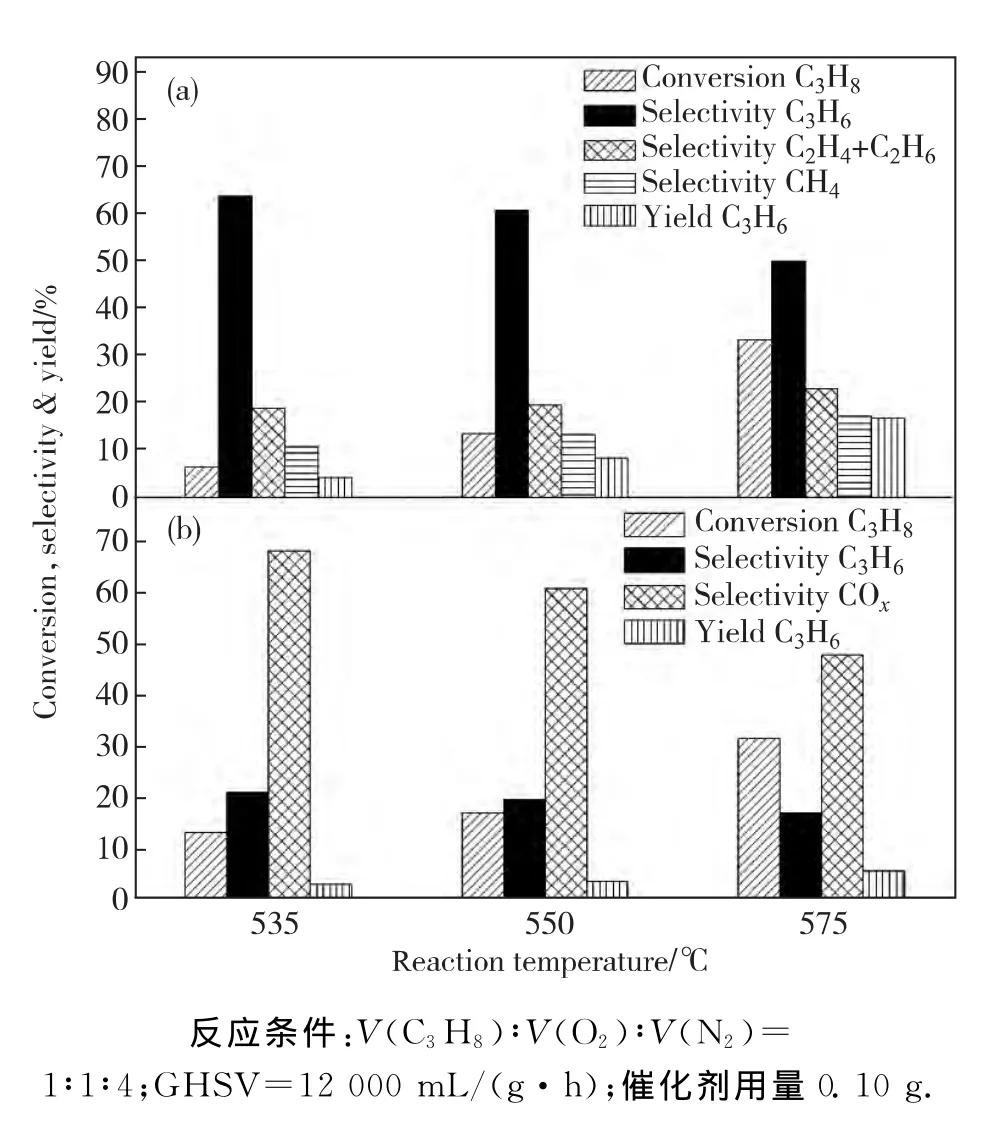
图5 CeF3在650℃焙烧形成的CeO2/CeF3的催化剂(a)和CeO2催化剂(b)在不同反应温度时的ODHP反应性能Fig.5 Catalytic performance for ODHP of CeO2/CeF3(a)prepared from CeF3calcined at 650℃and CeO2(b)under various reaction temperatures
3 结 论
通过XRD、Raman和LEIS等对所制得的CeO2/CeF3表征发现CeF3的分解先从表面开始,形成的CeO2覆盖在CeF3上,其生成量随着焙烧温度的升高而增大.从CeF3制备的CeO2/CeF3的ODHP性能显著高于CeO2的,这可能是F-的存在隔离表面活性氧物种,降低活性氧物种的浓度,抑制了深度氧化产物的生成而提高丙烯的选择性.这也体现在高温焙烧生成更多的CeO2,表面F/O摩尔比降低,F-的隔离作用减弱,丙烯选择性由56.3%降低到42.2%.CeO2/CeF3的稳定性与CeF3核为外层的CeO2源源不断地提供F-有关.
[1]Kaspar J,Fornasiero P,Graziani M.Use of CeO2-based oxides in the three-way catalysis[J].Catal Today,1999,50(2):285-298.
[2]Murray E P,Tsai T,Barnett S A.A direct-methane fuel cell with a ceria-based anode[J].Nature,1999,400(6745):649-651.
[3]Fu Q,Saltsburg H,Flytzani-Stephanopoulos M.Active nonmetallic Au and Pt species on ceria-based water-gas shift catalysts[J].Science,2003,301(5635):935-938.
[4]Wheeler C,Jhalani A,Klein E J,et al.The water-gas-shift reaction at short contact times[J].Journal of Catalysis,2004,223(1):191-199.
[5]Bunluesin T,Gorte R J,Graham G W.Studies of the water-gas-shift reaction on ceria-supported Pt,Pd,and Rh:implications for oxygen-storage properties[J].Appl Catal B:Environ,1998,15(1/2):107-114.
[6]Cargnello M,Gentilini C,Montini T,et al.Active and stable embedded Au@CeO2catalysts for preferential oxidation of CO[J].Chem Mater,2010,22(14):4335-4345.
[7]Solsona B,Concepción P,Hernández S,et al.Oxidative dehydrogenation of ethane over NiO-CeO2mixed oxides catalysts[J].Catal Today,2012,180(1):51-58.
[8]Luo F,Jia C J,Liu R,et al.Nanorods-assembled CeVO4hollow spheres as active catalyst for oxidative dehydrogenation of propane[J].Mater Res Bull,2013,48(3):1122-1127.
[9]Nilius N,Kozlov S M,Jerratsch J F,et al.Formation of one-dimensional electronic states along the step edges of CeO2(111)[J].ACS Nano,2011,6(2):1126-1133.
[10]Boizumault-Moriceau P.Oxidative dehydrogenation of propane on Ni-Ce-O oxide:effect of the preparation method,effect of potassium addition and physical characterization[J].Applied Catalysis A:General,2003,245(1):55-67.
[11]Zhang W D,Zhou X P,Tang D L,et al.Oxidative dehydrogenation of propane over fluorine promoted rare earth-based catalysts[J].Catal Lett,1994,23(1/2):103-106.
[12]Wan H L,Zhou X P,Weng W Z,et al.Catalytic performance,structure,surface properties and active oxygen species of the fluoride-containing rare earth (alkaline earth)-based catalysts for the oxidative coupling of methane and oxidative dehydrogenation of light alkanes[J].Catal Today,1999,51(1):161-175.
[13]Shen W,Wang X D,Cattrall R W,et al.XPS analysis of hydroxide ion surface reactions on reactions on CeF3and LaF3fluoride ion-selective electrodes[J].Electroanalysis,1997,9(12):917-921.
[14]Kuhlenbeck H,Shaikhutdinov S,Freund H J.Well-ordered transition metal oxide layers in model catalysis:a series of case studies[J].Chemical Reviews,2013,113(6):3986-4034.
[15]Campbell C T.Waltzing with O2[J].Science,2003,299(5605):357.
[16]Schaub R,Wahlstrom E,Ronnau A,et al.Oxygen-medi-ated diffusion of oxygen vacancies on the TiO2(110)surface[J].Science,2003,299(5605):377-379.
[17]Over H,Kim Y D,Seitsonen A P,et al.Atomic-scale structure and catalytic reactivity of the RuO2(110)surface[J].Science,2000,287(5457):1474-1476.
[18]Henderson M A,Epling W S,Perkins C L,et al.Interaction of molecular oxygen with the vacuum-annealed TiO2(110)surface:molecular and dissociative channels[J].J Phys Chem B,1999,103(25):5328-5337.
[19]Campbell C T.Chemistry:oxygen vacancies and catalysis on ceria surfaces[J].Science,2005,309(5735):713-714.
[20]Esch F,Fabris S,Zhou L,et al.Electron localization determines defect formation on ceria substrates[J].Science,2005,309(5735):752-755.
[21]Henderson M A.The interaction of water with solid surfaces:fundamental aspects revisited[J].Surface Science Reports,2002,46 (1-8):1-308.
[22]Liu G,Rodriguez J A,Chang Z,et al.Adsorption of methanethiol on stoichiometric and defective TiO2(110)surfaces:a combined experimental and theoretical study[J].J Phys Chem B,2002,106(38):9883-9891.
[23]Gamble L,Jung L S,Campbell C T.Decomposition and protonation of surface ethoxys on TiO2(110)[J].Surface Science,1996,348 (1/2):1-16.
