抗体在靶向基因治疗中的应用
2014-11-30王维刚
王维刚
基因治疗是将人的正常基因或有疾病治疗作用的基因导入人体靶细胞,从而达到治疗目的的生物医学技术。基因治疗正处于持续发展的阶段,已成为重要的医药产业。综合来说,抗体在基因治疗中主要应用于两方面:①直接将抗体基因导入体内,表达出的蛋白产物作为治疗分子发挥治疗作用[1-2];②作为基因转移系统的靶向成分在基因治疗中发挥作用。本文将重点介绍第二方面的研究进展。
将编码治疗分子的 DNA,siRNA(small interfering RNA)或反义 RNA(antisense oliognucleotides)高效、准确地转入体内靶组织和靶细胞是将基因治疗应用于临床的最大技术障碍。基因转运方式主要有两种:病毒法[3]和非病毒法。抗体作为靶向成分在这两类方法中都起着重要作用。利用逆转录病毒、腺病毒进行基因转移的方法缺乏组织、细胞特异性。病毒载体的宿主组织/细胞嗜向性是由病毒衣壳上的蛋白分子(包膜蛋白)决定的。利用基因工程抗体技术将包膜蛋白进行一些修饰,例如与 scFv 做成嵌合蛋白即可赋予病毒新的结合特性。纳米载体(包括脂质体、阳离子多聚体复合物两种形式)的应用在一定程度上改善了 DNA或 siRNA 的体内转运,但并没有在实质上解决组织特异性转运的问题。因此,一种“靶向纳米载体”的概念应运而生。这一概念涉及到两类方法。第一类方法主要依靠“细胞导向配基”(cell targeting ligands,CTLs),比如可以特异性结合脂蛋白受体、整合素、酪氨酸激酶受体以及 G 蛋白偶联受体——GPCR 的短肽和“细胞穿透肽”(cell penetrating peptides,CPPs),比如以 Tat、antennepedia 为代表的短肽[4]。在第二类方法中,抗体作为转运载体的一部分,可以将编码毒素、治疗分子的基因或 siRNA 选择性地携带到靶组织,并将其导入靶细胞。发展以抗体为基础的基因转移,其关键在于抗体-DNA/siRNA 复合物需要同时满足两个条件:第一,所用单抗须具有进行细胞导向所必需的抗原结合特异性;第二,复合物不仅要易于被靶细胞内吞,而且被携带的 DNA/siRNA 需要从内涵体中释放至细胞质中,对DNA 而言还要进入细胞核内,从而实现有效的基因转录和翻译。
1 抗体作为载体携带 siRNA
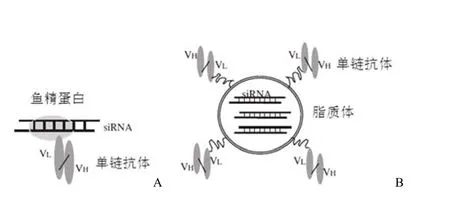
图1 抗体介导 siRNA导向转运的两种策略(A:单链抗体-鱼精蛋白-siRNA 复合物;B:单链抗体靶向的纳米脂质体-siRNA 复合物)
近年来,siRNA 作为药物的开发进展迅速,比如针对年龄相关性黄斑变性(age-related macular degeneration,AMD)的 siRNA 治疗进入了临床 III 期。特异、高效地将siRNA 导入靶细胞是临床治疗所面临的最大挑战。近年来的一系列研究表明抗体介导的 siRNA 导向治疗是可行的。研究者大致采用两种策略(图 1)。第一种方法综合了抗体的特异性和鱼精蛋白(protamine,一种小分子碱性蛋白)的核酸结合属性。将两者制成融合蛋白,再与 siRNA 混合形成复合物,从而实现特异性的 siRNA 导向。第二种方法又称纳米免疫脂质体法,主要涉及两步骤:首先用抗体对脂质体表面进行偶联修饰制成免疫脂质体,从而赋予其导向性;然后将 siRNA 包裹在上述免疫脂质体中。以下将分别讨论这两种策略在 siRNA 导向治疗中的应用。
2005年,Song 等[5]在 Nature Biotechnology 首次报道了一项抗体介导的 siRNA 体内导向研究。用 Fab 或 scFv抗体片段与鱼精蛋白制成融合蛋白,再与 siRNA 混合形成复合物。该纳米复合物的大小刚好高于肾清除的临界值(30~50 kD),改进了裸 siRNA 半衰期短的缺陷。采用表达 HIV 包膜蛋白的黑色素瘤体内模型,将上述复合物与针对肿瘤相关基因的 siRNA(c-myc、MDM2、VEGF)混合并给予荷瘤小鼠,可以将 siRNA 特异性地导入到表达抗体相应抗原的细胞中,有效抑制肿瘤生长。作者还制成了另一融合蛋白:抗 ErbB2 scFv-鱼精蛋白。该融合蛋白可将siRNA 特异性地导入 ErbB2 阳性的乳腺癌肿瘤。Peer 等[6]采用了类似的方法将抗淋巴细胞功能相关抗原-1(LFA-1)scFv 与鱼精蛋白制成融合蛋白,可以高效、特异地将 siRNA导入原代淋巴细胞、单核细胞和树状细胞。体外、体内试验证明该转运系统可以特异地抑制目标基因的表达。
基于类似的思路,一些研究者用抗体进行针对病毒基因的 siRNA 体内导向。Wen 等[7]用抗 HBV scFv或 scFv-Fc片段与鱼精蛋白融合,该融合蛋白可将 siRNA 或 siRNA表达质粒导入转基因鼠体内的靶细胞并抑制基因表达。Kumar 等[8]则尝试用抗 CD7 scFv 与一段含 9 个精氨酸的短肽偶联,该偶联物可将抗病毒 siRNAs 特异地导向小鼠体内的幼稚 T 细胞,从而抑制 HIV 感染。
免疫脂质体(immunoliposome)又名抗体-脂质体偶联物,由抗体和脂质体连接而成,是癌症化疗中重要的药物靶向载体系统,近几年来已经开始用于靶向基因治疗。早期用于核酸转移的免疫脂质体多采用完整抗体,并着重于方法学研究。之后以 scFv 片段作为导向载体的研究取得显著进展。2006年以来,Pirollo 研究组[9-10]发表了一系列采用纳米免疫脂质体进行体内 siRNA 靶向治疗的研究报道,用抗转铁蛋白 scFv 制成纳米免疫脂质体进行体内抗 HER2 siRNA 导向,可以显著降低肿瘤细胞 HER2 基因表达,增强肿瘤对化疗的敏感性。为了提高 siRNA 导向效率,对纳米免疫脂质体做了一系列改进。首先,在该复合物中加入了一种对酸碱度敏感的组氨酸/赖氨酸短肽,提高了细胞内化后 siRNA 从内涵体的释放率。其次,采用了比传统的siRNA 更稳定、更高效的 DNA-RNA 杂合双链。Peer 等[11]采用类似思路,将抗 Cyclin D1 siRNA 系统地导入体内特定白细胞亚群,其靶向转运是通过抗 β7 整合蛋白完整单抗来实现的。Zhang 等[12]则采用了一种略微不同的策略将siRNA 质粒导入小鼠脑组织治疗脑癌。他们选择 EGFR 作为 siRNA 靶点,并用两种单抗对聚乙二醇化的脂质体表面进行修饰:抗鼠转铁蛋白单抗使免疫脂质体得以穿过血脑屏障;抗人胰岛素受体单抗可以使免疫脂质体-siRNA 复合物特异地结合脑瘤细胞表面受体并引发内化。结果表明静脉注射该免疫脂质体-siRNA 复合物可明显降低脑瘤 EGFR 表达水平,显著延长荷瘤小鼠存活时间(88%)。
Avidin-Biotin 是一项稳定、可靠的蛋白连接技术,近年也有多篇报道尝试将其用于 siRNA 的抗体导向治疗[13-14]。将 siRNA 3' 末端生物素化,再与单抗-亲和素(抗生物素蛋白)偶联物混合,即可制成稳定的单抗-siRNA 复合物。静脉注射该抗转铁蛋白单抗-siRNA 复合物可以有效降低小鼠脑内细胞中靶基因的表达(抑制率 69%~81%)。
2 抗体作为载体携带毒素或其他治疗基因
抗体用于基因治疗靶向载体的尝试,实际上最早是由携带编码治疗分子的基因开始的。基因治疗药物的给药途径有两种:即 in vivo 及 ex vivo 方式。
2.1 In vivo 途径
这种途径是指将外源基因装配于真核细胞表达载体中,直接导入体内。抗体作为载体携带毒素基因或其他治疗基因大体也是基于以下两种方法。第一,利用抗体与某些正电荷短肽的融合/偶联蛋白;第二,纳米免疫脂质体法。
除了鱼精蛋白以外,研究者也尝试利用其他正电荷短肽结合抗体进行基因导向,应用较多的是聚乙烯亚胺(PEI)。用化学方法将单抗或单抗片段与 PEI 偶联,再与 DNA 混合即可制成纳米颗粒。一系列抗体,包括抗 G250、Hsp70、HER2、CD3、CD90、EGFR 的单抗或 scFv 与 PEI 偶联物可以将 DNA 表达载体高效、特异地导入到表达相应抗原的靶细胞中[15-20]。
大多数免疫脂质体导向基因转运研究均停留于体外方法学研究阶段。值得注意的是,Chang 研究组在小鼠体内进行了一系列纳米免疫脂质体导向基因治疗研究。用抗转铁蛋白 scFv 制成纳米免疫脂质体携带 p53 表达载体[21],该纳米免疫脂质体-p53 复合物可以将 p53 基因有效地转入靶细胞并表达。联合给予该复合物和化疗药可以显著延长荷瘤鼠存活时间。Pirollo 等[22]用上述免疫脂质体进行体内RB94 导向基因转运,结果表明该免疫脂质体可以将 RB94基因定向转入肿瘤细胞和组织,显著增强肿瘤对化疗药的敏感性。
除上述两种主流方法外,利用 Biotin-Avidin 技术[23]或化学法[24]直接连接抗体和 DNA 载体进行导向基因转移的研究亦有报道。
2.2 Ex vivo 途径
这是指将含外源基因的载体在体外导入自身或异体细胞(或异种细胞),经体外扩增后,再将细胞输回人体。Ex vivo 基因转移途径比较经典、安全,但是步骤多、技术相对复杂。
Chen 等[25]在 1997年首次报道了转染后的哺乳动物细胞可以长期产生和分泌免疫毒素。他们建立了一种特异性针对肿瘤或 HIV-1 感染细胞的新型杀伤细胞,该细胞显著抑制荷瘤裸鼠肿瘤生长,延长动物存活期。之后,Yang研究组陆续进行了一系列抗体导向的免疫促凋亡蛋白(immunoproapoptotic proteins)对肿瘤的杀伤作用研究[26]。他们选择在乳腺癌、卵巢癌及胃癌中呈现过度表达的 HER2作为靶标。克隆改造人促凋亡分子 caspas-3、caspas-6、Granzyme B、AIF 和 BID 等基因,将其与铜绿假单胞菌外毒素 A(PEA)转膜结构域基因和抗 HER2 抗体的基因重组,构建成靶向促凋亡分子基因(图 2)。理论上,用该重组表达载体转染细胞后,抗体-促凋亡蛋白表达后被分泌出细胞外,选择性地与 HER2 阳性的靶肿瘤细胞结合并内化,促凋亡蛋白继而在内涵体中被前蛋白转换酶 Furin 或其他蛋白酶剪切后释放到靶细胞的细胞质,最终诱导肿瘤细胞凋亡。研究者用重组表达载体转染人淋巴瘤 Jurkat 细胞并建成能稳定表达、分泌抗体-促凋亡蛋白的细胞系,再将该细胞培养扩增,并静脉注射荷瘤裸鼠。结果表明,该细胞产生的促凋亡蛋白特异性地分布在肿瘤组织,对 HER2 阳性的乳腺癌、胃癌、肝癌、骨肉瘤、卵巢癌细胞具有高效的杀伤作用。荷瘤裸鼠肿瘤生长受到抑制,存活期显著延长。进而对免疫促凋亡分子中的 PEA 转膜结构域部分进行改造并引入了前蛋白转换酶 Furin 蛋白酶切割位点序列,结果证实这种转膜结构域替换后的靶向促凋亡分子仍能从内吞体转位到细胞质,并有效地杀伤肿瘤细胞。
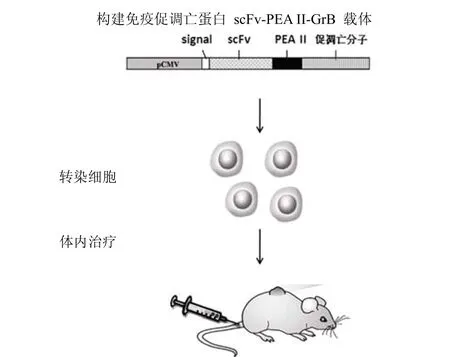
图2 抗体导向的免疫促凋亡蛋白
3 结语
与早期抗体药物的发展过程相仿,基因治疗正处于一个缓慢但持续进步的阶段。以抗体为基础的基因治疗为疾病的治疗提供了新思路,可以作为手术、化疗、放疗等传统治疗方案的辅助措施。抗体或抗体片段可以直接作为治疗分子在体内表达,发挥对疾病的治疗作用,也可以间接作为基因转移系统的靶向成分。尽管还有许多需要解决的技术问题,但值得强调的是,抗体为基础的基因治疗所面临的大部分问题也是其他治疗方法的共同问题。任何相关领域的重大突破也必将极大推动以抗体为基础的基因治疗的发展。
[1] Guijarro-Muñoz I, Compte M, Alvarez-Vallina L, et al.Antibody gene therapy: getting closer to clinical application? Curr Gene Ther, 2013,13(4):282-290.
[2] Lo AS, Zhu Q, Marasco WA.Intracellular antibodies (intrabodies) and their therapeutic potential.Handb Exp Pharmacol, 2008(181):343-373.
[3] Beatty MS1, Curiel DT.Chapter two--Adenovirus strategies for tissue-specific targeting.Adv Cancer Res, 2012, 115:39-67.
[4] Juliano R, Alam MR, Dixit V, et al.Mechanisms and strategies for effective delivery of antisense and siRNA oligonucleotides.Nucleic Acids Res, 2008, 36(12):4158-4171.
[5] Song E, Zhu P, Lee SK, et al.Antibody mediated in vivo delivery of small interfering RNAs via cell-surface receptors.Nat Biotechnol,2005, 23(6):709-717.
[6] Peer D, Zhu P, Carman CV, et al.Selective gene silencing in activated leukocytes by targeting siRNAs to the integrin lymphocyte function-associated antigen-1.Proc Natl Acad Sci U S A, 2007,104(10):4095-4100.
[7] Wen WH, Liu JY, Qin WJ, et al.Targeted inhibition of HBV gene expression by single-chain antibody mediated small interfering RNA delivery.Hepatology, 2007, 46(1):84-94.
[8] Kumar P, Ban HS, Kim SS, et al.T cell-specific siRNA delivery suppresses HIV-1 infection in humanized mice.Cell, 2008, 134(4):577-586.
[9] Pirollo KF, Rait A, Zhou Q, et al.Materializing the potential of small interfering RNA via a tumor-targeting nanodelivery system.Cancer Res, 2007, 67(7):2938-2943.
[10] Pirollo KF, Zon G, Rait A, et al.Tumor-targeting nanoimmunoliposome complex for short interfering RNA delivery.Hum Gene Ther, 2006,17(1):117-124.
[11] Peer D, Park EJ, Morishita Y, et al.Systemic leukocyte-directed siRNA delivery revealing cyclin D1 as an anti-inflammatory target.Science, 2008, 319(5863):627-630.
[12] Zhang Y, Zhang YF, Bryant J, et al.Intravenous RNA interference gene therapy targeting the human epidermal growth factor receptor prolongs survival in intracranial brain cancer.Clin Cancer Res, 2004,10(11):3667-3677.
[13] Boado RJ, Zhang Y, Zhang Y, et al.Genetic engineering, expression,and activity of a chimeric monoclonal antibody-avidin fusion protein for receptor-mediated delivery of biotinylated drugs in humans.Bioconjug Chem, 2008, 19(3):731-739.
[14] Xia CF, Zhang Y, Zhang Y, et al.Intravenous siRNA of brain cancer with receptor targeting and avidin-biotin technology.Pharm Res, 2007,24(12):2309-2316.
[15] Duan Y, Zheng J, Han S, et al.A tumor targeted gene vector modified with G250 monoclonal antibody for gene therapy.J Control Release,2008, 127(2):173-179.
[16] Shiota M, Ikeda Y, Kaul Z, et al.Internalizing antibody-based targeted gene delivery for human cancer cells.Hum Gene Ther, 2007, 18(11):1153-1160.
[17] Chiu SJ, Ueno NT, Lee RJ.Tumor-targeted gene delivery via anti-HER2 antibody (trastuzumab, Herceptin) conjugated polyethylenimine.J Control Release, 2004, 97(2):357-359.
[18] O'Neill MM, Kennedy CA, Barton RW, et al.Receptor-mediated gene delivery to human peripheral blood mononuclear cells using anti-CD3 antibody coupled to polyethylenimine.Gene Ther, 2001, 8(5):362-368.
[19] Strehblow C, Schuster M, Moritz T, et al.Monoclonal antibody-polyethyleneimine conjugates targeting Her-2/neu or CD90 allow cell type-specific nonviral gene delivery.J Control Release,2005, 102(3):737-747.
[20] Suzuki M, Takayanagi A, Shimizu N.Targeted gene delivery using humanized single-chain antibody with negatively charged oligopeptide tail.Cancer Sci, 2004, 95(5):424-429.
[21] Xu L, Pirollo KF, Chang EH.Tumor-targeted p53-gene therapy enhances the efficacy of conventional chemo/radiotherapy.J Control Release, 2001, 74(1-3):115-128.
[22] Pirollo KF, Rait A, Zhou Q, et al.Tumor-targeting nanocomplex delivery of novel tumor suppressor RB94 chemosensitizes bladder carcinoma cells in vitro and in vivo.Clin Cancer Res, 2008, 14(7):2190-2198.
[23] Theoharis S, Krueger U, Tan PH, et al.Targeting gene delivery to activated vascular endothelium using anti E/P-Selectin antibody linked to PAMAM dendrimers.J Immunol Methods, 2009, 343(2):79-90.
[24] Jin X, Mei L, Song C, et al.Immobilization of plasmid DNA on an anti-DNA antibody modified coronary stent for intravascular site-specific gene therapy.J Gene Med, 2008, 10(4):421-429.
[25] Chen SY, Yang AG, Chen JD, et al.Potent antitumour activity of a new class of tumour-specific killer cells.Nature, 1997, 385(6611):78-90.
[26] Jia LT, Chen SY, Yang AG.Cancer gene therapy targeting cellular apoptosis machinery.Cancer Treat Rev, 2012, 38(7):868-876.
