抗肿瘤抗体药物的研究趋势
2014-11-30邵荣光
邵荣光
抗体药物是发展最快的生物药物之一,为创新药物市场带来了巨大的利益,其中抗肿瘤抗体药物占主导地位[1]。自1979年第一个治疗癌症的抗体药物利妥昔单抗被美国FDA 批准上市以来,已有 17 个抗体药物被批准用于癌症治疗,但是其中的吉妥单抗撤出了市场[2-3]。2013年的统计显示,目前处于临床研究的抗体药物大约有 350 个,其中大部分都处在早期评估阶段[4]。处在 III 期临床研究的治疗性抗体包括 28 个单抗药物和 1 个单抗混合物,主要用于癌症、炎症或免疫疾病、高胆固醇、骨质疏松症、阿尔茨海默病和传染病,其中肿瘤治疗抗体 10 个,非肿瘤治疗抗体19 个。还有许多抗体药物处在临床前研究,其研究趋势主要集中在以下几个方面,包括:抗体新靶点的发现与确认,降低抗体免疫原性的新策略,抗体与药物的偶联物,双特异性抗体以及其他新型抗体药物的研究[5-9]。
1 发掘新的抗体靶分子
目前抗体药物的靶分子主要分为三大类:①临床验证的靶分子,该类靶分子的功效已经得到证实,例如:CD20、HER2、EGFR、VEGFA、EpCAM 和 CTLA-4 等;②实验验证的靶分子,该类靶分子的功效在细胞和动物上得到证实,例如:IGF-1R、IGF-1/2、HGF、c-Met、HER3、VEGF/VEGF-R、TRAIL-R、IL6/IL6R、IL4/IL13、CD19、CD22、CD30、CD33、CD44、CD80、CXCR4 和 ICAM-1等;③新功能的靶分子,为新发现的具有一定功效的靶分子,例如:RAAG12、CD9、JAM-A、CD151、TSN-1 等。
迄今,已经批准上市的抗肿瘤抗体药物作用靶分子为数不多,目前只有 9 个。已报道的肿瘤相关的生物标志分子有许多,因此还有许多用于抗体治疗的靶分子可以挖掘。即便是同一个已经开发的靶分子,也有不同的分子表位,可以研制出针对不同表位的抗体药物,如抗 CD20 的抗体药物有 5 个已上市,现在还有 5 个处在临床研究中。
另外,许多肿瘤细胞跨膜受体和细胞外基质相关基因通过差异拼接,可以产生新的剪辑序列,形成新的差异受体和基质,作为新的抗体靶分子。已报道的差异剪接基因变种产物有:FGFR(成纤维生长因子受体)变异体、EGFR(表皮生长因子受体)变异体、EpCAM(上皮细胞黏附分子)变异体、L1CAM(L1 细胞黏附分子)变异体、Claudin18 和CD44 变异体以及多功能蛋白聚糖 VN、纤连蛋白 FN、肌腱蛋白 TN、骨桥蛋白 O、纤维连结蛋白 F 和生腱蛋白 T的剪接变异体等。
近年来,研究较多的肿瘤相关抗体靶分子有 EpCAM、CEA、gpA33、Mucins、TAG-72、CAIX、PSMA 和叶酸结合蛋白,还有神经节苷脂、LeY、αVβ3、α5β1、MET、IGF1R、EPHA3、TRAILR1、TRAILR2、FAP 和韧黏素等。最近报道,磷脂酰肌醇蛋白聚糖也可以作为肝癌抗体治疗的新靶分子[10]。
2 降低抗体免疫原性
许多抗体药物为鼠源性抗体,临床治疗中会产生人抗鼠抗体(HAMA)反应。因此,对于治疗过程长、需反复多次给药的抗体药物容易产生 HAMA 反应,需要进行人源化改造,以降低其免疫原性。人源化抗体包括嵌合抗体、改形抗体等,其生物特性是 HAMA 反应降低,在血中半衰期延长。与鼠源性抗体比较,人源化抗体药物的功能效应部分可以按需要进行改造,抗体的人源化恒定区在治疗中能避免抗同型抗体的产生。与嵌合抗体比较,改形后的抗体进一步减少了抗体中鼠源部分的比例,能显著降低 HAMA 反应。
此外,全人源抗体的研究也非常受重视,是抗体药物研究的重要发展方向之一。利用噬菌体展示技术、抗体库筛选技术和转基因动物技术可获得完全的人源抗体,此技术生产的抗肿瘤抗体药物对癌症生长具有明显的抑制作用。
抗体药物的免疫原性是其主要的毒副作用之一,但对免疫原性发生的频率和时间,以及抗体的聚集等问题还没有可靠的预测方法,如若解决这些问题需要发展新的抗体检测技术。据报道,研究比较全人源抗体、人源化抗体和鼠源性抗体在人体中的免疫原性,结果表明:①大于 20% 的小鼠源性抗体诱导产生的免疫原性是可以容忍的或可忽略不计的,这些小鼠抗体不需要人源化;②人源化抗体可以降低免疫原性,但它们的临床治疗效果也明显下降;③不同来源抗体的免疫原性不是完全符合规律的,少数人源化抗体和全人源抗体也会产生明显的免疫反应;④需要逐项评估全人抗体和人源化抗体的效用,也需要考虑成本效益,同时考虑生化特性和有针对性的治疗适应证。
迄今为止,还没有很好的手段彻底消除抗体结合宿主细胞发生免疫反应的风险。但经典的研究工作表明,如果我们能够创建方法预防抗体的聚集或免疫复合物的形成,单体免疫球蛋白本质上是可以耐受的[11]。
3 抗体与药物偶联物
SGN-35 和 T-DM1 等抗体药物偶联物(ADC)已经在临床上获得成功,新技术可以促进 ADC 的发展。ADC 研究需要关注对抗体、药物和连接剂的优化,以获得更理想的ADC 药物。
⑴抗体与抗原:①靶抗原选择性强,选择肿瘤特异性相关抗原,在肿瘤中高表达,在正常组织中不表达或低表达;②抗原具有良好的结构均一性,以便抗原抗体结合有高度的亲和力;③ADC 抗体与抗原结合后能够被内化进入细胞;④抗体具有合适的连接位点,连接药物后不影响 ADC 的稳定性、结合力、内化和药效;⑤抗体具有较低的免疫原性。
⑵药物特性:①药物容易被化学修饰,有较好的连接基团;②具有较好的稳定性,抗体药物在血循环中不被代谢,进入肿瘤细胞后药物被激活;③药物的高效性,如加里奇霉素、力达霉素、duocarmycin、美登素衍生物、auristatin 衍生物等,在低浓度(nmol/L)水平能杀灭肿瘤细胞;④已阐明药物的作用机制,为临床研究提供理论基础;⑤无局部旁观者效应,能降低其毒副作用。
⑶连接:①连接键在血循环中稳定,不受血流中各种因素的影响;②选择在细胞内裂解,释放生物活性药物,如腙(连接)键在肿瘤细胞溶酶体酸性环境中分解,双硫(连接)键在肿瘤细胞内被还原,肽(连接)键被溶酶体中的蛋白酶分解;③连接剂对抗体的连接位点要有选择性,对连接药物的数量有一定的限制,以达到 ADC 药物的均一性。④经常采用的连接基团包括:基于赖氨酸的偶联,链间的二硫键偶联,工程半胱氨酸的点特异性偶联,非天然氨基酸的点特异性偶联等。
T-DM1 是用第二代硫醚键连接剂制备的 ADC(thiomAbs)药物,以硫醚键连接的 ADC 同样具有很好的抗肿瘤效果。游离药物的释放可能是由于抗体经细胞内吞后被溶酶体降解引起的,被释放的带有赖氨酸残基的美登素衍生物其细胞毒活性并不降低。硫醚键 ADC 在体内半衰期延长,且耐受性好,治疗窗得到明显改善。用非裂解的硫醚键代替可裂解的二肽键研发的 ADC 在体内试验同样可以获得相似的治疗活性。
4 双(多)特异抗体药物
大部分上市的抗体药物针对单一抗原,只能作用于一个靶分子。然而,复杂疾病在本质上往往是多因素的,涉及疾病介质的过度表达或相互协同作用,或不同受体的上调,包括其信号网络中分子相互作用。因此,阻断多信号途径,可以提高治疗性抗体的疗效。通过使用双靶向策略可以实现这样的治疗效果,双特异性抗体治疗已成为抗体治疗的手段之一[12]。双特异性抗体 catumaxomab(Removab)已于 2009年获得了欧洲药品局批准,用于恶性肿瘤腹水的治疗。它能同时靶向 EpCAM 和 CD3 肿瘤生物分子,通过 Fc 段介导活化巨噬细胞、NK 细胞和共刺激的 T 细胞应答,杀伤肿瘤细胞。
制药公司制备的双特异性抗体形式多样,如双可变域抗体(Abbott)、二合一抗体(Genentech)、双亲和性靶向抗体(MacroGenics)、κ-λ 体抗体(NovImmune)、双特异性 T 细胞接合子抗体(Micromet)和化学生成抗体(CovX/Pffizer)等。其作用模式:①同时抑制两种表面受体;②同时阻断两种配体;③抑制不同受体和配体;④两种受体交联;⑤招募T 细胞接近肿瘤等方式。由于其独特的结构和作用模式,双特异性抗体可能会更有效,成本更低。进入临床研究的双特异性抗体数量不断增加,2010–2011年就有 5 个新的双特异性抗体进入临床研究。大多数双特异性单克隆抗体在早期临床研究中,有 10 个在第 I 期临床,有 2 个在第 II 期临床研究中。
在双特异性抗体的基础上,人们开始研究多特异性抗体,特别是靶向肿瘤的多特异性抗体药物。在许多肿瘤中(如乳腺癌、黑色素瘤、多发性骨髓瘤、头颈部瘤、肺癌、前列腺癌、卵巢癌和结肠癌等)至少有三种以上的癌基因高表达,而且不同肿瘤表达的基因谱也不一样(表 1)。由此可见,癌症相关生存途径的复杂性和难治性。因此,恶性肿瘤的治疗需要通过多特异性抗体治疗策略得以实现。来自美国旧金山 Mol Med Tri-Con 2013 会议报告,在 cDNA 融合技术基础上建立多特异性抗体研究开发平台,可以获得不同类型的多特异性抗体,包括双特异性、三特异性、四特异性和五特异性抗体,以及八价双特异性抗体(图 1)。
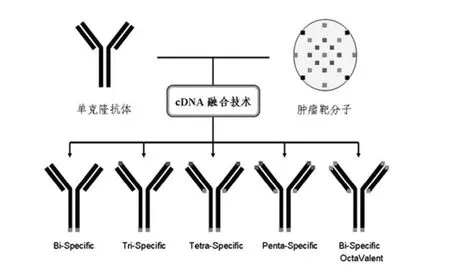
图1 多特异性抗体研究技术平台
5 其他新型抗体药物
通过抗体糖基化物理化学和功能分析,以及抗体结构优化,研发新一代抗体药物。新一代抗体药物具有不同的氨基酸序列,改良抗体可变区域(更好的亲和力)或改良 Fc 区域(糖基或氨基酸工程化)提高效应功能或半衰期。目前,抗体仿制药(包括 biosimilar、biobetter 或 biosuperior)的研发越来越受关注。Biosimilar 抗体是已批准上市抗体的复制品,具有相同的氨基酸序列,来源于不同的克隆,生产工艺能够导致糖基化的不同和其他微小变化。Biobetter 抗体具有非常接近的氨基酸序列,但是优化了糖基化(低海藻糖提高 ADCC,减少免疫原性)。可以通过工程化 Fc 区域(用两个或三个氨基酸突变)提高血清半衰期。
小分子免疫蛋白(SMIPs)也是研发的热点方向,如抗体融合蛋白、单链抗体等。这种小分子抗体的优点:①分子量小,免疫原性低,用于人体不易产生抗异种蛋白反应;②容易进入实体瘤周围的微循环甚至实体瘤内部;③血循环和全身廓清较快,半衰期短,肾脏蓄积很少,不容易对全身正常组织产生不利影响;④无 Fc 段,不易与具有 Fc 受体的非靶细胞结合;⑤小分子抗体基因构建比较简单,易于操作和改造;⑥Fab 可与高效“弹头”药物构成免疫偶联物,单链抗体可与毒素、前体药物转化酶、细胞因子等构成双功能抗体分子。
综上所述,当前的治疗性抗体研究趋势主要是以解决临床治疗中出现的问题展开的,抗体药物的研究已越来越有针对性。此外,研究者还开展了多肽体(peptibodies,多肽-Fc融合蛋白)[13]、同种抗体(homophilic antibodies)[14]、化学编程抗体(chemically programmed antibodies,cpAbs)[15]等抗体药物研究。可以预见,将来会有更多类型的抗肿瘤抗体药物进入临床研究。
[1] Zhen YS.Antibody engineering pharmaccutics: Hotspot field of biotechnological pharmaceutics//Zhen YS, Shao RG.Antibody engineering pharmaccutics.Beijing: Chemical Industry Press, 2002:1-7.(in Chinese)甄永苏.抗体工程药物: 生物技术制药领域的热点//甄永苏, 邵荣光主编.抗体工程药物.北京: 化学工业出版社, 2002:1-7.
[2] Shao RG.Overview and frontier of antibody-based drug research//Shao RG, Zhen YS.Research and application of antibody-based drugs.Beijing: People's Medical Publishing House, 2013:3-36.(in Chinese)邵荣光.抗体药物研究概况与前沿//邵荣光, 甄永苏.抗体药物研究与应用.北京: 人民卫生出版社, 2013:3-36.
[3] Vacchelli E, Aranda F, Eggermont A, et al.Trial watch:Tumor-targeting monoclonal antibodies in cancer therapy.Oncoimmunology, 2014, 3(1):e27048.
[4] Reichert JM.Which are the antibodies to watch in 2013? MAbs 2013,5(1):1-4.
[5] Ho M, Royston I, Beck A.2nd PEGS annual symposium on antibodies for cancer therapy: April 30-May 1, 2012, Boston, USA.MAbs, 2012,4(5):562-570.
[6] Lacy SE, Bond CJ, Benjamin D, et al.Americas antibody congress:September 21-23, 2009, Washington, D.C.MAbs, 2009, 1(6):523-530.
[7] Dhimolea1 E, Reichert JM.World bispecific antibody summit.September 27-28, 2011, Boston, MA.MAbs, 2012, 4(1):4-13.
[8] Lugovskoy AA, Reichert JM, Beck A.7th annual European antibody congress 2011: November 29-December 1, 2011, Geneva, Switzerland.MAbs, 2012, 4(2):134-152.
[9] Beck A, Wurch T, Bailly C, et al.Strategies and challenges for the next generation of therapeutic antibodies.Nat Rev Immunol, 2010,10(5):345-352.
[10] Feng M, Ho M.Glypican-3 antibodies: a new therapeutic target for liver cancer.FEBS Lett, 2014, 588(2):377-382.
[11] Waldmann H.Human monoclonal antibodies: the residual challenge of antibody immunogenicity.Methods Mol Biol, 2014, 1060:1-8.
[12] Kontermann RE.Dual targeting strategies with bispecific antibodies.MAbs, 2012, 4(2):182-197.
[13] Shimamoto G, Gegg C, Boone T, et al.Peptibodies: a flexible alternative format to antibodies.MAbs, 2012, 4(5):586-591.
[14] Kohler H. Homophilic antibodies as immunotherapeutics.Immunotherapy, 2013, 5(3):235-246.
[15] Rader C.Chemically programmed antibodies.Trends Biotech, 2014,32(4):186-197.
