抗明胶酶单链抗体与力达霉素融合蛋白抗肿瘤作用机制及疗效研究
2014-10-31高瑞娟尚伯杨盛唯瑾赵春燕李电东甄永苏
高瑞娟,尚伯杨,盛唯瑾,赵春燕,李电东,甄永苏
抗明胶酶单链抗体与力达霉素融合蛋白抗肿瘤作用机制及疗效研究
高瑞娟,尚伯杨,盛唯瑾,赵春燕,李电东,甄永苏
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所肿瘤室
探讨抗明胶酶单链抗体 Fv 与力达霉素(LDM)融合蛋白的抗肿瘤作用机制及疗效。
采用三联径向加压 C4柱制备 LDM 发色团 AE,体外分子重建将其装入融合蛋白Fv-LDP 中,Superdex 75 层析获得 Fv-LDP-AE。反相 HPLC 测定纯度或相对含量。流式细胞术测定 DNA 含量;采用 SA-β-gal 染色、Western blot 和细胞伤口愈合实验分别检测药物对细胞衰老、蛋白表达和迁移的影响;通过动物模型评价药物疗效。
Fv-LDP-AE 承袭了 LDM 诱导肿瘤细胞周期阻滞、凋亡和裂亡的作用特点,并显示出更强的诱导衰老和抗迁移作用。Fv-LDP-AE 诱导凋亡和抑制迁移依次与 caspases 通路激活和 MMP-2 降调节有关。Fv-LDP-AE 可抑制小鼠和裸鼠移植瘤生长,抑制率分别可达到 86.6% 和 82.5%。
Fv-LDP-AE 对小鼠和裸鼠移植瘤有效,可能与其对细胞周期阻滞、凋亡、裂亡和衰老的诱导以及迁移的抑制有关。
明胶酶类; 单链抗体; 肿瘤微环境; 力达霉素
明胶酶(gelatinases,Gel)是在肿瘤侵袭和转移过程中扮演重要角色的基质金属蛋白酶(matrix metalloproteinases,MMPs)家族重要成员,包括 MMP-2(Gel-A)和 MMP-9(Gel-B)两种组分[1]。明胶酶在大多数肿瘤细胞高表达,其亦可分泌到肿瘤细胞外,诱导肿瘤微环境细胞发生上皮间质转化(epithelial-mesenchymal transition,EMT),使它们产生更多的明胶酶[2-3]。可是,明胶酶在正常细胞中却表达极低甚或检测不到,因而是临床上判断肿瘤恶性程度、转移和预后的重要指标[4-5]。在功能上,明胶酶能够降解基底膜和细胞外基质中的IV型胶原等多种成分,促进肿瘤生长、侵袭和转移[6]。抑制明胶酶活性可抑制肿瘤生长、侵袭和转移[7]。因此,明胶酶已成为抗癌药物研究的重要分子靶点[8]。
力达霉素(lidamycin,LDM),又名 C-1027,是一种九元环烯二炔抗肿瘤抗生素。LDM具有高效抗肿瘤活性,其体外细胞毒性比丝裂霉素和阿霉素强 10000 倍;在体内,LDM 对小鼠和裸鼠移植瘤亦具有显著疗效[9-11]。LDM 结构独特,由一个烯二炔发色团 AE(843 D)和一个酸性辅基蛋白 LDP(10500 D)以非共价键结合而成[12]。AE 嵌入双螺旋 DNA 分子小沟时,分子结构发生诱变,所形成的苯环型双自由基中间体能够夺取核苷酸核糖骨架 C4'、C1' 和 C5' 位的氢原子,导致 DNA 单链和(或)双链断裂[13]。AE 本身极不稳定,LDP 对 AE 活性起保护作用。AE 和 LDP 在体外可被拆分和重建,重建 LDM 与天然 LDM 活性相同[14]。因此,LDM 是比较理想的高效“弹头”分子。
融合蛋白 Fv-LDP-AE 是作者实验室以明胶酶为靶点,以抗明胶酶单链抗体 scFv(3G11)为运载体,以 LDM 为高效“弹头”,先通过 DNA 重组构建并表达融合蛋白 Fv-LDP,然后再通过体外分子重建技术将 LDM 游离 AE 装配其中而制备的一种抗肿瘤侵袭转移小型化抗体药物。其设计理念是通过药物对明胶酶的特异靶向作用,将高效“弹头”LDM 富集至明胶酶高表达肿瘤及其微环境细胞,主要依靠 LDM 杀伤作用来治疗肿瘤。先前,作者已建立重组菌中 Fv-LDP 含量测定新方法,优化了该重组菌高效表达所需的最佳培养基组分和培养条件,实现了高密度发酵,并完成了 Fv-LDP 制备过程优化[15-18]。本文将在前述研究基础上,分离 LDM 游离发色团 AE,并通过体外分子重建技术制备融合蛋白 Fv-LDP-AE,进而深入探讨其抗肿瘤作用机制及疗效。
1 材料与方法
1.1 主要材料
1.1.1 试药 LDM 由本所金莲舫老师提供;融合蛋白 Fv-LDP 参照文献[18]自制。
1.1.2 色谱柱 HiLoad™ Superdex 75 预装柱(600 mm × 16 mm)购自美国 GE 公司;三联径向加压 Delta-PAK C4柱(30 nm,100 mm × 25 mm)购自美国 Waters 公司;Vydac C4分析柱(5 µm,150 mm × 4.6 mm)购自美国 Grace 公司。
1.1.3 细胞株 明胶酶高表达的人肝癌 BEL-7402 和人巨细胞肺癌 PG-BE1 细胞分别购自中国医学科学院肿瘤医院和北京协和细胞资源中心[19],而表达明胶酶的小鼠肝癌22(H22)细胞由本室保存并经昆明小鼠腹水传代培养[20]。
1.1.4 实验动物 18 ~ 20 g 雌性昆明小鼠和 BALB/c 裸鼠分别购于军事医学科学院实验动物中心[动物许可证号:SCXK(军)2012-0004]和北京维通利华实验动物技术有限公司[动物许可证号:SCXK(京)2012-0001],均饲养在标准的明暗各半的环境中,20 ~ 22 ℃,相对湿度 50% ~ 60%[设施许可证号:SYXK(京)2012-0021]。所有受试动物均可自由进水和摄食。所有实验均按照国际公认的实验动物照料和使用原则进行。
1.1.5 主要试剂 RPMI 1640 培养液和胎牛血清分别购自美国 Hyclone 和 Gibco 公司;预染蛋白 marker 和 BCA 试剂盒购自美国 Pierce 公司;所有兔抗 anti-cleaved PARP、anti-caspase-3、anti-cleaved caspase-3、anti-caspase-9、anti-cleaved caspase-9、anti-MMP-2、anti-MMP-9、anti-β-actin 和辣根过氧化物酶 HRP 标记羊抗兔 IgG 购自美国 CST 公司;乙腈和三氟乙酸购自德国 Merck 公司;戊二醛购自美国 Sigma 公司;RNase A、PI 和 X-gal 购自美国 Amresco 公司;其他均为国产分析纯。
1.2 方法
1.2.1 LDM 游离 AE 制备 将 100 mg LDM 粉剂溶于 1 ml 水中,采用三联径向加压Delta-PAK C4柱对其进行层析分离以制备游离 AE。制备条件为:流动相为含 22% 乙腈的 0.0125% 三氟乙酸溶液,检测波长为 350 nm,流速为 4 ml/min。采用 Vydac C4分析柱,通过反相 HPLC 分析分段收集的 AE 样品,并将活性 AE 浓度较高者合并。反相 HPLC 分析时,流动相和检测波长同“游离 AE 制备条件”,流速为 0.6 ml/min。
1.2.2 Fv-LDP-AE 制备及热稳定性分析 将LDM游离 AE 按分子比 5:1 轻柔加入Fv-LDP/PBS 溶液中(体积比为 1:50),4 ℃,50 ×振摇 16 h。超滤浓缩混合物,Superdex 75 预装柱层析以去除未偶联游离 AE。Fv-LDP-AE 鉴定使用 Vydac C4分析柱采用反相 HPLC 进行,条件同步骤“1.2.1”。热稳定性检测时,等量分装 Fv-LDP-AE 样品于 1.5 ml 离心管,置于 37 ℃水浴中,并于特定时间点取出,使用 Vydac C4分析柱并用上述流动相和流速进行反相 HPLC 分析,检测波长为 280 nm 和 350 nm。
1.2.3 流式细胞术 Fv-LDP-AE 处理细胞 4 h,PBS(pH 7.4)洗 3 次,换入新鲜培养液继续培养 72 h。收集悬浮和贴壁细胞,110 ×离心 5 min,弃上清;预冷 PBS 洗 2 次,预冷 70% 乙醇 –20 ℃固定过夜。上机检测前,110 ×离心 10 min,弃乙醇,预冷 PBS 洗 2 次,加入 RNase A 至终浓度 50 μg/ml,37 ℃消化 30 min,加入终浓度65 μg/ml 的 PI,避光染色 1 h。400 目尼龙网过滤细胞,流式细胞仪测定 DNA 含量。
1.2.4 衰老相关-β-半乳糖苷酶染色 对数期细胞消化计数,按 4 × 104个/孔接种于 24 孔板内。次日,加入不同浓度药物处理 4 h,继续培养72 h 后,0.5 % 戊二醛室温固定 10 min,PBS(pH 7.4)洗 3 次,2 mmol/L MgCl2洗 1 次,衰老相关-β-半乳糖苷酶(SA-β-gal)染色液[1 mg/mlX-gal、5 mmol/L K3Fe(CN)6、5 mmol/L K4Fe(CN)6、150 mmol/L NaCl、2 mmol/L MgCl2、40 mmol/L 柠檬酸/Na2HPO4,pH 6.0]于 37 ℃染色 16 ~ 20 h,倒置显微镜下计数 β-半乳糖苷酶染色阳性细胞,细胞总数为 300 个,结果以阳性细胞数占总细胞数的百分比表示。
1.2.5 Western blot Fv-LDP-AE 处理细胞 4 h,PBS(pH 7.4)洗 3 次后加入新鲜培养液继续培养 72 h。悬浮细胞收集后用细胞裂解液直接裂解;贴壁细胞用预冷 PBS 洗 3 次,加入细胞裂解液裂解后用细胞刮刀刮下,与裂解的悬浮细胞合并收集到 1.5 ml Eppendorf 管中,冰上继续裂解 30 min,4 ℃、20 000 ×离心 10 min,BCA 试剂盒测定上清蛋白浓度。SDS-PAGE 分离等量上清蛋白,半干电转至 PVDF 膜,含 5% 脱脂奶粉的 TBST(20 mmol/L Tris base、150 mmol/L NaCl、0.05% Tween-20,pH7.5)室温封闭至少 1 h,加入 1:1000 稀释的一级抗体于 4 ℃孵育过夜;TBST洗3 次,用 1:2000 稀释的 HRP 标记羊抗兔 IgG 于室温孵育 2 h;TBST 洗 3 次,化学发光液显色,拍照。
1.2.6 细胞伤口愈合实验 采用细胞伤口愈合实验研究 LDM 和 Fv-LDP-AE 对人肝癌BEL-7402 细胞迁移的影响[21]。对数生长期细胞接种于 6 孔板中,次日用 20 μl 无菌吸头在板中划线。37 ℃预温 PBS 洗 3 次,加入不同浓度 LDM 或 Fv-LDP- AE 处理 24 h,光学显微镜观察,拍照。药物处理后细胞内明胶酶表达水平通过 Western blot 方法进行检测和均一化比较。
1.2.7 动物模型 取小鼠 H22 腹水,以生理盐水稀释成细胞数为 1.5´106个/0.2 ml 接种于昆明小鼠右侧腋窝皮下(第 0 天)。次日,荷瘤小鼠被随机分成 5 组,每组 10 只。在第 1 天和第 7 天,分别静脉给予 0.4、0.6 和 0.8 mg/kg Fv-LDP-AE,以 0.05 mg/kg LDM 作为对照药物同步给予,无药对照组以生理盐水进行注射。实验第 11 天处死动物,剥离肿瘤并测瘤重,计算抑制率。
1.3 统计学处理
两组之间比较采用 Student’s检验,< 0.05 代表差异显著,< 0.01 表示差异高度显著。
2 结果
2.1 Fv-LDP-AE 制备及其热稳定性
LDM 可被拆分成 LDP 和 AE,在监测记录纸上显示为 5 个峰(图 1A),将其中的活性 AE 峰(P4)单独收集,反相 HPLC 分析其保留时间为 7.952 min,纯度为 95% 以上(图 1B)。通过体外分子重组技术,LDM 游离 AE 可被整合入 Fv-LDP 中,形成融合蛋白 Fv-LDP-AE。反相 HPLC 结果显示,Fv-LDP-AE 呈现保留时间分别为 2.966、7.789 和 8.980 min 的 3 个色谱峰,依次为 Fv-LDP、活性 AE 以及芳构化 AE(图 2A)。Fv-LDP-AE 热稳定性检测结果显示,Fv-LDP 部分在前 2 h 内降解迅速,之后会相对稳定,在 48 h 时仍有 36.8% 的样品以完整 Fv-LDP 存在;AE 部分相对不稳定,其含量随温育时间延长逐渐减少,在 48 h 时,仅有 19.3% 的 AE 以活性形式存在(图 2B)。
2.2 Fv-LDP-AE 承袭了 LDM 对人肿瘤细胞周期阻滞、凋亡和裂亡的诱导作用
图 3 结果显示,0.01 nmol/L Fv-LDP-AE 可使 BEL-7402 和 PG-BE1 细胞周期阻滞于S 期和G2 + M 期,更大浓度时则使 PG-BE1 细胞阻滞于G2 + M 期;Fv-LDP-AE 可诱导 BEL-7402 和 PG-BE1 细胞同时发生凋亡和裂亡,细胞死亡比例呈剂量依赖性增加。对照药 LDM 亦可诱导这两种细胞产生类似的周期阻滞与细胞死亡效果。Western blot 进一步研究发现,Fv-LDP-AE 和 LDM 均能够激活人 BEL-7402 细胞中的凋亡相关蛋白 caspase-3 和 caspase-9 表达,产生 PARP 切割带(图 4)。这些结果提示,Fv-LDP-AE 承袭了 LDM 诱导人肿瘤细胞周期阻滞、凋亡和裂亡的作用特点,Fv-LDP-AE 和 LDM 诱导人 BEL-7402 细胞凋亡与 caspase-3 和 caspase-9 激活有关。

OD3500.020 0.015 0.010 0.005 0 2 4 6 8 10 A 时间(min)Time (min)B
Figure 1 Separation (A) and reverse-phase HPLC analysis (B) of free AE from LDM
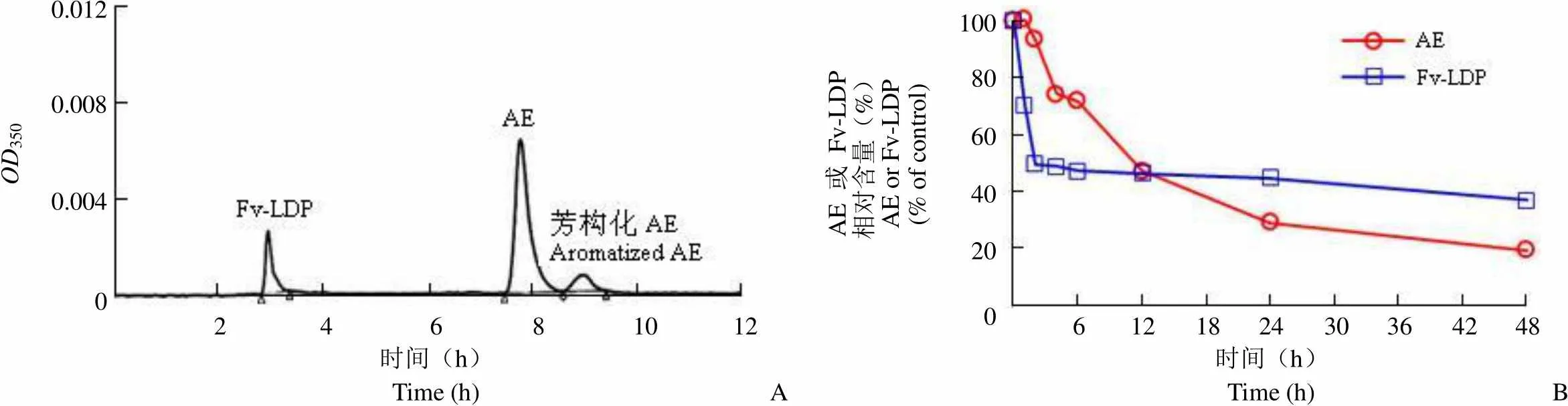
OD3500.012 0.008 0.004 0 AE 或 Fv-LDP 相对含量(%)AE or Fv-LDP (% of control)100 80 60 40 20 0 2 4 6 8 10 12 6 12 18 24 30 36 42 48 时间(h)Time (h)A 时间(h)Time (h)B
Figure 2 Identification (A) and thermostability (B) of Fv-LDP-AE analyzed by reverse-phase HPLC

对照 Control 0.01 nmol/L LDM 0.5 nmol/L LDM BEL-7402 细胞数No. of BEL-7402 cells 对照 Control 0.01 nmol/L Fv-LDP-AE 0.5 nmol/L Fv-LDP-AE BEL-7402 细胞数No. of BEL-7402 cells DNA 含量DNA content A 对照 Control 0.01 nmol/L LDM 0.1 nmol/L LDM PG 细胞数No. of PG cells 对照 Control 0.01 nmol/L Fv-LDP-AE 0.1 nmol/L Fv-LDP-AE PG 细胞数No. of PG cells DNA 含量DNA content B
Figure 3 Cell cycle arrest, apoptosis and mitotic cell death analyzed by flow cytometry in human hepatoma BEL-7402 (A) and PG-BE1 (B) cells treated with LDM and Fv-LDP-AE, respectively
2.3 Fv-LDP-AE 比 LDM 5177有更强的诱肿瘤细胞衰老作用
为了研究LDM 和Fv-LDP-AE 对衰老样表型的影响,我们检测了 BEL-7402 和PG-BE1 细胞中 SA-β-gal 表达情况。结果显示,Fv-LDP-AE 呈剂量依赖性诱导 BEL-7402 和 PG-BE1 细胞衰老,其中 0.1 nmol/L Fv-LDP-AE 可使 BEL-7402 和 PG-BE1 细胞 SA-β-gal 表达阳性率分别比无药对照组提高 3 倍和 6.4 倍,比等摩尔 LDM 组分别提高 18.6% 和 12.3%,提示 Fv-LDP-AE 诱导肿瘤细胞衰老活性强于对照药 LDM(图 5)。
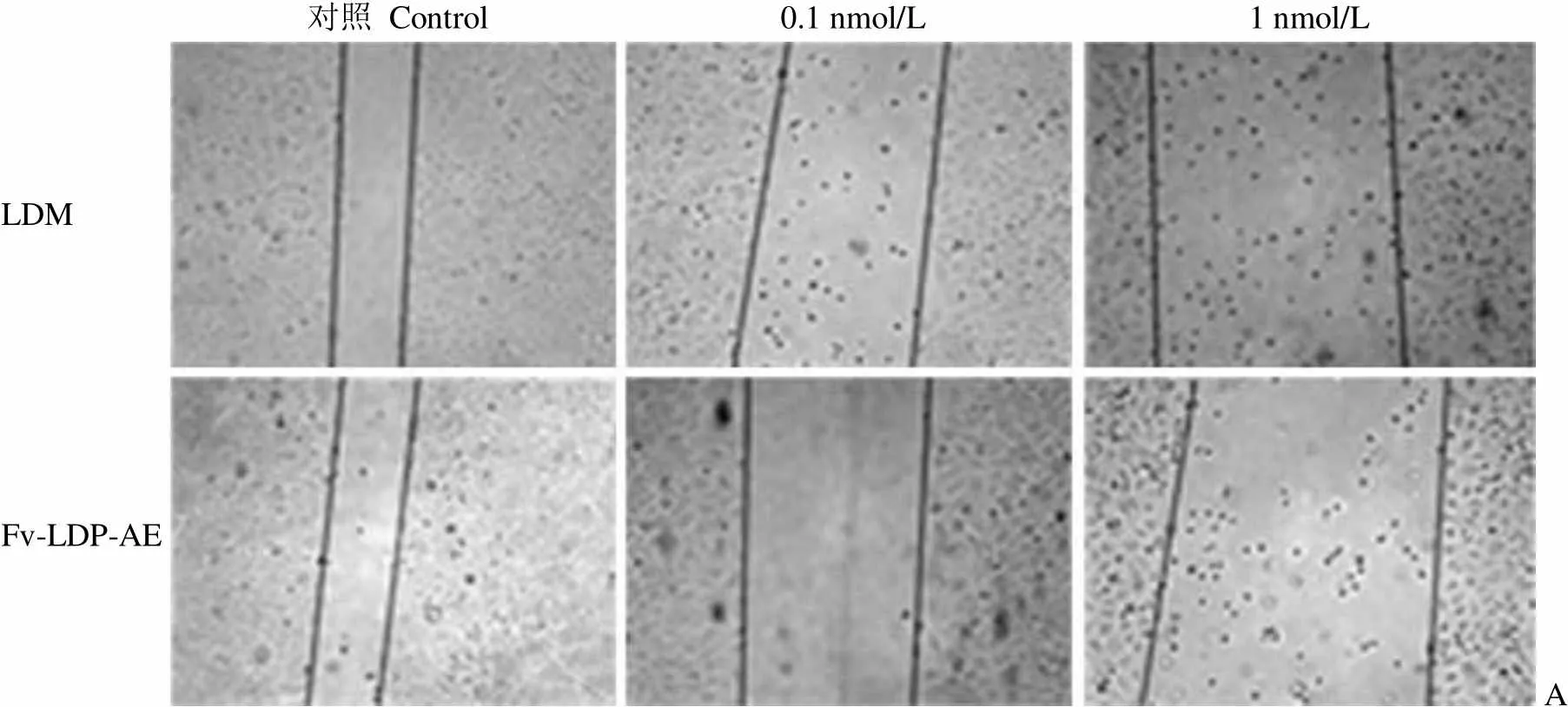
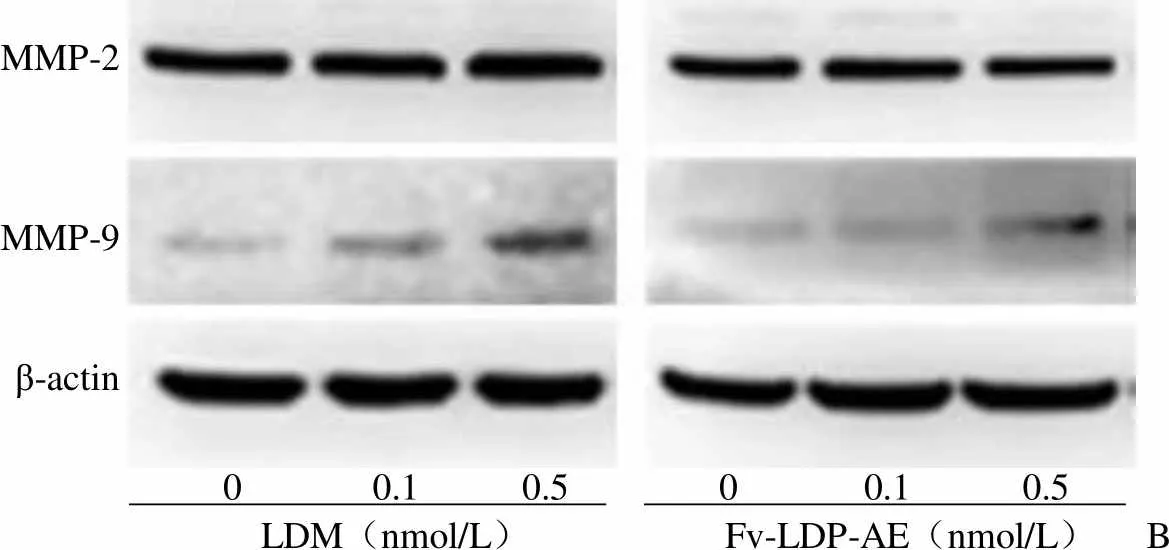
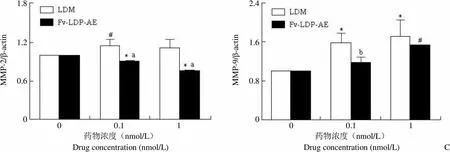
2.4 Fv-LDP-AE 较强的细胞迁移抑制作用与 MMP-2 蛋白降调节有关
如图 6A 所示,划痕产生 24 h 后,划痕边缘的 BEL-7402 细胞会很快向迁移区域移动;Fv-LDP-AE 可抑制 BEL-7402 细胞的这种快速迁移,并导致部分细胞死亡,漂浮于培养液中;LDM 对细胞迁移的抑制作用略弱于 Fv-LDP-AE。为揭示 Fv-LDP-AE 抗迁移作用强于 LDM 是否与明胶酶表达水平有关,本研究采用 Western blot 方法比较了LDM 和Fv-LDP-AE 作用 24 h 后BEL-7402 细胞内明胶酶表达情况。结果发现,Fv-LDP-AE 可呈剂量依赖性降调节 BEL-7402 细胞内 MMP-2 蛋白表达,而 LDM 不能抑制该蛋白表达;此外,Fv-LDP-AE 对 MMP-9 的升调节作用弱于等摩尔 LDM(图 6B 和图 6C)。这些结果提示,Fv-LDP-AE 细胞迁移抑制作用好于对照药 LDM 与 MMP-2蛋白降调节有关。
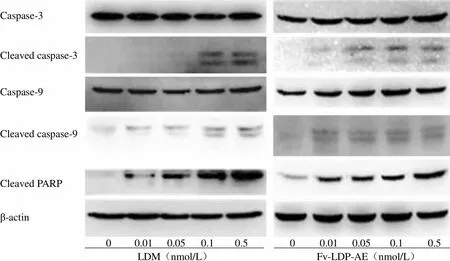
Caspase-3 Cleaved caspase-3 Caspase-9 Cleaved caspase-9 Cleaved PARP β-actin 0 0.01 0.05 0.1 0.5 0 0.01 0.05 0.1 0.5 LDM(nmol/L) Fv-LDP-AE(nmol/L)
Figure 4 Effect of LDM and Fv-LDP-AE on the expression of apoptosis-related proteins in human hepatoma BEL-7402 cells analyzed by Western blot
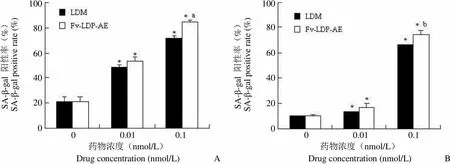
SA-β-gal 阳性率(%)SA-β-gal positive rate (%)100 80 60 40 20 0 SA-β-gal 阳性率(%)SA-β-gal positive rate (%)100 80 60 40 20 0 0 0.01 0.1 0 0.01 0.1 药物浓度(nmol/L)Drug concentration (nmol/L)A 药物浓度(nmol/L)Drug concentration (nmol/L)B
Figure 5 Cellular senescence induced by LDM and Fv-LDP-AE in human hepatoma BEL-7402 (A) and lung cancer PG-BE1 (B) cells
对照 Control0.1 nmol/L1 nmol/L LDM Fv-LDP-AEA
MMP-2 MMP-9 β-actin 0 0.1 0.5 0 0.1 0.5 LDM(nmol/L) Fv-LDP-AE(nmol/L)B
MMP-2/β-actin1.8 1.2 0.6 0 MMP-9/β-actin2.4 1.6 0.8 0 0 0.1 1 0 0.1 1 药物浓度(nmol/L)Drug concentration (nmol/L) 药物浓度(nmol/L)Drug concentration (nmol/L)C
与无药对照组比,*<0.01,#< 0.05;与等摩尔 LDM 组比,a< 0.01,b< 0.05。
*< 0.01 and#<0.05 compared with drug-free control;a<0.01 andb<0.05 compared with equimolar LDM group.
图 6 LDM 和 Fv-LDP-AE 对人肝癌 BEL-7402 细胞迁移和明胶酶表达的影响(A:细胞迁移;B:明胶酶表达;C:明胶酶表达的均一化比较)
Figure 6 Effect of LDM and Fv-LDP-AE on cell migration and gelatinases expression in human hepatoma BEL-7402 cells (A: Cell migration; B: Gelatinases expression; C: Normalized comparison of gelatinases expression)
2.5 Fv-LDP-AE 显著抑制小鼠和裸鼠移植瘤生长
本研究首先观察了 Fv-LDP-AE 对小鼠 H22 移植瘤生长的影响。如表 1 所示,Fv-LDP-AE 呈剂量依赖性抑制小鼠 H22 移植瘤生长,其中,0.8 mg/kg Fv-LDP-AE 对 H22 荷瘤小鼠的治疗效果最好,抑制率为 86.6%,显著强于耐受剂量的 LDM(69.6%)。在整个实验期间,所有受试小鼠体重均呈递增趋势,未见副作用。
为进一步评价 Fv-LDP-AE 对人移植瘤的治疗效果,本研究还建立了人肝癌 BEL-7402 裸鼠模型。图 7A 结果显示,Fv-LDP-AE 能够抑制人肝癌 BEL-7402 裸鼠移植瘤生长,并表现出比 0.05 mg/kg 耐受剂量 LDM 更强的肿瘤生长抑制作用;在实验第 27 天,Fv-LDP-AE 抑瘤率为 82.5%,而耐受剂量的 LDM 抑瘤率仅为 65.6%,两者相比差异显著(< 0.05)。在整个实验治疗期间,LDM 处理组动物平均体重下降 14.0%,而Fv-LDP-AE 处理组仅下降 9.8%,荷瘤裸鼠进食和活动均未见明显异常(图 7B)。

表 1 Fv-LDP-AE 抑制昆明小鼠 H22 移植瘤生长
注:与对照组比,*< 0.01;与 LDM 组比,a< 0.01,b< 0.05。
Notes:*< 0.01 compared with control;a< 0.01 andb< 0.05 compared with LDM group.
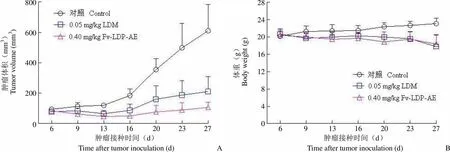
肿瘤体积(mm3)Tumor volume (mm3)800 600 400 200 0 体重(g)Body weight (g)28 24 20 16 12 8 4 0 6 9 13 16 20 23 27 6 9 13 16 20 23 27 肿瘤接种时间(d)Time after tumor inoculation (d)A 肿瘤接种时间(d)Time after tumor inoculation (d)B
Figure 7 Efficacy of Fv-LDP-AE on human hepatoma BEL-7402 xenograft in athymic mice (A: Curves of tumor growth; B: Curves of body weight change)
3 讨论
近年来,肿瘤微环境因对癌细胞生长和扩散的重要作用而成为新的癌症治疗靶点[22]。靶向癌细胞并同时靶向肿瘤微环境是现代癌症治疗新理念。明胶酶高表达于肿瘤细胞和肿瘤微环境细胞,在肿瘤侵袭和转移过程中扮演重要作用,因此,抑制明胶酶活性就可抑制肿瘤细胞及肿瘤微环境细胞侵袭和转移[1-3,7]。Fv-LDP-AE 是作者实验室以明胶酶为靶点,以烯二炔抗肿瘤抗生素 LDM 为高效弹头,通过 DNA 重组和体外分子重建特色技术构建的一种基于 scFv 的抗肿瘤侵袭转移小型化抗体融合蛋白[23]。Fv-LDP-AE 既能够靶向肿瘤细胞和肿瘤微环境细胞,又具有将弹头分子 LDM 携带至靶部位以发挥其强效抗肿瘤作用的功能,体现了现代癌症治疗新理念,发展前景光明。
烯二炔抗肿瘤抗生素 LDM 可在体外拆分为辅基蛋白 LDP 和发色团 AE[14],在监测记录纸上显示为5 个分离峰。LDP 对活性 AE 起保护作用,亦可作为支架定向构建其他新型抗肿瘤抗体药物。例如,作者实验室曾用 LDP 作支架,以 AE 为高效弹头,构建了针对 EGFR 靶点的基于scFv 的小型化抗体药物ER(Fv-LDP-AE) 和 ER(Fv)- LDP-NGR-AE,深入研究发现它们对人类癌细胞具有更强活性和选择性,提示 AE 再装配能够提高融合蛋白ER(Fv-LDP) 和ER(Fv)-LDP-NGR 的抗肿瘤作用,且优于单药 LDM[24-25]。与ER(Fv-LDP-AE) 类似,LDM 游离 AE 也可被成功装配入以 LDP 为支架的抗明胶酶单链抗体融合蛋白 Fv-LDP 中以形成新型抗体药物 Fv-LDP-AE,且已初步证明 Fv-LDP-AE 在抑制肿瘤细胞增殖和侵袭方面比 LDM 更有优势[23]。上述结果提示,以 LDP 为支架,以 AE 为高效弹头,针对肿瘤不同靶点可研发出不同的基于 scFv 的新型抗体药物,以建立基于 LDM 和 scFv 的小型化抗体药物新平台。
据报道,LDM 作用机制新颖多样,可诱导肿瘤细胞周期阻滞、裂亡、凋亡和衰老,还能抑制肿瘤细胞侵袭和迁移[26-29]。在前期研究中,作者曾通过 Hoechst33342 和 PI 染色以及 DNA ladder 方法发现了 Fv-LDP-AE 能够诱导肿瘤细胞形成多个微核,并产生凋亡 DNA 梯带[23]。本研究采用流式细胞术方法在揭示 Fv-LDP-AE 具有周期阻滞作用的同时,亦再次证明了 Fv-LDP-AE 诱导的肿瘤细胞凋亡和裂亡的发生,并用 Western blot 方法进一步揭示了 Fv-LDP-AE 诱导细胞凋亡与 caspases 通路激活有关。值得注意的是,作为 Fv- LDP-AE 弹头分子的 LDM 部分也可能通过调节其他分子如 p38MAPK、JNK 等参与细胞凋亡的发生[27]。
另外,本研究还新发现,除具有诱导肿瘤细胞衰老的作用外,Fv-LDP-AE 还具有抑制肿瘤细胞迁移的功能,且抗迁移效果好于单用 LDM,其原因可能有:①Fv-LDP-AE 的靶点是在肿瘤侵袭和转移过程中起重要作用的明胶酶,其对明胶酶高表达肿瘤细胞的特异免疫反应使得 Fv-LDP-AE 更易富集至肿瘤细胞而发挥生物学作用[23];②Fv- LDP-AE 能够抑制肿瘤细胞明胶酶分泌,且抗明胶酶分泌作用稍好于等摩尔 LDM[23];③Fv-LDP-AE 能够显著降调节 MMP-2 蛋白表达,并部分遏制 LDM 作用引发的 MMP-9 蛋白表达水平的升高。
此外,Fv-LDP-AE 良好的体外抗肿瘤作用亦在荷瘤鼠模型内得到了验证。在建立的小鼠 H22 移植瘤模型中,0.4 mg/kg Fv-LDP-AE 可使肿瘤抑制率达到 83.0%,与耐受剂量的 LDM(69.6%)相比差异显著,而等剂量 Fv-LDP-AE 对裸鼠人肝癌 BEL-7402 移植瘤的治疗亦取得了类似结果,提示通过抗明胶酶单链抗体与 LDM 偶联制备融合蛋白 Fv-LDP-AE 可进一步提高 LDM 抗肿瘤疗效。
当前,抗体药物研发已成为全球的朝阳产业,小型化和高效化是其两大发展趋势。小型化抗体不需要糖基化修饰,可在原核中表达,操作方便,生产成本低;而且,小型化抗体删除了 Fc 段,分子质量变小,免疫原性大大降低,实体瘤穿透性亦比完整抗体高。抗体药物高效化主要是将高效弹头药物与抗体偶联制成化学偶联物或通过基因工程手段制成融合蛋白,从而提高抗体药物对肿瘤细胞的作用强度,降低药物用量。因此,通过小型化和高效化手段产生的抗体药物在降低免疫原性,提高实体瘤穿透性,增强抗肿瘤活性以及降低成本等方面均具有很大优势,容易获得更好效果。本研究 Fv-LDP-AE 由抗明胶酶单链抗体 scFv(3G11) 和弹头分子 LDM 共同构成,分子量为 39.6 kD,约为完整抗体3G11(150 kD)的 1/4,因此,Fv-LDP- AE 的研制完全符合抗体药物小型化和高效化的发展趋势,研发前景光明。本研究对 Fv-LDP-AE 抗肿瘤作用机制及疗效的深入探讨,奠定了其坚实的药学基础,是对 Fv-LDP-AE 研发的一个有力推进。
[1] Benjamin MM, Khalil RA. Matrix metalloproteinase inhibitors as investigative tools in the pathogenesis and management of vascular disease. EXS, 2012, 103:209-279.
[2] Roomi MW, Monterrey JC, Kalinovsky T, et al. Patterns of MMP-2 and MMP-9 expression in human cancer cell lines. Oncol Rep, 2009, 21(5):1323-1333.
[3] Cheng XS, Yang ZB, Yin ZF. Matrix metalloproteinases and epithelial-mesenchymal transition in tumor: an advance. Chin J Cancer Biother, 2011, 18(4):437-440. (in Chinese)
程先硕, 杨之斌, 殷正丰. 基质金属蛋白酶与肿瘤上皮间质转化的研究进展. 中国肿瘤生物治疗杂志, 2011, 18(4):437-440.
[4] Pellikainen JM, Ropponen KM, Kataja VV, et al. Expression of matrix metalloproteinase (MMP)-2 and MMP-9 in breast cancer with a special reference to activator protein-2, HER2, and prognosis. Clin Cancer Res, 2004, 10(22):7621-7628.
[5] Liu Z, Li L, Yang Z, et al. Increased expression of MMP9 is correlated with poor prognosis of nasopharyngeal carcinoma. BMC Cancer, 2010, 10:270. doi: 10.1186/1471-2407-10-270.
[6] Dong W, Li H, Zhang Y, et al. Matrix metalloproteinase 2 promotes cell growth and invasion in colorectal cancer. Acta Biochim Biophys Sin (Shanghai), 2011, 43(11):840-848.
[7] Zhao F, Zhang Q, Kang C, et al. Suppression of matrix metalloproteinase-9 expression by RNA interference inhibits SGC7901 gastric adenocarcinoma cell growth and invasion in vitro and in vivo. Med Oncol, 2010, 27(3):774-784.
[8] Roy R, Yang J, Moses MA. Matrix metalloproteinases as novel biomarkers and potential therapeutic targets in human cancer. J Clin Oncol, 2009, 27(31):5287-5297.
[9] Huang YH, Shang BY, Zhen YS. Antitumor efficacy of lidamycin on hepatoma and active moiety of its molecule. World J Gastroenterol, 2005, 11(26):3980-3984.
[10] Zhen YS, Ming XY, Yu B, et al. A new macromolecular antitumor antibiotic, C-1027. III. Antitumor activity. J Antibiot (Tokyo), 1989, 42(8):1294-1298.
[11] Shao RG, Zhen YS. Enediyne anticancer antibiotic lidamycin: chemistry, biology and pharmacology. Anticancer Agents Med Chem, 2008, 8(2):121-131.
[12] Otani T, Minami Y, Marunaka T, et al. A new macromolecular antitumor antibiotic, C-1027. II. Isolation and physico-chemical properties. J Antibiot (Tokyo), 1988, 41(11):1580-1585.
[13] Gao RJ, Li DD, Zhen YS. Study on mechanisms of action of enediyne antitumor antibiotic lidamycin. Chin J New Drugs, 2006, 15(13): 1039-1043. (in Chinese)
高瑞娟, 李电东, 甄永苏. 烯二炔类抗肿瘤抗生素力达霉素的作用机制研究进展. 中国新药杂志, 2006, 15(13):1039-1043.
[14] Shao RG, Zhen YS. Relationship between the molecular composition of C1027, a new macromolecular antibiotic with enediyne chromophore, and its antitumor activity. Acta Pharm Sinica, 1995, 30(5):336-342. (in Chinese)
邵荣光, 甄永苏. 新烯二炔类大分子抗肿瘤抗生素C1027的分子构成与活性关系. 药学学报, 1995, 30(5):336-342.
[15] Gao RJ, Zhao CY, Wang YF, et al. Comparison of two kinds of protein determination methods for fusion protein Fv-LDP in the recombinant strain. Chin J New Drugs, 2010, 19(4):280-283, 331. (in Chinese)
高瑞娟, 赵春燕, 王玉凤, 等. 两种重组菌中融合蛋白Fv-LDP含量测定方法的比较研究. 中国新药杂志, 2010, 19(4):280-283, 331.
[16] Gao RJ, Zhao CY, Wang YF, et al. Fermentation process of single-chain Fv antibody and lidamycin apoprotein expressed in Escherichia coli. Chin J Antibiotics, 2009, 34(4):210-214, 237. (in Chinese)
高瑞娟, 赵春燕, 王玉凤, 等. 单链抗体与力达霉素辅基蛋白在大肠埃希菌表达的发酵工艺. 中国抗生素杂志, 2009, 34(4):210-214, 237.
[17] Gao RJ, Zhao CY, Wang YF, et al. High cell-density fermentation of the engineered strain and immunological activity of the fusion protein composed of single-chain Fv antibody and lidamycin apoprotein. Chin J Antibiotics, 2009, 34(9):536-540. (in Chinese)
高瑞娟, 赵春燕, 王玉凤, 等. 单链抗体与lidamycin辅基蛋白融合蛋白工程菌的高密度发酵及其免疫活性. 中国抗生素杂志, 2009, 34(9):536-540.
[18] Gao RJ, Zhao CY, Li DD, et al. Optimization of the preparation process for fusion protein Fv-LDP that composes lidamycin apoprotein and single-chain Fv antibody directed against type IV collagenase. Acta Pharm Sinica, 2013, 48(10):1563-1569. (in Chinese)
高瑞娟, 赵春燕, 李电东, 等. 单链抗体与力达霉素辅基蛋白融合蛋白制备过程的优化. 药学学报, 2013, 48(10):1563-1569.
[19] Zhong G, Zhang S, Li Y, et al. A tandem scFv-based fusion protein and its enediyne-energized analogue show intensified therapeutic efficacy against lung carcinoma xenograft in athymic mice. Cancer Lett, 2010, 295(1):124-133.
[20] Xu H, Wei Y, Zhang Y, et al. Oestrogen attenuates tumour progression in hepatocellular carcinoma. J Pathol, 2012, 228(2):216-229.
[21] Jiao Y, Sun KK, Zhao L, et al. Suppression of human lung cancer cell proliferation and metastasis in vitro by the transducer of ErbB-2.1 (TOB1). Acta Pharmacol Sin, 2012, 33(2):250-260.
[22] Reisfeld RA. The tumor microenvironment:a target for combination therapy of breast cancer. Crit Rev Oncog, 2013, 18(1-2):115-133.
[23] Gao RJ, Li L, Zhao CY, et al. Antitumor effect of the engineered and energized fusion protein Fv-LDP-AE composed of lidamycin and anti-type IV collagenase single-chain Fv antibody. Chin Pharm J, 2010, 45(11):808-813. (in Chinese)
高瑞娟, 李亮, 赵春燕, 等. 单链抗体与力达霉素基因工程强化融合蛋白Fv-LDP-AE的抗肿瘤作用. 中国药学杂志, 2010, 45(11): 808-813.
[24] Sheng W, Shang Y, Miao Q, et al. Antitumor efficacy of the scFv-based fusion protein and its enediyne-energized analogue directed against epidermal growth factor receptor. Anticancer Drugs, 2012, 23(4):406-416.
[25] Sheng WJ, Shang Y, Li L, et al. An EGFR/CD13 bispecific fusion protein and its enediyne-energized analog show potent antitumor activity. Anticancer Drugs, 2014, 25(1):82-91.
[26] Liu X, He H, Feng Y, et al. Difference of cell cycle arrests induced by lidamycin in human breast cancer cells. Anticancer Drugs, 2006, 17(2):173-179.
[27] Zhen YZ, Lin YJ, Shang BY, et al. Enediyne lidamycin induces apoptosis in human multiple myeloma cells through activation of p38 mitogen-activated protein kinase and c-Jun NH2-terminal kinase. Int J Hematol, 2009, 90(1):44-51.
[28] Gao RJ, Liang YX, Li DD, et al. Effect of lidamycin on telomerase activity in human hepatoma BEL-7402 cells. Biomed Environ Sci, 2007, 20(3):189-197.
[29] Zhang SH, Zhang H, He HW, et al. Lidamycin up-regulates the expression of thymidine phosphorylase and enhances the effects of capecitabine on the growth and pulmonary metastases of murine breast carcinoma. Cancer Chemother Pharmacol, 2013, 72(4):777- 788.
Antitumor mechanismand efficacy of the fusion protein consisting of lidamycin and anti-gelatinases single-chain Fv antibody
GAO Rui-juan, SHANG Bo-yang, SHENG Wei-jin, ZHAO Chun-yan, LI Dian-dong, ZHEN Yong-su
To investigatethe antitumor mechanism and efficacy of the fusion protein Fv-LDP-AE composed of lidamycin (LDM) and anti-gelatinases single-chain Fv antibody.
Free AE (the active enediyne chromophore of LDM) prepared using the triple radial pressure C4column was reassembled into fusion protein Fv-LDP bymolecular reconstitution. The rebuilt fusion protein Fv-LDP-AE was obtained by Superdex 75 chromatography to remove the free AE. Reverse phase HPLC was used to determine the purity or the relative content of the drug components. DNA content was measured by flow cytometry. SA-β-gal staining, Western blot and cell wound healing assay were exploited to detect the effect of tested drugs on cell senescence, protein expression and cell migration, respectively. Antitumor efficacies of tested drugs were evaluated by different animal models.
Fv-LDP-AE inherited the action characteristics derived from LDM including the induction of cell cycle arrest, apoptosis and mitotic cell death in human hepatoma BEL-7402 and lung cancer PG-BE1 cells. Furthermore, Fv-LDP-AE also showed more potent activity than LDM in triggering cellular senescence and inhibiting cell migration in human cancer cells. The induction of cell apoptosis was related to the activation of caspases signaling pathway and the inhibition of migration was associated with the down-regulation of MMP-2 in Fv-LDP-AE-treated BEL-7402 cells., Fv-LDP-AE also suppressed the growth of murine tansplantable hepatoma 22 (H22) and human hepatoma BEL-7402 xenograft in athymic mice with the inhibition rate of 86.6% and 82.5%, respectively.
Fv-LDP-AE showes antitumor effects against murine transplantable tumor and cancer xenograft in athymic mice, which may be related to the induction of cell cycle arrest, death and senescence as well as the inhibition of cell migration by Fv-LDP-AE in tumor cells.
Gelatinases; Single-chain antibodies; Tumor microenvironment; Lidamycin
ZHEN Yong-su, Email: zhenys@public.bta.net.cn
10.3969/cmba.j.issn.1673-713X.2014.04.002
“重大新药创制”国家科技重大专项(2009ZX09103-136、2013ZX09102064);国家自然科学基金(81001021)
甄永苏,Email:zhenys@public.bta.net.cn
2014-02-12
Author Affiliation: Department of Oncology, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
