新型双酚类抗氧剂2,2′-亚甲基双(6-壬基对甲酚)的合成
2014-11-28李世昌敖晓娟苑丽红谭卓华
李世昌,敖晓娟,王 庆,苑丽红,谭卓华
(广州合成材料研究院有限公司,广东广州510665)
受阻酚类抗氧剂的发展伴随着高分子材料对性能的需求不断发展,大分子量是抗氧剂发展的一个方向,长链烷基双酚类抗氧剂代表了未来抗氧剂发展的一个趋势[1-3]。抗氧剂2,2′ - 亚甲基双(6 -壬基对甲酚)是类似产品2246 的双酚类抗氧剂,国外市场已经有类似的。与2246 是熔点高的固体抗氧剂不同的是[4],该抗氧剂属于大分子量液体双酚类抗氧剂,在易于乳化的应用如乳液聚合中液体抗氧剂有着独特的优势。目前在壬基酚以及下游产品TNP,即三(壬基酚)亚磷酸酯面临被禁用的情况下,该抗氧剂能在一定程度上填补其空白。
对于长链烷基酚已经有些研究报道,但是主要限于无取代基苯酚的长链烷基,如壬醇等长链醇与苯酚在路易斯酸或者固体超强酸的作用下制备长链烷基酚[5-6]。对于2,2′ -亚甲基双(6 -壬基对甲酚)现在没有相关研究文献的报道,该抗氧剂的研发有着重要的意义,经过探索我们完成了该产品的研发。目标产物的制备路线如图1 所示,以对甲酚为原料经过酰化反应、还原反应和亚甲基化反应制备目标产品。对甲酚与壬酰氯通过一步酰化反应或者通过先酯化再Fries 重排反应两步法制备得到2 -壬酰基对甲酚,然后经过羰基还原反应得到2 -壬基对甲酚,最后2 -壬基对甲酚通过多聚甲醛或者甲缩醛亚甲基化制备得到目标产品2,2′ -亚甲基双(6 -壬基对甲酚)。

图1 2,2′-亚甲基双(6 -壬基对甲酚)的合成路线Fig.1 Synthetic route of target compound
1 实验部分
1.1 主要仪器和试剂
Bruker AVANCE AV 400 超导脉冲傅里叶变换核磁共振仪(TMS 作内标);Thermo DSQ EI 低分辨率质谱仪;LCQ Deca XP 液质联用仪;溶剂和试剂均为市售分析纯,购买得到的试剂未经纯化直接使用。
1.2 合成步骤
1.2.1 化合物正壬酸对甲酚酯(1)的合成
称取64.8g(0.6mol)对甲酚和碳酸钾138g(1mol)于圆底烧瓶中,加入100mL 丙酮,装好回流装置,用恒压滴液漏斗分别慢慢滴加48.2g(0.61mol)壬酰氯,滴加完毕后在搅拌下缓慢升温到丙酮回流,TLC 跟踪对甲酚的消失,约2h 后反应完毕,降温后用旋转蒸发仪减压蒸除丙酮后加入200mL 水溶解固体,每次用100mL 氯仿萃取3 次,合并有机层后分别用200mL 碳酸氢钠水溶液和饱和食盐水各洗涤一次,无水硫酸镁干燥,抽滤后用旋转蒸发仪蒸除溶剂得到目标产物,乙酸乙酯-石油醚硅胶柱层析得到淡黄色液体148g(0.6mol,99%)。其表征数据为:1H NMR(400MHz,CDCl3)δ 7.18(d,J =8.2Hz,2H),6.98(d,J =8.4Hz,2H),2.56(t,J =7.5Hz,2H),2.36(s,3H),1.85 ~1.71(m,2H),1.41 ~1.23(m,10H),0.93(t,J =6.9Hz,3H)。13C NMR(101MHz,CDCl3)δ 172.47,148.52,135.18,129.79,121.16,34.34,31.74,29.15,29.05,24.91,22.57,20.72,13.98。EI-MS m/z(%):248(M+,100),108(M+-140,4)。
1.2.2 化合物2 -壬酰基对甲酚(2)的合成
快速称取80g(0.3mol)无水AlCl3于圆底烧瓶中,慢慢加入300mL 二氯甲烷,装好氯化钙干燥管保持反应体系隔绝水汽,装好尾气吸收装置,用恒压滴液漏斗慢慢滴加148g(0.6mol)正壬酸对甲酚酯(1),滴加完毕后在搅拌下缓慢升温到回流状态,用TLC 跟踪化合物正壬酸对甲酚酯的消失,约3h后降温,降到室温后把反应物转移到分液漏斗中,分别用200mL 稀盐酸、300mL 水和300mL 饱和食盐水各洗涤一次,无水硫酸镁干燥,抽滤并用旋转蒸发仪减压蒸除溶剂得到目标产物,乙酸乙酯-石油醚硅胶柱层析得到淡黄色液体72g(0.29mol,97%)。其表征数据为:1H NMR(400MHz,CDCl3)δ 11.95(s,1H),7.26(s,1H),7.00(dd,J = 8.8,2.3Hz,1H),6.61(d,J =8.5Hz,1H),2.70(t,J =7.5Hz,2H),2.04(s,3H),1.53 ~1.41(m,2H),1.14 ~0.97 (m,12H),0.62 (s,3H)。13C NMR(101MHz,CDCl3)δ 206.84,160.44,137.17,129.68,127.84,118.27,38.26,31.81,29.37,29.30,24.50,22.62,20.52,14.04。EI-MS(70eV)m/z (%):248(M+,16),135(M+-113,100)。
1.2.3 化合物2 -壬酰基对甲酚(2)的一步合成
快速称取40g(0.3mol)无水AlCl3于圆底烧瓶中,装好尾气吸收装置,用恒压滴液漏斗分别慢慢滴加32.4g(0.3mol)对甲酚和54g(0.3mol)壬酰氯,滴加完毕后在搅拌下缓慢升温到120℃反6h,此时反应物固化不易搅拌,降到室温后用500mL 浓度为6mol/L 的盐酸溶解反应物,每次用200mL 氯仿萃取,萃取3 次,合并有机层后分别用300mL 水和饱和食盐水各洗涤一次,无水硫酸镁干燥,抽滤并用旋转蒸发仪蒸除溶剂得到目标产物,乙酸乙酯-石油醚硅胶柱层析得到淡黄色液体72g(0.29mol,97%)。NMR 和EI-MS 数据同1.2.2 产物相同。
1.2.4 锌汞齐制备
量取100mL 水和30mL 浓盐酸放入圆底烧瓶中,称取18g 氯化汞加入并搅拌溶解,在水浴下分批加入73g 锌粉,加完搅拌反应20 分钟后倾出上层水溶液,每次用200mL 蒸馏水洗涤沉淀物,洗涤4 次,加少量蒸馏水覆盖得到的锌汞齐备用。
1.2.5 化合物2 -壬基对甲酚(3)的合成
新制备的锌汞齐催化剂(73g 锌,18g 氯化汞)加入圆底烧瓶中,加入300mL 浓度为6mol/L 的稀盐酸和200mL 无水乙醇,称取70g(0.28mol)化合物2 -壬酰基对甲酚(2)溶解在100mL 乙醇中在搅拌下加入上述溶液中,然后缓慢升温到85℃,反应6h,后降温到室温,过滤除去催化剂,反应液经旋转蒸发仪蒸除乙醇后加300mL 水,每次用200mL 乙酸乙酯萃取3 次,合并有机层后分别用300mL 水和饱和食盐水各洗涤一次,无水硫酸镁干燥,抽滤并用旋转蒸发仪减压蒸除溶剂得到粗品,快速柱层析得到琥珀色液体62g(0.27mol,95%)。其表征数据为:
1H NMR(400MHz,CDCl3)δ 6.92(d,J = 1.9Hz,1H),6.87(dd,J = 8.0,1.9Hz,1H),6.66(d,J =8.0Hz,1H),4.48(s,1H),2.56(t,J =8.0Hz,2H),2.26(s,3H),1.66 ~1.53(m,2H),1.41 ~1.24(m,12H),0.89(t,J =6.9Hz,3H)。13C NMR(101MHz,CDCl3)δ 151.14,130.73,129.87,128.34,127.32,115.03,31.89,29.97,29.93,29.59,29.55,29.32,22.66,20.50,14.08。EIMS(70eV)m/z(%):234(M+,25),121(M+-113,100)。
1.2.6 化合物2,2′ -亚甲基双(6 -壬基对甲酚)(4)的合成
称取60g(0.26mol)2 - 壬基对甲酚(3)和11.5g 多聚甲醛加入圆底烧瓶中,加入200mL 苯搅拌均匀,然后加入20mL 浓盐酸,缓慢加热到85℃反应,7h 后降温到室温,将反应液转移到分液漏斗中,分别用200mL 水和200mL 饱和食盐水洗涤,无水硫酸镁干燥,抽滤并用旋转蒸发仪减压蒸除溶剂得到产物粗品,快速柱层析得到琥珀色液体63g(0.13mol,100%)。其 表 征 数 据 为:1H NMR(400MHz,CDCl3)δ 6.81(s,1H),6.72(s,1H),6.65(s,1H),6.36(s,1H),2.77 ~2.44(m,4H),2.41 ~1.96(m,6H),1.84 ~1.51(m,4H),1.51 ~1.04(m,24H),0.97 ~0.75(m,6H)。13C NMR(101MHz,CDCl3)δ 197.22,149.18,148.80,143.56,137.35,130.84,130.15,130.04,128.85,128.72,128.51,126.75,125.79,119.38,80.91,51.46,31.95,31.87,30.58,30.53,30.25,30.12,30.06,29.99,29.79,29.67,29.57,29.50,29.44,29.35,29.27,29.25,29.14,28.33,25.72,22.67,21.98,20.66,20.51,14.08。EI-MS(70eV)m/z(%):480(M+,19),365(M+-115,12),247(M+-233,23),135(M+-345,100),121(M+-359,50)。
2 结果与讨论
2.1 酰化产物2 -壬酰基对甲酚制备
本研究中涉及一步法和两步法来制备酰化产物。一步法是直接利用AlCl3介导的傅克酰基化来完成。两步法是先利用碱催化得到酯,然后利用AlCl3介导的Fries 重排来完成[7-8]。在利用三氟甲磺酸介导Fries 重排时产物复杂,没有得到优势主产物[9]。
一步法可以认为是先经过了酯中间体,再通过重排得到的酰化产物。但是两种途径各有利弊,表1 是对两种途径的比较。
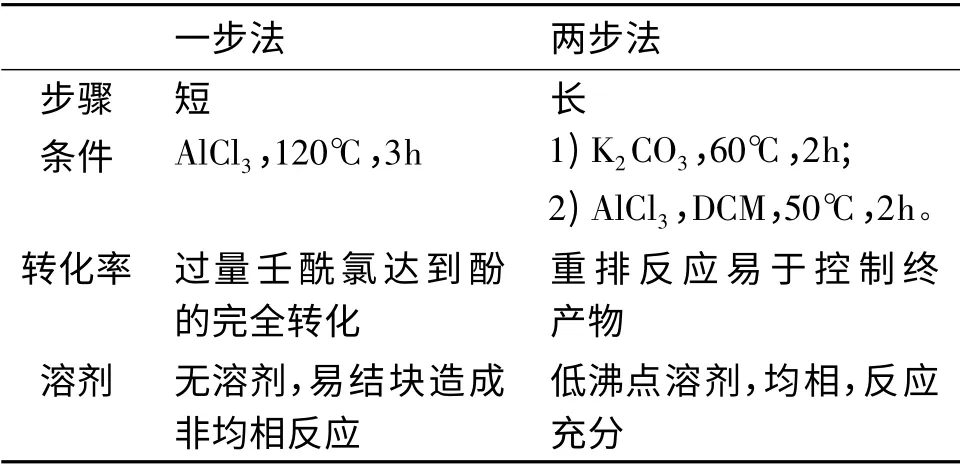
表1 两种途径的比较Table 1 Comparisons of two procedures
由表1 可知:一步法虽然有步骤短的优点,但是两步法条件温和,在低沸点溶剂中均相反应,反应时间短,可重复性好,是利于工业化生产的路线,所以两步法是更优异的途径。
2.2 制备2 -壬基对甲酚
利用1 -壬烯与对甲酚烷基化也可以制备烷基酚中间体,得到其同分异构体2 -异壬基对甲酚,其研究工作已经有文献报道,其采用的是铝做催化剂[10]。烯烃催化烷基化在以丁烯和酚为原料制备异丁基酚已经有大量的研究[11]。
本研究选择了锌汞齐还原法[12]制备目标中间体,在选择黄鸣龙反应制备还原产物时没有得到目标产物[13-14]。
2.3 目标产物的制备
目标化合物的合成关键在于制备重要中间体2 -壬基对甲酚,与甲醛的反应本研究参照双酚抗氧剂2246 的合成[4,15]。目标产物抗氧剂2,2′ -亚甲基双(6 -壬基对甲酚)的结构式如下,经过表征确定得到了产品,产品为琥珀色粘稠液体,分子量为480。其核磁和质谱特征经过解析符合其分子结构。

最终产品的合成可以用甲醛水溶液、多聚甲醛或者甲缩醛做溶剂,在抗氧剂2246 合成中应用较多的是甲醛水溶液。但是利用甲醛水溶液做试剂时需要表面活性剂增加原料的相容性形成均相反应,造成反应体系复杂。而且甲醛水溶液存在储存时间短、单位质量甲醛释放量小等缺点。研究中选择了多聚甲醛和甲缩醛两种试剂,考察了对产物的影响。表2 是以多聚甲醛和甲缩醛作为反应试剂时的比较。

表2 两种试剂对亲核取化反应的影响Table 2 Effect of the two agents on the nucleophilic substitution reactions
从表2 可知,多聚甲醛最大的缺点是需要借助甲苯等溶剂溶解实现均相反应,优点是原料容易运输使用。而甲缩醛的优点和缺点正好分别是多聚甲醛的缺点和优点,其最大优点是它既是反应试剂又是溶剂,减少了额外溶剂的使用,另一个优点是它的沸点不是很高,容易除去溶剂残留,总之它们都是比较好的甲醛源。
3 结论
本研究以对甲酚为原料,经过酰化、还原和亲核取代反应制备得到了新型大分子量液体双酚类抗氧剂2,2′ -亚甲基双(6 -壬基对甲酚)。对酰化的工艺进行了一步法和两步法制备2 -壬酰基对甲酚的研究。还原反应发现锌汞齐还原能够制备得到产物,而黄明龙反应不能实现合成目标。最后步骤参照比较成熟的抗氧剂2246 合成工艺,发现多聚甲醛和甲缩醛都是比较好的反应试剂。经过4 步反应制备得到各中间体和最终目标产物。
[1]张永鹏,陈俊,郭绍辉,等. 受阻酚类抗氧剂的研究进展及发展趋势[J]. 塑料助剂,2011(03):1 -7.
[2]高欣宇,王硕. 塑料抗氧剂的种类、现状及发展趋势[J]. 天津科技,2010(02):80 -82.
[3]陈威,邬茂,金炼铁. 抗氧剂及其发展趋势[J].化工技术与开发,2008(12):22 -25.
[4]张天永,池立峰,夏文娟,等. 抗氧剂2246 的合成研究[J]. 化学工业与工程,2009(01):19-22.
[5]苏毅,朱书全,王建利. Al2O3-AlCl3催化合成长链烷基酚的研究[J]. 化学试剂,2006(05):261 -263 +266.
[6]苏毅,朱书全,王建利. Fe2O3·SO2-4 催化合成长链烷基酚[J]. 石油学报(石油加工),2006(05):92 -95.
[7]China Raju,B. ,R. Nageswara Rao,P. Suman,P.Yogeeswari,D. Sriram,T. B. Shaik,and S. V.Kalivendi. Synthesis,structure-activity relationship of novel substituted 4H-chromen-1,2,3,4-tetrahydropyrimidine-5-carboxylates as potential antimycobacterial and anticancer agents[J]. Bioorganic & Medicinal Chemistry Letters,2011,21(10):2855 -2859.
[8]GIESBRECHT,G.,T. BOLLER,A. VOSKOBOYNIKOV,A. ASACHENKO,M. NIKULIN,and A.TSAREV,CATALYST COMPOUNDS AND USE THEREOF. 2011,WO Patent 2,011,056,423.
[9]Murashige,R. ,Y. Hayashi,S. Ohmori,A. Torii,Y. Aizu,Y. Muto,Y. Murai,Y. Oda,and M.Hashimoto. Comparisons of O-acylation and Friedel-Crafts acylation of phenols and acyl chlorides and Fries rearrangement of phenyl esters in trifluoromethanesulfonic acid:effective synthesis of optically active homotyrosines[J]. Tetrahedron,2011,67(3):641 -649.
[10]JR,H. W. E. and F. LESTER. PHOSPHITE HEAT STABILIZED GRAFT DIENE COPOLYMERS 1983.
[11]杜非.2,4 - 二叔丁基苯酚的合成工艺研究[J]. 辽宁化工,1996(05):1 -4.
[12]Oslund,R. C. ,N. Cermak,C. L. M. J. Verlinde,and M. H. Gelb. Simplified YM-26734 inhibitors of secreted phospholipase A2 group IIA[J]. Bioorganic & Medicinal Chemistry Letters,2008,18(20):5415 -5419.
[13]郭志雄,王荷芳,辛春伟,等. 叶酸拮抗剂Alimta 的合成[J]. 有机化学,2006(04):546-550.
[14]韩广甸,马兆扬. 黄鸣龙还原法[J]. 有机化学,2009(07):1001 -1017.
[15]柴义. 抗氧剂2246 的合成研究[D]. 天津:天津大学,2007.
