冬凌草甲素和冬凌草乙素与谷胱苷肽的迈克尔加成反应
2014-11-27刘建群高俊博舒积成
刘建群,高俊博,舒积成,张 锐
(江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004)
迈克尔加成反应[1]是亲电的共轭体系与亲核的负电体系进行的共轭亲核加成反应.一般来说,烯键或炔键与吸电子基团共轭相连形成的官能团可构成亲电共轭体系,含有该共轭体系的化合物称为迈克尔反应受体分子.迈克尔反应受体分子具有许多重要的药理活性,如酶抑制活性[2],抗病毒活性[3],抗炎活性[4],醌还原酶诱导活性[5],抗肿瘤活性[6-7]等.迈克尔反应受体分子是一类重要的烷化剂,它能与细胞酶中半胱氨酸残基的巯基或细胞上其他亲核基团发生迈克尔加成反应形成共价键结合,从而产生重要的生物效应[2,7-8].冬凌草甲素和冬凌草乙素是从中药冬凌草(Rabdosia rubescens)中分离出来的具有抗肿瘤等活性的对映贝壳杉烯二萜类成分[9],也是一类重要的天然迈克尔反应受体分子.对映贝壳杉烯二萜具有较广谱的抗肿瘤活性,对人早幼粒白血病细胞、人宫颈癌细胞、人食管癌细胞、人肝癌细胞[7,10-11]等许多肿瘤细胞有较强的抑制作用.研究表明,绝大多数对映贝壳杉烯类化合物的抗肿瘤活性与其D环中具有exo-亚甲基环戊酮结构有关.该结构可以与受体氨基酸的亲核基团,如氨基、羟基及巯基等发生不可逆迈克尔加成反应,从而显示出较好的抗肿瘤活性,此机制已得到大多数研究者的认可[12].还原型谷胱苷肽(GSH)是一种含有游离巯基的生物活性分子,在机体细胞中含量丰富.GSH具有很好的清除氧自由基活性,从而保护细胞免受氧化伤害的能力[13-14].GSH的缺乏可引起机体细胞受损凋亡,GSH水平是反映机体细胞是否健康的标志[15-16].迈克尔反应受体分子能与细胞酶中半胱氨酸残基的巯基等亲核基团发生迈克尔加成反应形成共价键结合,从而产生抗肿瘤等重要的生物效应.为阐明冬凌草甲素和冬凌草乙素等対映贝壳杉烯二萜抗肿瘤作用机制,本文作者首次采用紫外光谱动力学方法测定了冬凌草甲素和冬凌草乙素与谷胱苷肽的迈克尔加成反应级数、速率常数和平衡常数.
1 实验部分
1.1 试剂及仪器
SHIMADZU UV 2550型紫外可见分光光度计(日本岛津公司).冬凌草甲素(≥98%,南京泽朗医药科技有限公司),冬凌草乙素(≥98%,河南济源济世药业有限公司),还原型谷胱甘肽(GSH,≥98%,阿拉丁试剂(上海)有限公司).
1.2 冬凌草甲素和冬凌草乙素与GSH迈克尔加成反应贮备溶液的配制
称取KH2PO41.36g溶于30.4mL 0.1mol/L NaOH溶液中,加蒸馏水至200mL得pH=6.5的磷酸盐缓冲液.取pH=6.5的磷酸盐缓冲液和甲醇等体积混匀得pH=6.5的磷酸盐缓冲液-甲醇(1∶1,V∶V)溶液.精确称取冬凌草甲素13.10mg、冬凌草乙素13.03mg和谷胱甘肽11.06mg,分别置于25mL容量瓶内,用pH=6.5的磷酸盐缓冲液-甲醇(1∶1)溶液溶解并稀释至刻度,摇匀,得1.44×10-3mol/L冬凌草甲素、冬凌草乙素和谷胱甘肽反应贮备溶液.
1.3 冬凌草甲素(或冬凌草乙素)吸光度-浓度标准曲线的绘制
精确量取1mL 1.44×10-3mol/L冬凌草甲素(或冬凌草乙素)反应贮备溶液六份分别置于50mL刻度试管中,分别加入50、75、100、125、200和375μL冰醋酸,摇匀,再分别加入1mL 1.44×10-3mol/L谷胱甘肽反应贮备溶液,用pH=6.5的磷酸盐缓冲液-甲醇溶液分别稀释至4、6、8、10、16和30mL,摇匀,得3.60×10-4、2.40×10-4、1.80×10-4、1.44×10-4、9.00×10-5、4.80×10-5mol/L系列标准溶液.以等体积pH=6.5的磷酸盐缓冲液-甲醇溶液代替冬凌草甲素(或冬凌草乙素)反应贮备溶液,同标准溶液制备方法制备系列空白溶液.以空白溶液为参比,立即在240nm波长处测定吸光度,绘制冬凌草甲素(或冬凌草乙素)的吸光度-浓度标准曲线(A-c).前期实验结果表明,在待测反应体系中加入冰醋酸作为反应终止剂后,冬凌草甲素和冬凌草乙素与GSH迈克尔加成反应非常缓慢,可以忽略不计.
1.4 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应紫外光谱动力学研究
控制反应温度为25℃,于10mL试管中加入冬凌草甲素(或冬凌草乙素)和GSH反应贮备溶液各2 mL,混匀,得初始浓度为0.72μmol/L冬凌草甲素(或冬凌草乙素)反应液.以240nm为检测波长,立即进行紫外动力学测定,记录吸光度随反应时间变化的曲线(A-t),至吸光度不再变化.冬凌草甲素和冬凌草乙素与GSH迈克尔加成反应方程式见图1.
2 结果与讨论
2.1 冬凌草甲素(或冬凌草乙素)吸光度-浓度标准曲线的绘制
采用紫外分光光度法分别建立了冬凌草甲素和冬凌草乙素的吸光度-浓度(A-c)标准曲线,得线性回归方程为:冬凌草甲素A=8.010 1c-0.006 6(c:μmol/L),相关系数R=0.999 6,线性范围为0.048~0.360 μmol/L;冬凌草乙素A=5.280 4c+0.030 9,相关系数R=0.999 5,线性范围为0.048~0.360μmol/L.
2.2 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应紫外光谱动力学研究
采用紫外光谱动力学法测定了冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应动力学性质.加成反应吸光度随反应时间变化如图2所示.从图2可以看出,随着反应时间的增加,反应体系的吸光度均逐渐下降,吸光度下降快慢速度顺序为:冬凌草甲素>冬凌草乙素,说明冬凌草甲素反应速度比冬凌草乙素快.根据冬凌草甲素(或冬凌草乙素)吸光度-浓度标准曲线计算吸光度对应浓度值,并以浓度倒数对反应时间作图(图3).从图3可以看出,在反应时间0~600s内,反应物浓度倒数与反应时间基本呈线性关系,线性回归方程为:冬凌草甲素1/c=16.196 0t+3 917.8(c:mol/L,t:s),相关系数R=0.997 7;冬凌草乙素1/c=7.480 5t+3 148.7,相关系数R=0.995 2.说明在反应初始阶段,冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应符合二级动力学方程,速率常数分别为16.196 0L·(mol·s)-1(冬凌草甲素)和7.480 5L·(mol·s)-1(冬凌草乙素).冬凌草甲素与GSH的迈克尔加成反应速率比冬凌草乙素快一倍以上.这可能是因为冬凌草乙素的14位羟基在变成缩醛后,破坏了原羟基与15位羰基形成的分子内氢键,降低了双键的亲电性导致迈克尔加成反应活性下降所致.
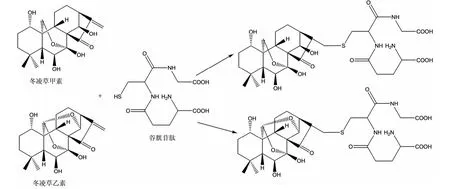
图1 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应方程式Fig.1 The reaction scheme of oridonin and ponicidin with glutathione
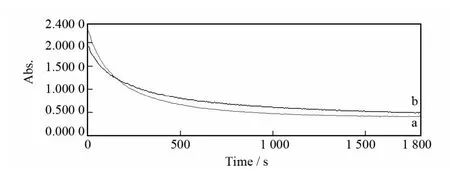
图2 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应吸光度随反应时间变化曲线Fig.2 Plots of the absorbance of oridonin and ponicidin versus reaction time
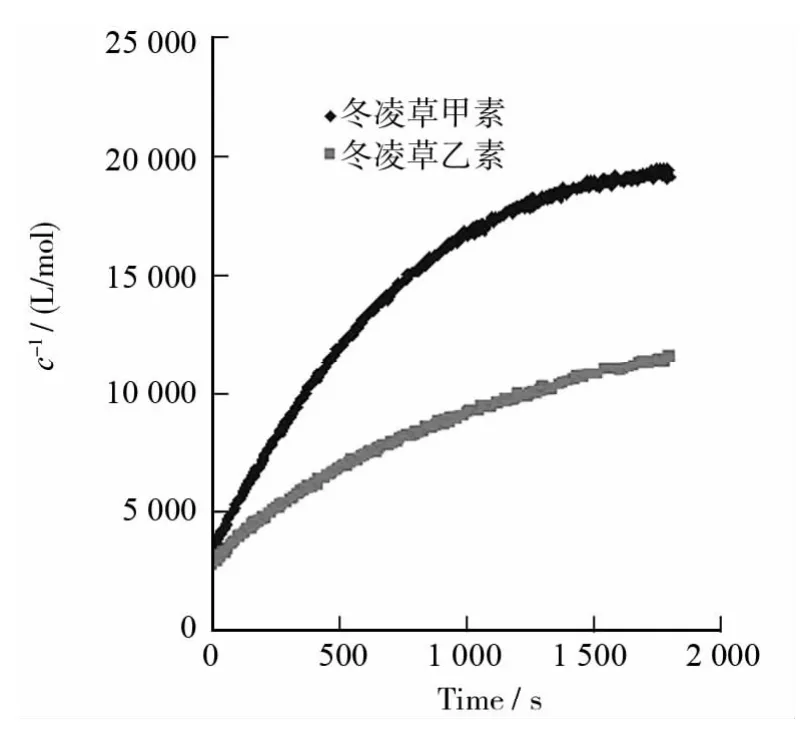
图3 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应浓度倒数随反应时间变化曲线Fig.3 Plots of the reciprocal of concentration of oridonin and ponicidin versus reaction time
2.3 冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应平衡常数测定
冬凌草甲素与GSH的迈克尔加成反应接近30min后反应体系吸光度基本不变(约为0.41),说明反应已趋于平衡.而冬凌草乙素与GSH的迈克尔加成反应接近55min后反应体系吸光度才基本不变(约为0.42),说明这时反应已趋于平衡.根据反应物初始浓度、反应体系平衡时吸光度值以及吸光度-浓度标准曲线求得平衡转化率α为92.78%(冬凌草甲素)和89.76%(冬凌草乙素),并由平衡常数计算公式K=α/(1-α)2求得25℃条件下,冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应的平衡常数分别为177.98L/mol和85.60L/mol.说明冬凌草甲素加成反应的转化率比冬凌草乙素高,反应更彻底.
3 结论
冬凌草甲素和冬凌草乙素与GSH的迈克尔加成反应符合二级动力学方程,综合迈克尔加成反应速率、平衡转化率和平衡常数测定结果,冬凌草甲素与GSH的迈克尔加成反应活性比冬凌草乙素高得多.根据反应活性,本文作者推测冬凌草甲素的抗肿瘤活性可能比冬凌草乙素更好,这与文献[6]报道的冬凌草甲素比冬凌草乙素具有更好抗肿瘤活性相一致.
[1]MICHAEL A.Ueber die addition von natriumacetessigund natriummalonsäureäthern zu den aethern ungesättigter säuren[J].J Prakt Chem,1887,35:349-356.
[2]STEERT K,EL-SAYED I,VAN DER VEKEN P,et al.Dipeptidylα-fluorovinyl Michael acceptors:Synthesis and activity against cysteine proteases[J].Bioorg Med Chem Lett,2007,17:6563-6566.
[3]EKICI O D,LI Z Z,POWERS J C,et al.Design,synthesis,and evaluation of aza-peptide Michael acceptors as selective and potent inhibitors of caspases-2,-3,-6,-7,-8,-9,and-10[J].J Med Chem,2006,49:5728-5748.
[4]ANAND P,SUNG B,KUNNUMAKKARA A B,et al.Suppression of pro-inflammatory and proliferative pathways by diferuloylmethane(curcumin)and its analogues dibenzoylmethane,dibenzoylpropane,and dibenzyl ideneacetone:Role of Michael acceptors and Michael donors[J].Biochem Pharmacol,2011,82:1901-1909.
[5]张潇雨.天然迈克尔反应受体分子的快速发现及活性研究[D].杭州:浙江大学,2011.
[6]左海军,李 丹,吴 斌,等.冬凌草的化学成分及其抗肿瘤活性[J].沈阳药科大学学报,2005,22(4):258-262.
[7]李金华,梁念慈,莫丽儿,等.半边旗5种成分体外细胞毒活性比较及构效关系分析[J].药学学报,1998,33(9)641-644.
[8]KUNAKBAEVA Z,CARRASCO R,ROZAS I,et al.An approximation to the mechanism of inhibition of cystein proteases:nucleophilic sulphur addition to Michael acceptors type compounds[J].J Mol Struct(Theochem),2003,626:209-216.
[9]余祖胤.对映贝壳杉烷类二萜化合物抗肿瘤作用及其分子机制研究[D].北京:军事医学科学院,2007.
[10]王 筠,刘清芸,华海婴,等.冬凌草甲素诱导HL-60细胞凋亡[J].中国药理学通报,2001,17(4):402-404.
[11]王 瀚,丁 兰,刘国安,等.拟缺香茶菜二萜成分及细胞毒活性研究[J].西北师范大学学报:自然科学版,2005,41(6):54-57.
[12]FUJITA E,NAGAO Y,KOHNO T,et al.Antitum or activity of acylated oridonin[J].Chem Pharm Bull,1981,29(11):3208-3213.
[13]胡俊斌,刘新月,陈燕,等.谷胱苷肽对化疗药物性肝损害的防治作用[J].中国新药与临床杂志,1998,17(4):231-232.
[14]宋秀丽,杨道峰,田德英.谷胱苷肽对病毒性肝炎病人超氧化物的歧化酶过氧化脂质水平的影响及疗效[J].中国新药与临床杂志,1998,17(4):234-235.
[15]MEISTER A.Glutathione-ascorbic acid antioxidant system in animals[J].J Biol Chem,1994,269:9397-9400.
[16]ARMSTRONG J S,JONES D P.Glutathione depletion enforces the mitochondrial permeability transition and causes cell death in Bcl-2overexpressing HL60cells[J].FASEB J,2002,16(10):1263-1265.
