过敏性哮喘模型脱敏治疗前后小鼠肥大细胞的变化与其细胞因子的检测①
2014-11-27姚添淇吴莹莹杨小猛匡渤海刘志刚深圳大学过敏反应与免疫学研究所深圳518060
姚添淇 吴莹莹 杨小猛 匡渤海 刘志刚(深圳大学过敏反应与免疫学研究所,深圳518060)
过敏性哮喘(Bronchial asthma)是以肺部多种细胞特别是肥大细胞、嗜酸性粒细胞和T淋巴细胞等浸润和对各种激发因子产生气道高反应为特征的慢性气道炎症疾病,在易感者中此种炎症可引起反复发作的气促、喘息、咳嗽和胸闷等症状,气道对多种刺激因子反应性增高,其发病率有逐年上升的趋势[1,2]。过敏性哮喘的发生和过敏原的接触密切相关,粉尘螨变应原是诱导哮喘和其他变态反应疾病最重要的变应原之一[3,4]。有研究表明哮喘与过敏性鼻炎患者血清中粉尘螨抗原特异性IgE抗体阳性率为70%~80%[5]。肥大细胞在病理学中扮演了非常重要的角色,特别是过敏或内源性的哮喘。在过敏反应中,肥大细胞是连接过敏反应致敏阶段与效应阶段的枢纽细胞,粉尘螨抗原特异性IgE与肥大细胞表面受体FcεRI结合从而活化肥大细胞,肥大细胞的活化释放了大量的生物活性介质包括组织胺、蛋白酶、半胱氨酰白三烯和前列腺素等,肥大细胞脱颗粒为检测肥大细胞是否被活化提供了重要依据[6]。鉴于种种现状,对肥大细胞在过敏性哮喘中的病理学作用的研究有着非常重要的意义。
1 材料与方法
1.1 材料 粉尘螨粗抗原由深圳大学过敏和免疫研究所提供,BALB/c小鼠购自广州实验动物中心,明矾佐剂购自Thermo公司,色甘酸钠购自Sigma公司,辣根过氧化物酶(Streptavidin-HRP)、生物素标记的羊抗鼠IgE抗体购自Southernbiotect公司,TMB显色液购自湖州英创生物科技有限公司,γ干扰素(IFN-γ)、白细胞介素4(IL-4)和白细胞介素10(IL-10)ELISA检测试剂盒购自美国eBioscience公司,组胺检测试剂盒购自武汉优尔生生物公司。
1.2 动物免疫与处理 30只BALB/c小鼠随机均分为3组,阴性对照组(A组)、哮喘模型组(B组)和治疗组(C组)。A组始终使用PBS处理,B组和C 组在第0、7和14天用50 μg粉尘螨粗抗原+50 μl明矾佐剂腹腔注射致敏。在第28天,A组和B组用PBS、C组用粉尘螨粗抗原(350 μg/次)皮下注射免疫1周,隔天免疫1次,末次免疫1周后开始用50 μg粉尘螨粗抗原滴鼻激发,每天1次,连续7次。末次激发24 h后进行气道高反应检测。末次激发48 h后处死小鼠,取血,分离制备血清-20℃保存;对小鼠进行肺泡灌洗收集肺泡灌洗液(BALF),收集的BALF离心后吸取上清-20℃保存,沉淀细胞用PBS洗2次后定容至1 ml体积待染色;无菌摘取肺组织和脾脏,分别进行肺组织病理切片与脾细胞培养。
1.3 方法
1.3.1 气道高反应的检测 小鼠在第7次激发24 h之后,对小鼠进行气道高反应性(AHR)变化的检测。首先将小鼠罩入非创伤性全体积呼吸计量器(Whole body plethysmograph)鼠笼中,小鼠依次吸入雾化后的 PBS 缓冲液与 6.25、12.5、25、50 和 100 mg/ml的乙酰甲胆碱,观察小鼠肺功能指标扩大间隙(Penh)值的变化,并以正常状态下小鼠为基础值,绘制不同乙酰甲胆碱浓度激发下Penh值变化的百分比曲线。
1.3.2 BALF中细胞总数、嗜酸粒细胞计数 各组BALF离心后获得的沉淀细胞,用PBS清洗2次,定容为1 ml的细胞悬液,充分混匀后吸取0.01 ml在显微镜下进行细胞计数。取0.2 ml/个进行甩片,分别用刘氏染色液和甲苯胺蓝染色液对甩片进行染色,在光学显微镜下进行细胞计数和分类,观察肥大细胞脱颗粒现象。
1.3.3 肺组织学观察 打开小鼠胸腔,无菌摘取各组小鼠支气管肺组织,分别用4%多聚甲醛溶液和Bouin固定液固定,经过脱水包埋后常规石蜡切片,分别进行HE染色和甲苯胺蓝染色,光学显微镜观察肺部炎症细胞浸润程度和肥大细胞脱颗粒状况,参照文献[7]的Underwood评分法记录评分。
1.3.4 小鼠血清中特异性IgE水平测定 使用封闭液(pH9.6)稀释粉尘螨粗抗原至终浓度10 μg/ml,加入96孔板中4℃封闭过夜。用含有5%胎牛血清的PBS按1∶100稀释度稀释免疫血清,然后加入到已包被粉尘螨粗抗原的96孔板中,100 μl/孔,37℃孵育2 h;PBST(含吐温-20)洗板5次,加入100 μl生物素标记的羊抗鼠IgE抗体37℃孵育2 h,PBST洗板5次;加入辣根过氧化物酶(Streptavidin-HRP)100 μl/孔,37℃孵育 2 h;PBST(含吐温-20)洗板5 次,然后加入 3,3,5,5-四甲基联苯胺(TMB)显色液显色,终止反应后在酶标仪上读取吸光度A450值。
1.3.5 脾脏制备脾细胞悬液和脾细胞体外培养用RPMI1640培养基将脾细胞悬液的细胞密度稀释至 5.0×106ml-1。将 100 μl脾细胞悬液加入无菌平底24孔板中,按照每个样本在有或无粉尘螨粗抗原(终浓度20 μg/ml)的条件下,在37℃、5%CO2的恒温培养箱中培养。72 h后收集培养上清液。
1.3.6 BALF和脾细胞体外培养上清细胞因子IL-4、IL-10和IFN-γ的测定 按ELISA试剂盒说明书操作分别测定其IL-4、IL-10和IFN-γ水平。
1.3.7 BALF和血清中组胺水平的测定 按ELISA试剂盒说明书操作分别测定各组的组胺水平。
2 结果
2.1 气道高反应检测结果 结果显示(图1),A组与B组相比,在25、50和100 mg/ml的乙酰甲胆碱浓度激发时,两组数据差异显著,两者间的差异有统计学意义(P<0.01)。与 B组相比,C组在12.25 mg/ml的乙酰甲胆碱浓度激发时与之持平,但在25、50和100 mg/ml的乙酰甲胆碱浓度激发时走势与A组相似,B组与C组两者间有显著差异(P<0.01)。
2.2 BALF中细胞计数 计数结果显示,和A组[(4.23±1.18) ×104ml-1,0]相比,B 组(模型组)BALF 中的细胞总数[(77.61±8.45)×104ml-1]和嗜酸粒细胞数[(18.53±5.12)×104ml-1]明显增多。与 B 组相比,C 组[(34.22±6.61)×104ml-1,(2.25±0.66)×104ml-1]BALF 中细胞总数和嗜酸粒细胞数显著减少(P<0.01)。BALF中嗜酸粒细胞数之间的差异有统计学意义。图2和图3所示为B组和C组BALF中细胞甩片进行刘氏染色和甲苯胺蓝染色后的结果。
2.3 小鼠肺部炎症观察 肺组织HE病理切片显示,B组气管管壁出现明显增厚、轻度糜烂、绒毛损伤、排列紊乱等现象,并呈现以嗜酸性粒细胞为主的炎症细胞浸润现象,表明粉尘螨粗抗原引起了B组小鼠出现肺部病变;C组中气管管壁完整排列基本整齐无明显损伤,炎症细胞浸润症状减弱;见图4。肺组织甲苯胺蓝病理切片显示,B组肥大细胞膜出现不规则不完整状,肥大细胞有空洞基本无颗粒,气管壁周围有明显的颗粒状物质存在,表明肥大细胞已出现脱颗粒,肥大细胞被激活;C组中肥大细胞细胞膜趋于完整,颗粒被抑制在肥大细胞中未释放,气管壁周围并无明显颗粒存在;见图5、6。

图1 乙酰甲胆碱吸入后各组Penh值变化(n=10)Fig.1 Assessment of airway hyper-responsiveness follo wing inhaled methacholine(n=10)
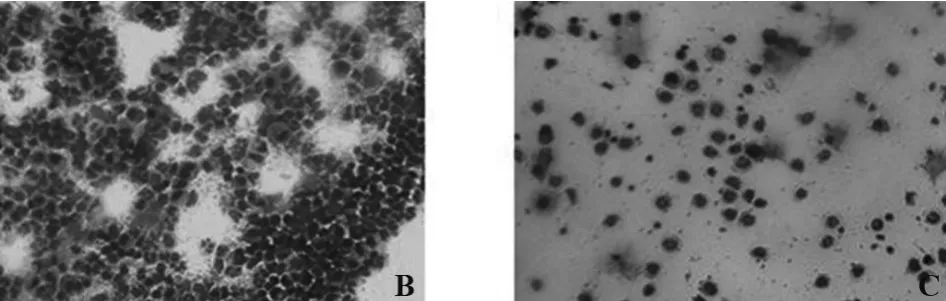
图2 BALF中细胞甩片刘氏染色后的结果(×400)Fig.2 Histopathologic changes of BALF spun cells by Liu's staining(×400)

图3 BALF中细胞甩片甲苯胺蓝染色后的结果(×400)Fig.3 Histopathologic changes of BALF spun cells by Toluidine blue staining(×400)

图4 小鼠肺组织切片HE染色(×400)Fig.4 Histopathologic changes of mice lungs by HE stain(×400)

图7 小鼠血清中特异性IgE水平检测Fig.7 Assessment of special-IgE of mice serum

图8 BALF和脾细胞体外培养上清细胞因子IL-4、IL-10和IFN-γ水平检测Fig.8 Assessment of IL-4,IL-10 and IFN-γ of BALF and supernatants of splenocytes

图9 BALF和血清中组胺水平检测Fig.9 Assessment of histamine of BALF and serum
2.4 小鼠血清中特异性IgE水平 与B组相比,C组小鼠血清中特异性IgE抗体水平明显降低(P<0.01);见图7。
2.5 BALF和脾细胞体外培养上清细胞因子IL-4、IL-10和IFN-γ水平 结果显示,与B组相比,C组BALF中IL-4水平明显降低接近A组值(P<0.01),而IL-10与A、B两组相比有明显升高(P<0.01),C组的IFN-γ 高于A、B两组(P<0.01)。C 组脾细胞上清中IL-4明显低于B组(P<0.01),而IL-10明显高于B组(P<0.01),IFN-γ也明显高于 B组(P<0.01),见图 8。
2.6 BALF和血清中组胺水平 结果显示,在BALF中,C组与B组相比略低(P<0.05),而在血清中检测出的组胺有明显降低(P<0.05),见图9。
3 讨论
本实验参照国内外文献,利用腹腔内注射尘螨抗原(尘螨粗提液)致敏,同时给予佐剂明矾,采用滴鼻激发的方法,成功建立了尘螨过敏性哮喘模型。本实验制作的小鼠过敏性哮喘模型具有哮喘的基本特征[8]:具有气道的炎症及气道高反应性,小鼠的BALF中的细胞总数和嗜酸性粒细胞均明显增多,部分肺组织也可见炎症细胞的浸润。血清中抗原特异性IgE水平明显升高。对BALF中IL-4和IFN-γ的测定表明:IL-4明显升高,而IFN-γ明显降低,表现为Th2型的细胞因子占优势。用尘螨粗提液进行治疗后,小鼠的哮喘症状明显减轻,表现为:气道高反应性和肺部病理症状减轻,细胞总数和嗜酸粒细胞数明显减少,血清中抗原特异性IgE抗体水平明显降低,BALF和脾细胞体外培养上清细胞因子IL-4水平治疗组明显降低接近阴性对照组值,而IL-10治疗组与其他两组相比有明显升高,治疗组的IFN-γ也高于其他两组。这说明利用尘螨粗提液对于哮喘的治疗是非常有效果的,能够大大减轻哮喘症状。
组织内的肥大细胞来源于骨髓、脐带血的干细胞。体外培养CD34+造血干细胞,在IL-3的作用下,可产生肥大细胞;而IL-4和其他的基质蛋白则影响肥大细胞的成熟。哺乳类动物组织内的肥大细胞主要分布于机体与外界环境相通的地方,如皮肤、气道和消化道,这些部位经常可以接触到病原体、过敏原以及环境中的其他物质。肥大细胞在这些物质的刺激下,脱颗粒、释放胞浆递质,如组胺、白细胞介素、蛋白酶和前列腺素等[9,10]。其中,组胺作为一种前炎症因子,仅存在于肥大细胞和嗜碱性粒细胞中,只有这些细胞被激活脱颗粒时,其才能释放到细胞外发挥作用。因此,组胺被认为是肥大细胞脱颗粒的标志物。目前,许多抗过敏药物均具有抑制IgE诱导的肥大细胞释放组胺的作用[11]。通过组胺释放实验,本实验中治疗组BALF和血清中的组胺水平都有降低,因此可推断出治疗组中肥大细胞的脱颗粒能力降低,这与模型组小鼠过敏性哮喘症状的减轻密切相关。
通过小鼠过敏性哮喘模型及利用尘螨粗提液对过敏性哮喘小鼠的治疗,本实验探讨了肥大细胞与过敏性哮喘之间的关系,有利于人们对于过敏性哮喘病因机理的了解,为利用抗组胺药物治疗过敏性哮喘提供了理论依据。
[1]Brozek JL,Bousquet J,Baena-Cagnani CE,et al.Allergic rhinitis and its impact on asthma(ARIA)guidelines:2010 revision[J].J Allergy Clin Immunol,2010,126(3):466-476.
[2]Bousquet J,Mantzouranis E,Cruz AA,et al.Uniform definition of asthma severity,control,and exacerbations:Document presented for the world health organization consultation on severe asthma[J].J Allergy Clin Immunol,2010,126(5):926-938.
[3]Sade K,Roitman D,Kivity S.Sensitization to Dermatophagoides,Blomia tropicalis,and other mites in atopic patients [J].J Asthma,2010,47(8):849-852.
[4]陈育智,马 煜,王红玉,等.中国三城市儿童个人过敏原与喘息及气道高反应性的相关性研究[J].中华儿科杂志,2003,41(7):538-541.
[5]朱健琪,刘志刚,高 波,等.粉尘螨I类变应原(Der f I)的克隆表达、纯化及免疫学特性[J].昆虫学报,2006,49(2):213-218.
[6]Wenzel SE,Larsen GL,Johnston K,et al.Elevated levels of leukotriene C4 in bronchoalveolarlavage fluid from atopic asthmatics after endobronchial allergen challenge[J].Am Rev Respir Dis,1990,142:112e 9.
[7]Yu HQ,Li XH,Guo H,et al.Sublingual immunotherapy efficacy of Dermatophagoides farinae vaccine in a murine asthma model[J].Int Arch Allergy Immunol,2010,152(1):41-48.
[8]郝敏麒,徐 军,钟南山.尘螨致敏小鼠肺部变应性炎症模型的建立[J].中国病理生理杂志,2003,19(1):139-141.
[9]沈士亮.肥大细胞与过敏性哮喘[J].皖南医学院学报,2012,31(5):345-348.
[10]郑敬民,尹 广,姚根宏,等.肥大细胞在糖尿病肾病患者肾组织中的分布及相关性研究[J].医学研究生学报,2012,25(6):622-627.
[11]谢 华,何韶衡,程明华,等.类胰蛋白酶抑制剂对人大肠肥大细胞组胺释放的影响[J].细胞与分子免疫学杂志,2004,20(6):678-681.
