RNA干扰技术沉默MMP-9基因对THP-1细胞影响的实验研究①
2014-11-27凌云志韩昂轩徐鹏琛高乾乾
禹 莉 凌云志 肖 霄 韩昂轩 彭 柯 徐鹏琛 高乾乾
(蚌埠医学院医学检验系输血学教研室 临床检验诊断学实验中心,蚌埠 233030)
白血病是一种造血系统的恶性克隆性疾病,严重威胁人类健康。浸润和转移是恶性肿瘤的主要生物学特性,也是导致治疗失败和患者死亡的主要原因。基质金属蛋白酶(Matrix metalloproteinase,MMP)在肿瘤的侵袭和转移过程中具有重要作用,逐渐成为恶性肿瘤治疗的一个新靶点。在基因治疗方面,反义寡核苷酸和干扰技术用来干扰MMP基因表达,作为新的分子靶点,为肿瘤的基因治疗提供新的、有前途的手段。RNA干扰(RNAi)是由双链RNA(dsRNA)所引起的序列特异性基因沉默。RNA干扰效应具有两个明显的特征:特异性和高效性。与其他方法相比,RNAi技术在基因功能研究上有其独特的优点[1-3]:简单易行,容易开展;与基因敲除相比实验周期短,成本低;与反义技术相比,具有高度特异性和高效性。本实验设计合成针对MMP-9基因的小干扰RNA(small interfering RNA,siRNA),并转染人急性单核细胞白血病细胞株THP-1细胞,分析siRNA转染后THP-1细胞中MMP-9 mRNA及蛋白表达的变化及其对THP-1细胞增殖的影响。
1 材料与方法
1.1 材料细胞株 THP-1细胞购自中国科学院上海细胞生物学研究所。主要试剂:RPMI1640培养液、新生牛血清为美国Gibco公司产品;脂质体转染试剂 LipofectamineTM2000为 Invitrogen公司产品;RT-PCR试剂盒(MBI Fermentas公司);Trizol试剂(Invitrogen公司);羊抗MMP-9抗体(Santa Cruz公司);细胞裂解液、PMSF、TEMED、电泳液、封闭液、转膜液(碧云天公司),化学发光增强液(Millipore公司)。
1.2 方法
1.2.1 目的siRNA的设计合成 参考文献[4],根据siRNA设计原则,从基因编码区选择靶序列1 324~1 344核苷处,委托上海吉玛制药技术有限公司合成 siRNA,如下:5'-UUC AGG GCG AGG ACC AUA GAG-3'。并选取无意义序列作为阴性对照(siRNAN):5'-ACG UGA CAC GUU CGG AGA AdTdT-3'。
1.2.2 细胞培养 THP-1细胞接种于含10% 灭活新生牛血清的RPMI1640培养基,置37℃饱和湿度的5%CO2培养箱中培养,2~3 d细胞换液传代培养。取处于对数生长期的THP-1细胞接种于6孔细胞培养板中,培养24 h后准备进行细胞转染。
1.2.3 细胞转染 分为3组:空白对照组(不转染siRNA,只应用Lipofectamine 2000)、阴性对照组(转染无意义序列)和siRNA组(转染 MMP-9 siRNA)。转染时以50 nmol/L的浓度用Lipofectamine 2000脂质体进行转染,按说明书操作分别转染接种细胞,继续培养48 h后进行检测分析,每组实验重复3次。
1.2.4 RT-PCR检测MMP-9 mRNA表达 参照Trizol试剂说明书提取不同处理组细胞总RNA。取3 μl总RNA为模板,用随机引物反转录合成cDNA,以此cDNA 2 μl为模板,PCR扩增,所用引物见表1,引物均由上海生工生物工程技术服务有限公司合成。PCR反应体系终体积为50 μl,反应条件:94℃5 min,94℃ 变性1 min,60℃ 退火30 s,72℃ 延伸1 min,35个循环后72℃ 平衡10 min,4℃保存。PCR产物进行1.5%琼脂糖凝胶电泳,Smart view图像分析处理系统进行灰度扫描分析。
1.2.5 Western blot法检测MMP-9蛋白表达 收集3组THP-1细胞,用预冷的裂解液裂解,按说明书操作提取蛋白,Bradford法进行蛋白质定量。SDS-PAGE(8%分离胶,5% 浓缩胶)电泳后,蛋白质湿转至PVDF膜上;封闭液封闭,分别加入稀释的一抗37℃孵育2 h;TBST洗膜后,加入相应的辣根酶标记的二抗37℃孵育1 h,TBST洗膜。化学发光增强液与膜充分接触,曝光,凝胶成像系统成像。
1.2.6 四甲基偶氮唑蓝(MTT)法检测THP-1细胞的增殖能力 将3组细胞接种于96孔板(调整细胞浓度为 5 ×104ml-1),每孔200 μl,培养48 h;加入5 mg/ml MTT溶液20 μl,继续培养4 h;吸去上清后每孔加入200 μl DMSO,避光振荡10 min,使蓝紫色结晶充分溶解,酶标仪上读取A570 nm值。每组实验重复3次,每次做5个平行孔,按照公式计算生长抑制率,抑制率=(1-实验组平均A值/对照组平均A值)×100%。
1.2.7 细胞活率和形态观察 调整3组细胞浓度为2 ×105ml-1,每瓶含5 ml培养液,培养 48、72 h,计数各组细胞数,用0.4%台盼蓝染色,计数活细胞数,细胞活率=活细胞数/细胞总数×100%。每次每瓶计数3次,实验重复3次。取各组细胞先在倒置显微镜下观察,再将细胞悬液离心涂片,用Wright染色,光镜下观察细胞形态变化。
1.3 统计学方法 采用方差分析和q检验。
2 结果
2.1 siRNA转染后THP-1细胞中MMP-9 mRNA的表达 3组细胞均可见MMP-9基因电泳带存在,但其亮度存在差异,siRNA转染组mRNA经RT-PCR后电泳带亮度明显弱于阴性对照组和空白对照组(图1)。电泳图谱经图像软件分析,siRNA组、阴性对照组和空白对照组MMP-9 mRNA的表达强度结果见表 2,显示转染 MMP-9 siRNA后,siRNA组MMP-9 mRNA的表达与阴性对照组和空白对照组相比均有显著性差异(P<0.05)。

表1 扩增目的基因和内参照引物序列及产物长度Tab.1 Primer sequences and length of productions of objective genes and β-actin
2.2 siRNA转染后THP-1细胞中MMP-9蛋白的表达 Western blot对蛋白质测定结果见图2,siRNA转染组条带亮度明显弱于阴性对照组和空白对照组。经图像软件分析,结果显示:siRNA组、阴性对照组和空白对照组的内参β-actin蛋白表达量无明显差异,而siRNA组MMP-9蛋白的表达与空白对照组和阴性对照组比较均有显著性差异(P<0.05),见表1。
2.3 MMP-9 siRNA对THP-1细胞增殖能力的影响
siRNA组转染后48、72 h,THP-1细胞的增殖能力与对照组相比较,A570 nm值明显下降(P<0.05),细胞生长受到明显抑制,随着转染时间的延长,生长抑制率增加。表明MMP-9 siRNA具有抑制THP-1细胞增殖的能力(表3)。
2.4 MMP-9 siRNA对THP-1细胞活率的影响siRNA组转染后48、72 h,THP-1细胞活率为与空白对照组及阴性对照组相比较明显下降(P<0.05,P<0.01),结果见表4,表明MMP-9 siRNA能够抑制THP-1细胞生长,促进细胞凋亡。
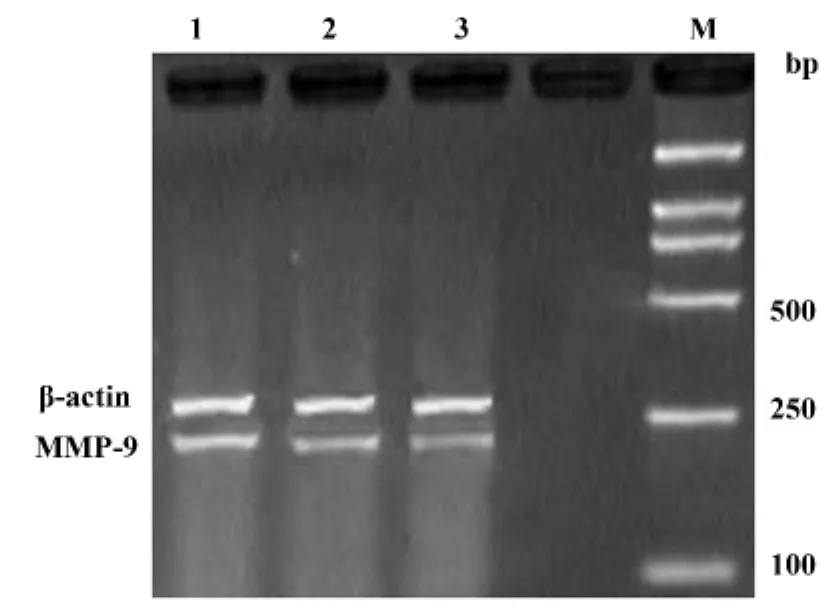
图1 RT-PCR检测MMP-9 mRNA的表达Fig.1 Express of MMP-9 mRNA by RT-PCR

图2 Western blot检测MMP-9蛋白的表达Fig.2 Express of MMP-9 protein by Western blot
2.5 细胞形态学观察 倒置显微镜下可见空白对照组和阴性对照组细胞呈半贴壁生长,细胞轮廓清楚,形态均一,生长旺盛。而siRNA组细胞生长受抑,细胞集落减少,大小不一,胞膜明显皱缩,细胞中颗粒增多,细胞碎片增多,见图3。经Wright染色后观察,对照组THP-1细胞呈圆形,细胞膜完整,染色质疏松,呈紫红色,核仁清晰,胞浆量少;siRNA组细胞形态有明显改变,大小不一,细胞着色不均,大部分细胞出现凋亡的形态学变化,表现为细胞皱缩、体积缩小,细胞核固缩,核内染色质浓缩凝聚,出现核边聚、核碎裂、核溶解,并可见典型的凋亡小体等,见图 4、5。
表2 各组MMP-9 mRNA及蛋白的相对表达水平(,n=3)Tab.2 Express value of MMP-9 mRNA and protein(,n=3)

表2 各组MMP-9 mRNA及蛋白的相对表达水平(,n=3)Tab.2 Express value of MMP-9 mRNA and protein(,n=3)
Note:1)P<0.05 vs blank control group;2)P<0.05 vs negative control group.
?
表3 MMP-9 siRNA对THP-1细胞增殖能力的影响(,n=3)Tab.3 Effect of MMP-9 siRNA on proliferation of THP-1 cells(,n=3)

表3 MMP-9 siRNA对THP-1细胞增殖能力的影响(,n=3)Tab.3 Effect of MMP-9 siRNA on proliferation of THP-1 cells(,n=3)
Note:1)P<0.01 vs blank control group;2)P<0.05 vs negative control group.
Group 48 h A570 nm value rate of inhibition(%)72 h A570 nm value rate of inhibition(%)Blank control group 0.446 1±0.073 0 0.461 6±0.31 0546 0 Negative control group0.410 8±0.084 4 7.9 0.437 7±0.084 1 5.2 siRNA group 0.350 5±0.061 21)2)21.4 0.318 7±0.062 31)2)
表4 MMP-9 siRNA对THP-1细胞活率的影响(,n=3)Tab.4 Effect of MMP-9 siRNA on motility rate of THP-1 cells(,n=3)

表4 MMP-9 siRNA对THP-1细胞活率的影响(,n=3)Tab.4 Effect of MMP-9 siRNA on motility rate of THP-1 cells(,n=3)
Note:1)P<0.01 vs blank control group;2)P<0.05 vs negative control group;3)P<0.01 vs negative control group.
Group The motility rate of THP-1 cells(%)48 h 72 h Blank control group 86.89±5.95 85.33±5.66 Negative control group 82.33±3.87 80.11±4.57 siRNA group 73.44±6.481)3) 74.11±6.011)2)

图3 倒置显微镜下THP-1细胞形态学改变(×400)Fig.3 Changes in morphology of THP-1 cells through inverted microscope( ×400)

图4 Wright染色后THP-1细胞形态(×100)Fig.4 Morphology of THP-1 cells after Wright stain( ×100)
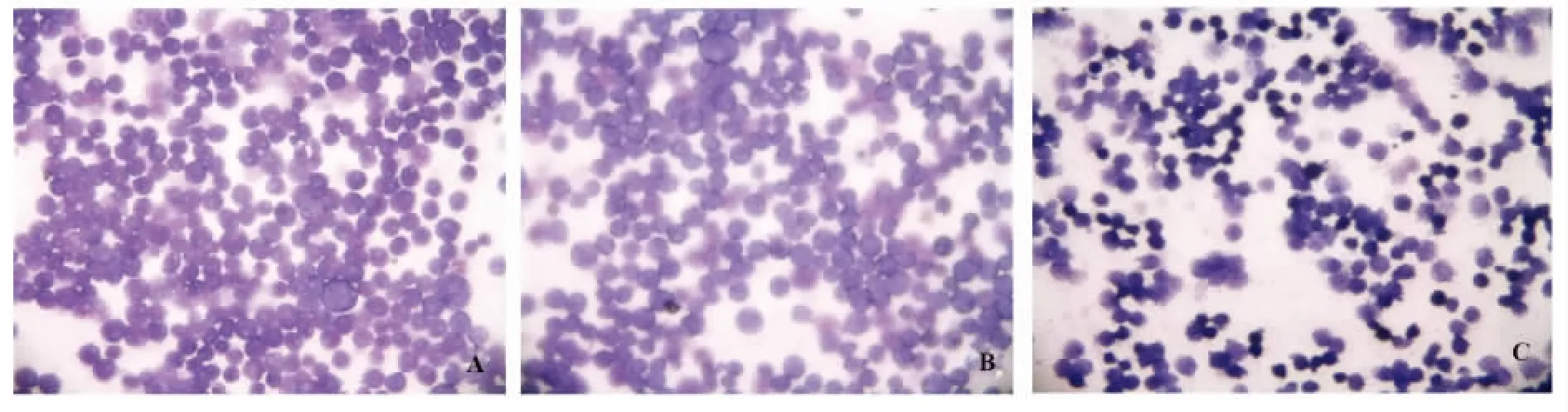
图5 Wright染色后THP-1细胞形态(×400)Fig.5 Morphology of THP-1 cells after Wright stain( ×400)
3 讨论
白血病是一种常见的血液系统恶性肿瘤,在我国,儿童及35岁以下成人恶性肿瘤的死亡率中,其中由白血病引起的居首位,严重威胁人类健康。恶性肿瘤的主要特点是侵袭并向远处器官转移,在恶性肿瘤突破细胞外基质进入血管,以及新生血管的出芽过程中都需要降解细胞外基质。肿瘤细胞对基底膜胶原的溶解是其向细胞外基质扩散的起始,因此基底膜完整性的破坏被认为是恶性肿瘤侵袭开始的一个标志。MMP-9是锌离子依赖性蛋白水解酶超家族成员之一,具有降解细胞外基质的能力,它属于Ⅳ型胶原酶,主要降解细胞外基质中基底膜的主要结构蛋白-Ⅳ型胶原,并能促进血管生成和调节细胞黏附性,促进细胞的迁移[5-7],因此,它在肿瘤的侵袭和转移中占有重要的地位。
目前急性白血病的主要治疗手段是通过细胞毒药物杀灭病人体内恶性增殖的白血病细胞,这虽然能使大部分患者获得缓解和延长生存期,但治愈率低,而且由于化疗药物的非特异性细胞毒性,往往造成患者治疗的相关性死亡。近年来,随着分子生物学与基因工程的研究进展,白血病的基因治疗已被广泛研究,部分白血病基因治疗进入临床试验阶段,基因治疗不但为白血病开辟出新的治疗途径,而且有可能成为治愈白血病的重要手段。RNAi已成为分子生物学研究的主要技术手段之一,其作用机制是通过活化的siRNA靶向降解目的mRNA,从而使目的基因表达沉默。目前,MMP作为抑制肿瘤侵袭和转移治疗靶点的研究已开展。
在本实验中,将靶向MMP-9的特异性siRNA转染至THP-1细胞,通过RT-PCR及Western blot方法检测MMP-9 mRNA及蛋白表达的变化。结果显示,在siRNA转染组THP-1细胞MMP-9 mRNA及蛋白表达明显受到抑制,显著低于阴性对照组和空白对照组,差异有统计学意义。
MTT结果显示,siRNA组转染后48、72 h,THP-1细胞的增殖能力与对照组相比较,A570 nm值明显下降(P<0.05),细胞生长明显受到抑制,随着转染时间的延长,生长抑制率增加。表明MMP-9 siRNA具有抑制THP-1细胞增殖的能力。台盼蓝染色结果显示,siRNA组转染后48、72 h,THP-1细胞活率与空白对照组及阴性对照组相比较明显下降,表明MMP-9 siRNA能够抑制THP-1细胞生长,促进细胞凋亡。
本实验在倒置显微镜下观察发现,空白对照组和阴性对照组细胞呈半贴壁生长,细胞轮廓清楚,形态均一,生长旺盛。而siRNA组细胞生长受抑,细胞集落减少,大小不一,胞膜明显皱缩,细胞中颗粒增多,细胞碎片增多,经Wright染色后观察,对照组THP-1细胞呈圆形,染色质呈紫红色,胞浆量少;siRNA组细胞形态有明显改变,大部分细胞出现凋亡的形态学变化,表现为细胞皱缩、体积缩小,细胞形态出现核固缩、核边聚、核碎裂,并可见典型的凋亡小体等。研究表明MMP-9 siRNA能够促进THP-1细胞凋亡。总之,研究结果提示:采用siRNA技术可靶向干扰体外THP-1白血病细胞MMP-9 mRNA和蛋白水平的表达,在MMP-9表达受抑后可有效抑制THP-1细胞的增殖,促进THP-1细胞凋亡。这就为包括白血病在内的血液系统恶性肿瘤的基因治疗提供了一个新的切入点。
[1]Meng XB,Bi XL,Zhao HL,et al.Small interfering RNA targeting nuclear factor kappa B to prevent vein graft stenosis in rat models[J].Transplant Proc,2013,45(6):2553-2558.
[2]Yin JQ,Wan Y.RNA 2mediated gene regulation system:now and future[J].Int J Mol Med,2002,10(4):355-365.
[3]Coelho T,Adams D,Silva A,et al.Safety and efficacy of RNAi therapy for transthyretin amyloidosis[J].N Engl J Med,2013,369(9):819-829.
[4]赵凤娟,崔小伟,刘 建,等.靶向 MMP-9的 siRNA抑制人类SGC7901胃腺癌细胞侵袭和迁移的研究[J].天津医药,2009,37(8):628-631.
[5]Qian Q,Wang Q,Zhan P,et al.The role of matrix metalloproteinase 2 on the survival of patients with non-small cell lung cancer:a systematic review with meta-analysis[J].Cancer Invest,2010,28(6):661-669.
[6]Yeh HC,Lin SM,Chen MF,et al.Evaluation of serum matrix metalloproteinase(MMP)-9 to MMP-2 ratio as a biomarker in hepatocellular carcinoma[J].Hepatogastroenterology,2010,57(97):98-102.
[7]Roomi MW,Monterrey JC,Kalinovsky T,et al.In vitro modulation of MMP-2 and MMP-9 in human cervical and ovarian cancer cell lines by cytokines,inducers and inhibitors[J].Oncol Rep,2010,23(3):605-614.