合欢花黄酮对精神分裂症模型大鼠学习能力的影响及其机制研究①
2014-11-27杜志敏宋予娟吕路线李万里新乡医学院免疫教研室新乡453003
杜志敏 马 倩 宋予娟 吕路线 齐 鹏 李万里 (新乡医学院免疫教研室,新乡453003)
精神分裂症是临床上较为常见的危害人体健康的疾病。该病多发生于青壮年,常伴有感知、情感、思维、行为等方面的障碍,一般无意识和智能障碍,可伴有记忆、信息整合和抽象思维等损害,是一组病因不明的症状与体征的集合[1]。精神分裂症不仅严重影响了患者及其家属的工作和生活,而且也给患者及家庭、社会带来沉重的负担。
合欢花中含有多糖、多酚、黄酮等多种活性成分,经研究显示,黄酮类化合物具有抗肿瘤、抗氧化自由基、抗菌、镇静、消炎、提高免疫力、调节血管渗透性等作用,最近研究发现黄酮类化合物对神经精神系统有显著的影响,例如神经保护、中枢抑制、抗抑郁、抗焦虑等作用[2]。合欢花黄酮的药理作用多,价格低,且安全剂量大,毒副作用小,因此成为神经精神系统研究领域的热点。
目前非竞争性N-甲基-D-天冬氨酸(NMDA)受体拮抗剂地卓西平马来酸盐(Dizocilpine maleate,MK-801)已经广泛应用于制作精神分裂症动物模型。该药物可使实验动物表现出精神分裂症的一些阳性、阴性症状以及认知功能的损害[3]。本实验采用MK-801制备大鼠模型,使用合欢花黄酮对模型进行干预,观察模型的学习认知能力的变化,并且检测其对模型大鼠海马组织中精神疾病相关蛋白S100-β、c-Fos表达的影响,探讨其干预精神分裂症的分子机制。
1 材料及方法
1.1 实验动物 SPF级SD大鼠,雌雄各半,体重190~220 g,河北省实验动物中心提供,许可证号SCXK(冀)2008-1-003。饲养温度为20~26℃之间,湿度保持在50% ~60%,定期清洗消毒。
1.2 实验主要试剂 MK-801(美国Sigma公司),兔抗大鼠S100-β、c-Fos多克隆抗体(武汉博士德公司),SP试剂盒 SP9001、FITC标记山羊抗兔 IgG(H+L)、β-actin抗体(北京中杉金桥生物技术有限公司)。
1.3 合欢花黄酮的提取 称取粉碎后的合欢花粉末购买于新乡市张仲景大药房,包好置于索氏提取器内,用石油醚加热回流脱脂6 h,此时抽提液呈无色,50%乙醇浸提2 h,浸提温度70℃,浸提2次。提取液抽滤,取滤液测定黄酮含量[4]。黄酮提取率(%)=,式中:c为量黄酮质量浓度(mg/ml);v为提取液体积ml;N为样品稀释倍数;m为未脱脂前原料的质量g。
1.4 实验分组 SD大鼠,单笼适应性饲养环境5天后,随机分为四组,每组10只,分别为正常组(Control)、模型组(Model)、氟哌啶醇阳性对照组(HLA)、合欢花黄酮干预组(FAF)。
1.5 模型构建及干预 Control组与Model组灌胃生理盐水,HLA组灌胃氟哌啶醇(剂量:2 mg/kg),FAF组灌胃合欢花黄酮(剂量:60 mg/kg)单位体重给药容量100 μl/20 g,1 次/d,连续给 28 d 后,Model组、HLA组、FAF组按照100 μl/20 g的单位体重给药容量分别于右后侧腹腔注射0.6 mg/kg MK-801,Control组腹腔注射等体积生理盐水,均连续注射3 d建立模型[5]。于第4天进行Morris水迷宫实验,评价模型是否成功的标准:以Control组大鼠逃避潜伏期的均值为参考值,计算每只大鼠的平均逃避潜伏期值与参考值之差占该鼠的平均逃避潜伏期时间的比值 >20%则表示造模成功[6,7],根据实验数据分析评定,Model组10只大鼠均造模成功,提示MK-801阻断NMDA受体成功。建模过程中未出现动物死亡。根据实验观察所有大鼠采用同样的测试顺序,实验直至结束均采用双盲测试。
1.6 Morris水迷宫测试 Morris水迷宫可通过对大鼠进行定位航行(大鼠逃避实验)和空间探索实验来判断其学习记忆能力,用大鼠逃避潜伏期和穿越平台次数来表示。对Control组、Model组、氟哌啶醇组(HLA)、合欢花黄酮组(FAF)造模后大鼠行水迷宫测试。采用诺达思(北京)信息技术公司研制开发的Morris水迷宫视频分析系统进行信息处理,该系统能动态记录大鼠在水迷宫中游泳的录像资料,设定分析参数,进行数据分析。定位航行实验:于给药结束1 d后进行,实验前将大鼠置于站台上适应30 s,随后将大鼠随机四个象限面壁置入池内,大鼠登上站台5 s后终止记录,最长记录时间为60 s,若大鼠在60 s内不能上台,引导其登上站台适应30 s,最后将大鼠擦干放入鼠笼,4次/d,每次间隔1 h,定位航行训练需要4 d。空间探索实验:于第5 d进行,实验时撤去液面下站台,大鼠于四个象限入水点面壁入水,让其自由游泳60 s,测量大鼠在目标象限穿越平台次数。
1.7 免疫组化 水迷宫实验结束24 h后,4%多聚甲醛10 ml/min灌注取出海马组织。取其左侧海马组织置于多聚甲醛中固定24 h,再分别放入10%、20%、30%蔗糖PBS液中4℃冰箱过夜至沉底。经过冲洗、脱水、透明、浸蜡、包埋、切片等步骤制作7 μm石蜡切片(冠状位切取海马)。石蜡切片经过熔蜡、脱蜡水化、抗原修复、破膜、封闭、S100-β、c-Fos一抗孵育、清洗、生物素标记的二抗孵育、清洗、DAB显色等步骤后,在显微镜下观察各组大鼠海马细胞中S100-β、c-Fos蛋白的分布和表达变化情况。
1.8 免疫荧光 石蜡切片经过熔蜡、脱蜡水化、抗原修复、破膜、封闭、S100-β、c-Fos一抗孵育、清洗、FITC标记的二抗孵育、清洗、复染DAPI、封片等步骤后,在荧光显微镜下观察各组大鼠海马细胞中S100-β、c-Fos蛋白的分布和表达变化情况。
1.9 免疫印迹(Western blot) 水迷宫实验结束24 h后,4%多聚甲醛10 ml/min灌注取出右侧海马,先液氮保存,再冻存于-80℃冰箱保存备用。取出脑组织加入预冷的细胞裂解液,经过研磨制成匀浆液,冰浴 30 min,15 000 r/min,4℃离心 30 min,取上清至EP管中。BCA试剂盒定量蛋白,每组蛋白上样量30 μg,经过SDS-PAGE 电泳,转膜,一抗孵育,二抗孵育后,ECL发光并且X胶片曝光。所得的胶片结果经扫描后,利用Quantity One凝胶成像分析系统分析条带并记录灰度值结果,并与内参β-actin的灰度值相比较得出相对灰度值结果。
2.10 统计学分析 应用SPSS18.0统计软件分析,数据均经方差齐性检验,以x-±s标准差形式表示,多个样本均数比较采用One-way ANOVA检验,水迷宫实验数据采用重复测量数据方差分析,组间及组内两两比较用 LSD-t检验或 Dunnett’s检验,P<0.05为差异有显著统计学意义。
2 结果
2.1 水迷宫测试结果 4组大鼠4 d寻找目标象限时间(逃避潜伏期,Escape latency,EL)比较显示:Control组大鼠的逃避潜伏期最短,学习记忆能力最强;与Control组比较,Model组、HLA组、FAF组EL均延长,HLA组、FAF组大剂量大鼠的EL较Model组大鼠明显缩短,差异有统计学意义(P<0.05 or P<0.01);HLA组、FAF组大鼠的EL差异无统计学意义(P>0.05);4组大鼠第5 d穿越平台次数(Views across platforms,VAP)比较显示:Control组大鼠VAP最多,空间记忆能力最强;与Control组比较,Model组、HLA组、FAF组大鼠 VAP均减少,HLA组、FAF组大鼠较Model组大鼠VAP明显增多,差异有统计学意义(P<0.01);HLA组、FAF组大鼠VAP差异无统计学意义(P>0.05)。水迷宫测试结果显示:HLA组、FAF组大鼠的学习记忆能力明显改善(图1和2)。
2.2 免疫组化检测大鼠海马组织中S100-β、c-Fos蛋白的表达 免疫组化结果显示Control组仅见少量S100-β、c-Fos免疫组化阳性细胞,细胞着色较浅;Model组,S100-β、c-Fos蛋白表达较多,细胞着色较深,颗粒增粗,与Control组相比差异有统计学意义(P <0.01);HLA 组、FAF 组 S100-β、c-Fos阳性细胞表达较Model组有所减少,同时细胞着色较Model组浅,差异有统计学意义(P<0.01);HLA组与FAF组之间S100-β、c-Fos阳性细胞表达差异无统计学意义 (P>0.05)(图3和4)。
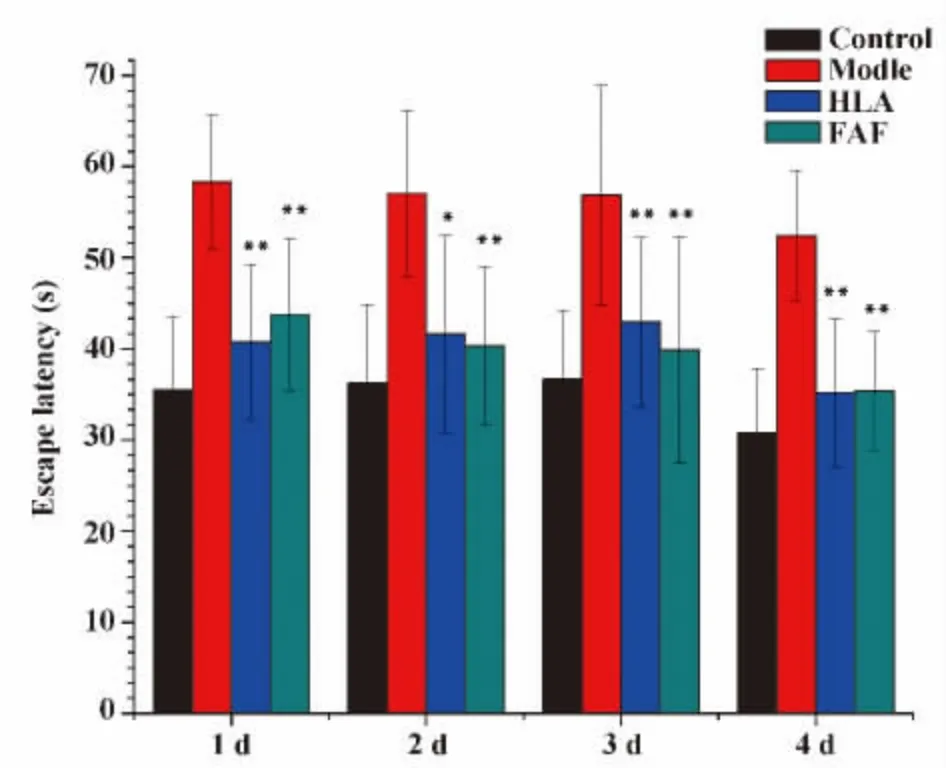
图1 大鼠逃避实验Fig.1 Escape latency experiments in rats
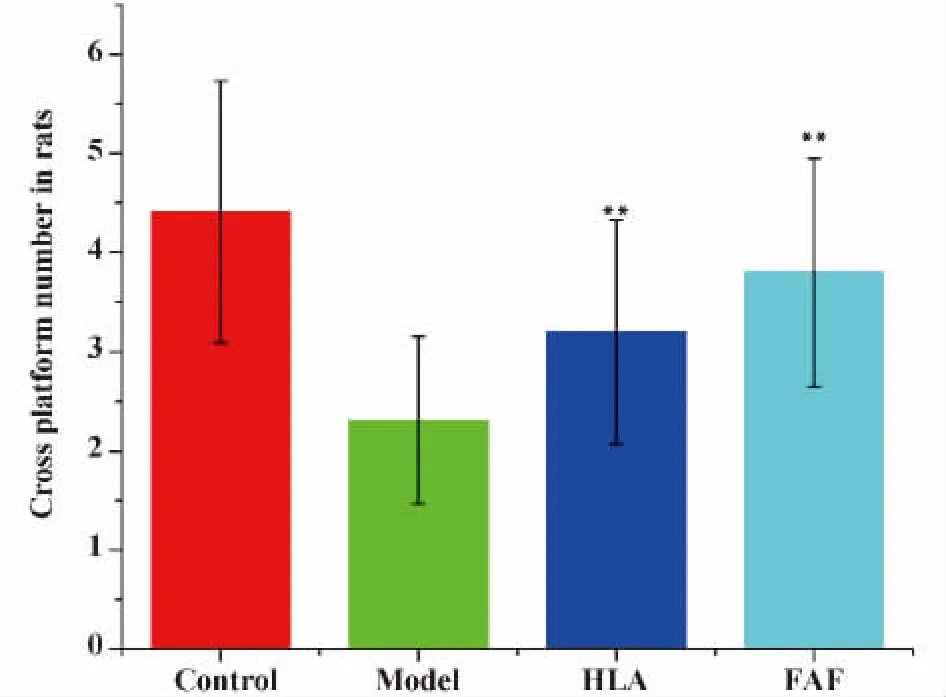
图2 大鼠穿越平台实验Fig.2 Experimental of views across platforms in rats
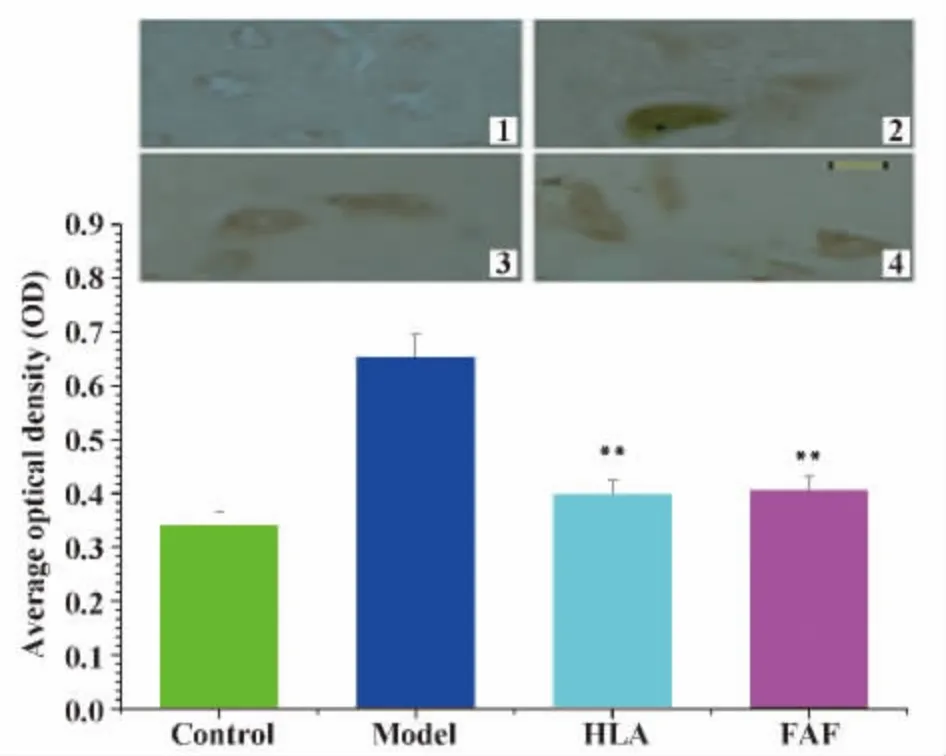
图3 海马组织中S100-β蛋白的表达分析Fig.3 The expression of S100-β in hippocampal tissue

图4 海马组织中c-Fos蛋白的表达分析Fig.4 The expression of c-Fos protein in hippocampal tissue

图5 S100-β蛋白的表达Fig.5 Expression of S100-β protein
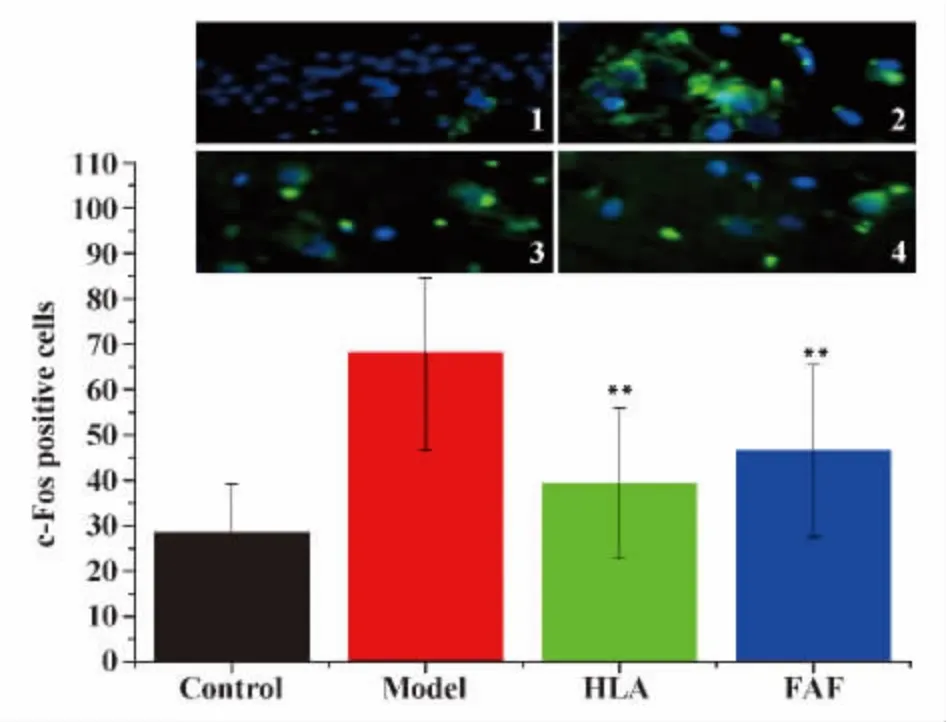
图6 c-Fos蛋白的表达Fig.6 Expression of c-Fos protein
2.3 免疫荧光检测大鼠海马组织中S100-β、c-Fos蛋白的表达 免疫荧光的结果显示Control组绿色荧光细胞数明显少于Model组,差异有统计学意义(P<0.01)。HLA组、FAF组海马中可见绿色荧光,但与Model组相比,细胞数减少,荧光较弱,差异有统计学意义(P<0.01)。HLA组、FAF组之间差异无统计学意义(P>0.05)(图5和6)。
2.4 Western blot检测脑组织S100-β、c-Fos蛋白的表达 Western blot结果显示:Control组中S100-β、c-Fos蛋白表达处于较低水平,Model组中S100-β、c-Fos蛋白表达水平较Control组均明显升高,差异有统计学意义(P <0.01);HLA组、FAF组中S100-β、c-Fos蛋白表达较Model组有所降低,差异具有统计学意义(P<0.01);HLA组、FAF组中S100-β、c-Fos蛋白表达未见明显差异,无统计学意义(P>0.05)(图7)。
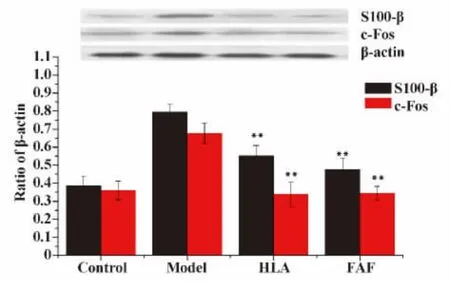
图 7 S100-β、c-Fos蛋白的表达Fig.7 The expression of S100-β,c-Fos protein in brain tissue
3 讨论
关于精神分裂症的发病机制有三大假说:多巴胺功能亢进假说、5-羟色胺功能紊乱假说和谷氨酸功能低下假说。与精神分裂症发病的三大假说相对应,有三大类拟精神病药物用于制作精神分裂症动物模型:多巴胺受体激动剂、5-羟色胺受体激动剂、谷氨酸受体拮抗剂。谷氨酸受体拮抗剂如地卓西平马来酸盐(MK-801)能很好地模拟精神分裂症的阳性症状、阴性症状和认知功能障碍三大症状,因此至今为止MK-801仍是精神病药物筛选的首选模型[8]。研究表明,小剂量MK-801破坏了大鼠的参照记忆、空间工作记忆和逆反学习,从而能够在多个认知维度上模拟精神分裂症患者的认知缺陷[9]。本实验就采用MK-801作为精神分裂症的诱导剂来构建大鼠精神分裂症模型。在水迷宫实验中,模型组大鼠表现出了较低的空间参考记忆,而合欢花黄酮干预后改善了这些认知能力,提示合欢花黄酮能够有效改善大鼠精神分裂症的认知缺陷。
S100-β是一种钙结合蛋白,已被作为活化的胶质细胞和脑功能障碍的标志物。S100-β在血清和脑脊液中的浓度变化可以灵敏地反映中枢损害的程度,故可作为判断和定量评估轻微脑损害程度的特异指标[10]。凌四海等[11]研究发现精神分裂症患者血浆中S100-β浓度明显升高,且患者精神症状越严重,其血浆中S100-β浓度越高。c-Fos蛋白是即刻早期基因c-Fos的神经元激活后快速转录的产物。正常情况下,在绝大多数神经元中c-Fos蛋白呈现低水平表达,不易检测到。但在外界刺激导致脑损伤时,海马及皮层短时内即可出现c-Fos的激活和过表达[12]。Nowak 等[13]通过利用地卓西平马来酸盐(MK-801)制备大鼠模型,使其产生精神分裂症样症状,采用免疫组化的方法检测到在内侧前额叶皮质层下发现c-Fos的表达显著增加。本研究中发现,S100-β和c-Fos在精神分裂症模型大鼠海马组织中表达增多,而合欢花黄酮能够明显降低这两种蛋白的表达。由于S100-β和c-Fos与精神分裂症有着密切的关系,而合欢花黄酮能够降低其表达,因此合欢花黄酮很可能是改变这两种蛋白的表达而改善了精神分裂症的症状。
综上所述,合欢花黄酮具有一定的神经保护作用,能改善精神分裂大鼠的认知缺陷,并且其作用可能与精神分裂症大鼠海马组织中的S100-β、c-Fos表达下调有关。
[1]回秀清,王学义.精神分裂症认知功能损害特点及干预研究进展[J].神经疾病与精神卫生,2011,11(1):69-72.
[2]马 锐,吴胜本.中药黄酮类化合物药理作用及作用机制研究进展[J].中国药物警戒,2013,10(5):286-290.
[3]司天梅,舒 良.地卓西平马来酸盐动物行为模型研究[J].中华精神科杂志,2000,33(3):158-160.
[4]袁建梅,郭伟云,汪应灵.合欢花中总黄酮的提取工艺及对羟自由基清除作用的研究[J].中国食品添加剂,2012,(1):87-91.
[5]Sams-Dodd F.Phencyclidine-induced stereotyped behaviour and social isolation in rats:a possible animal model of schizophrenia[J].Behavioural pharmacology,1996,7(1):3-23.
[6]冀俊虎,董联玲,曹 娟,等.红景天对阿尔茨海默病大鼠行为学和脑组织抗氧化能力的影响[J].中国中医药信息杂志,2009,16(2):38-38.
[7]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nature protocols,2006,1(2):848-858.
[8]杨 闯,郭兰婷,郭田友.谷氨酸受体与精神分裂症[J].中国神经精神疾病杂志,2005,31(3):3-3.
[9]李继涛,苏允爱,杨 阳,等.小剂量 MK-801对大鼠参照记忆,空间工作记忆和逆反学习能力的影响[J].中国神经精神疾病杂志,2011,37(5):261-265.
[10]Chan MK,Guest PC,Levin Y,et al.Converging evidence of blood-based biomarkers for schizophrenia:an update[J].Int Rev Neurobiol,2011,101:95-144.
[11]凌四海,郭实士,杨铁生,等.精神分裂症患者血中 S100b蛋白和抗脑抗体的研究[J].中国神经精神疾病杂志,2005,31(004):278-281.
[12]Simjee SU,Shaheen F,Choudhary MI,et al.Suppression of c-Fos protein and mRNA expression in pentylenetetrazole-induced kindled mouse brain by isoxylitones[J].J Mol Neurosci,2012,47(3):559-570.
[13]Nowak K,Meyza K,Nikolaev E,et al.Local blockade of NMDA receptors in the rat prefrontal cortex increases c-Fos expression in multiple subcortical regions[J].Acta Neurobiol Exp,2012,72:207-218.
