中药组方 NDRF对佐剂性关节炎家兔滑膜 MMP-3、VEGF分子及其mRNA的影响①
2014-11-27谈益芬唐艳丽王胜香郭锦锦孙万邦
谈益芬 唐艳丽 王胜香 郭锦锦 李 均 孙万邦
(遵义医学院珠海校区/贵州省免疫学研究生教育创新基地,珠海519041)
类风湿关节炎(Rheumatoid arthritis,RA)是一种常见的自身免疫性疾病,病因尚不清楚,其主要病变部位在关节滑膜,滑膜细胞类肿瘤样增生、炎性细胞浸润、新生血管生成,进而形成血管翳,造成关节的畸形和功能的丧失[1,2]。近年来有研究提示血管内皮生长因子(Vascular endothelial growth factor,VEGF)、基质金属蛋白酶-3(Matrix metalloproteinase-3,MMP-3)在RA滑膜炎症、血管新生、血管翳的形成及软骨与骨的破坏这一系列过程中可能起到关键性作用。中药组方NDRF是由羌活(Notopterygium incisium Ting)、独活(Doubleteeth pubescent angelica root)、防 风 (Radix sileris)和 木 瓜 (Fructus chaenomelis)为主药,共由14味药组成,主要药理作用为祛风除湿、补气温阳活血,本组方在临床治疗RA患者具有较好的疗效,但缺乏理论依据,为探讨NDRF治疗机制并指导临床应用,本课题组采用此组方及联合甲氨蝶呤(Methotrexate,MTX)对家兔佐剂性关节炎(Adjuvant arthritis,AA)动物模型进行实验性治疗。前期研究表明弗氏佐剂联合TNF-α改良方法造模能提高家兔AA模型成模率,中药组方NDRF及联合MTX能改善AA家兔滑膜组织病理损害,抑制IL-6、IL-8的表达作用[3]。本文通过检测治疗后家兔滑膜组织 MMP-3、VEGF细胞因子及其mRNA的变化,探讨其药物作用及机制,为中药NDRF组方及联合治疗提供理论依据。
1 材料与方法
1.1 实验动物和试剂 清洁级新西兰白兔50只,雌雄各半,体重为(2.30±0.50)kg,由遵义医学院珠海校区实验动物中心提供;弗氏完全佐剂(Complete freund adjuvant,CFA)Sigma公司产品;8%硫化钠脱毛剂(Na2S),本室配制;肿瘤坏死因子(TNF-α)上海近岸蛋白质科技有限公司产品。
1.2 实验药物 甲氨蝶呤由广东岭南制药有限公司提供;中药NDRF组方由羌活、独活、防风和木瓜为主药,包括白芍、威灵仙、伸筋草、白芷、茯苓、土茯苓、丹参、千斤拔、桑枝和川断等14味药组成,由遵义医学院第五附属医院李均博士提供。
1.3 试剂盒及主要仪器 MMP-3、VEGF ELISA检测试剂盒为上海江莱生物制药有限公司产品,酶标仪(ELx-800)为美国Bio-Tek公司产品,ABI Stepone plus型荧光定量PCR仪为美国ABI公司产品,凝胶图像分析系统为PC gene公司产品。
1.4 佐剂性关节炎的诱导及治疗方案 新西兰白兔适应性喂养1周后,足爪剃毛,称体重,在伸直体位测膝关节周径,采用随机抓取的方法分为正常组(8只)和造模组(42只),按文献[3]的方法造模及进行治疗。
1.5 采集滑膜液及滑膜组织标本 家兔处死后立即于膝关节腔内分别注射无菌生理盐水0.3 ml,无菌手术打开关节腔,抽取关节腔内滑膜液0.3 ml,各家兔关节滑膜液分别装入Eppendorf管中,-20℃低温冰箱保存待测细胞因子。抽取关节腔内滑膜液后,打开膝关节腔,用眼科直镊钝性分离关节囊的滑膜层和纤维层,完整剥离滑膜组织完整剪下,分别将所取滑膜组织迅速放入液氮罐中保存。
1.6 ELISA法检测滑膜液MMP-3、VEGF的水平操作按照试剂盒说明书进行,全自动酶标仪450 nm波长依序测量各孔的吸光度(A值),根据标准品的浓度及对应的A值计算出标准曲线的直线回归方程,再根据样品的A值在回归方程上计算出对应的样品浓度。
1.7 RT-qPCR检测MMP-3、VEGF mRNA的表达水平
1.7.1 引物序列(Primer Premier 5.0软件设计)由上海生物工程技术有限公司合成。见表1。
1.7.2 随机取几个样品,加入相应引物及SYBR green I进行预实验,确定反应条件如下:Real-time PCR 20 μl反应体系为 cDNA 1 μl,上游引物 1 μl,下游引物 1 μl,PCR mix 10 μl,ddH2O 7 μl。将反应体系置于Real-time PCR仪上作用,反应条件为预变性95℃,2 min,变性 95℃,10 s,退火、延伸 60℃,40 s,共40个循环;确定合适的PCR循环条件后,每个反应重复三次。观察扩增结果,看Ct值和扩增曲线。用Real-time PCR相对定量的计算方法,计算出2-(△△Ct)以反映目的基因(相对于正常对照组)的表达水平。
1.8 统计学处理 数据分析采用SPSS16.0版软件,所有数据结果均以±s表示,差异显著性采用方差分析(ANOVA)检验,组间两两比较采用t检验,数据间相关性采用pearson检验,P<0.05为差异有统计学意义。
2 结果
2.1 AA家兔滑膜液 MMP-3、VEGF细胞因子检测结果 模型组与正常对照组比较,模型组MMP-3、VEGF细胞因子水平比正常对照组明显增高,差异具有统计学意义(P<0.01);治疗组与模型组比较,三个治疗组MMP-3、VEGF细胞因子水平比模型组均明显降低,差异具有统计学意义(P<0.05);与西药MTX组比较,中药 NDRF组、联合组 MMP-3、VEGF细胞因子水平均低于西药MTX组,差异具有统计学意义(P<0.01);联合组与中药NDRF组比较,联合组MMP-3、VEGF细胞因子水平均低于中药NDRF组,差异具有统计学意义(P<0.05,P<0.01)。结果见表2。
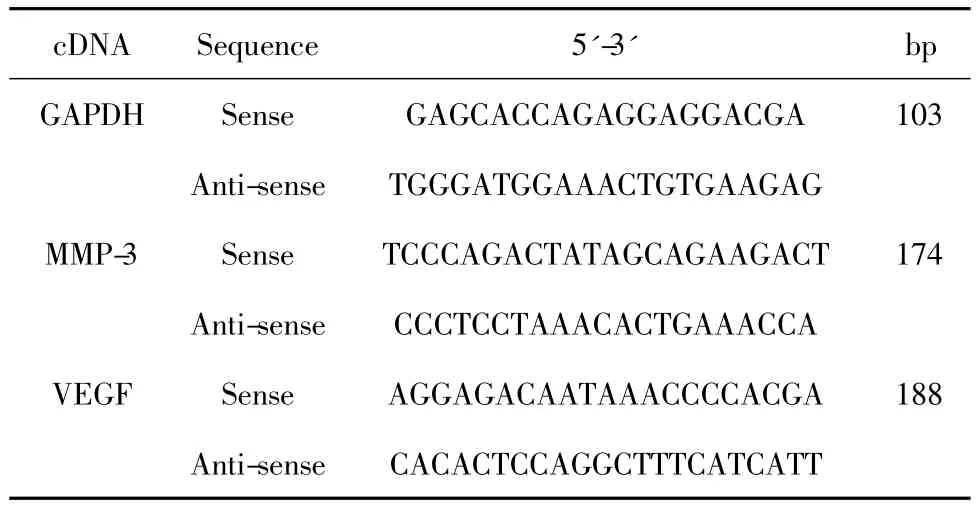
表1 PCR引物序列Tab.1 The primer sequence for GAPDH,MMP-3 and VEGF
表2 AA家兔滑膜液 MMP-3、VEGF细胞因子检测结果(n=8,±s)Tab.2 The MMP-3 and VEGF changes on the AA Rabbits'synovial(n=8,±s)
Note:Compared with Normal control,1)P < 0.01;compared with Model,2)P <0.05,3)P <0.01;compared with MTX,4)P <0.01;compared with NDRF,5)P <0.05,6)P <0.01.
Groups Treatment MMP-3(μg/L) VEGF(ng/L)A Normal control 5.91±0.41 99.79±10.19 B Model 13.39±2.791) 212.00±18.871)C NDRF 7.66±1.203)4) 105.34±14.183)4)D MTX 11.84±0.622) 174.45±35.482)E NDRF+MTX 5.97±0.883)4)5) 85.20±5.683)4)6)
表3 AA家兔滑膜组织MMP-3、VEGFmRNA检测结果(n=8,±s)Tab.3 The MMP-3 mRNA and VEGFmRNA changes on the AA Rabbits'synovial(n=8,±s)
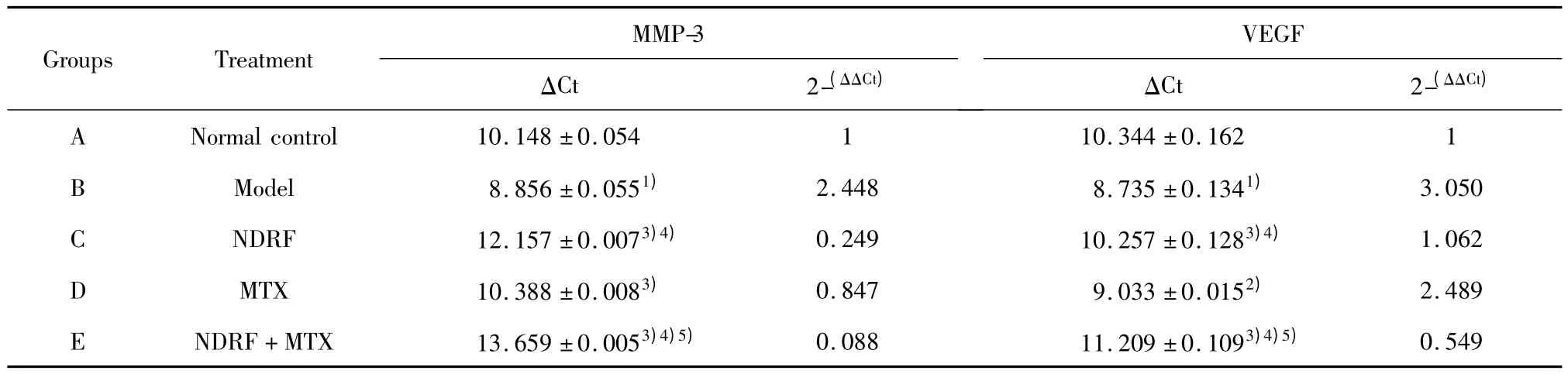
表3 AA家兔滑膜组织MMP-3、VEGFmRNA检测结果(n=8,±s)Tab.3 The MMP-3 mRNA and VEGFmRNA changes on the AA Rabbits'synovial(n=8,±s)
Note:Compared with Normal control,1)P <0.01;compared with Model,2)P <0.05,3)P < 0.01;compared with MTX,4)P <0.01;compared with NDRF,5)P <0.01.
Groups Treatment MMP-3 ΔCt 2-(ΔΔCt)VEGF ΔCt 2-(ΔΔCt)A Normal control 10.148±0.054 1 10.344±0.1621 0.549 B Model 8.856±0.0551) 2.448 8.735±0.1341) 3.050 C NDRF 12.157±0.0073)4) 0.249 10.257±0.1283)4) 1.062 D MTX 10.388±0.0083) 0.847 9.033±0.0152) 2.489 E NDRF+MTX 13.659±0.0053)4)5) 0.088 11.209±0.1093)4)5)
2.2 AA家兔滑膜组织MMP-3 mRNA、VEGF mRNA基因的检测结果 模型组与正常对照组比较,模型组 MMP-3 mRNA(2-(△△Ct)值)、VEGF mRNA(2-(△△Ct)值)明显高于正常对照组,差异具有统计学意义(P<0.01);治疗组与模型组比较,三个治疗组均比模型组明显降低,差异具有统计学意义(P<0.05);与西药MTX组比较,中药NDRF组、联合组均低于西药 MTX组,差异具有统计学意义(P<0.01);联合组与中药NDRF组比较,联合组均低于中药NDRF组,差异具有统计学意义(P<0.01)。结果见表3。
2.3 AA家兔滑膜组织MMP-3与滑膜MMP-3 mRNA水平相关性 AA家兔滑膜组织MMP-3的值分别与滑膜MMP-3 mRNA表达水平的相对定量值进行线性相关统计学分析,相关系数r=0.655,双侧pearson检验P<0.01,有统计学意义,可见AA家兔滑膜组织MMP-3的含量与滑膜MMP-3 mRNA表达水平有密切的相关性,且存在显著正相关关系。
2.4 AA家兔滑膜组织VEGF与滑膜VEGF mRNA水平相关性 AA家兔滑膜组织VEGF的值与滑膜VEGF mRNA表达水平的相对定量值进行线性相关统计学分析,相关系数r=0.905,双侧pearson检验P<0.01,有统计学意义,可见AA家兔滑膜组织VEGF的含量与滑膜VEGF mRNA表达水平有密切的相关性,且存在显著正相关关系。
3 讨论
RA是一种以关节病变为主的慢性多系统炎症性的自身免疫性疾病。RA的基本病理改变是滑膜炎,进而出现滑膜血管增生并伴有大量淋巴细胞浸润形成血管翳,导致关节黏连,最后出现关节软骨和骨组织的破坏等病理改变。有研究表明,过度增生滑膜细胞及滑膜组织中浸润的炎性细胞可能通过分泌大量细胞因子和蛋白酶,参与RA的发病和发展过程[4]。
由于RA病因尚未清楚,临床治疗棘手,目前西药能短期缓解RA炎症,但不能阻止病情的进展,需要长期治疗,由于副作用明显,患者难以坚持治疗;抗TNF-α单抗等生物制剂治疗效果较好,但其价格昂贵,应用受限。由于没有理想治疗药物,中医药治疗的研究成为了近年研究的热点。RA属中医痹证范畴,许多中药方剂具有控制炎症和免疫调节等多方面的作用,且可以长期服药[5]。本研究采用的是李均博士在临床实践中总结的中药NDRF组方,为祛风除湿,补气温阳活血的独创性组方,由羌活、独活、防风和木瓜为主药,主要功效为祛风胜湿,补气温阳活血,散寒止痛,临床上治疗RA具有较好疗效。MTX是临床上较早使用的抗风湿药,其疗效确定,服用方便,价格低廉被认为是治疗RA的金标准,但其胃肠道反应等副作用明显,多数患者难以耐受。为研究中药NDRF组方的药物作用及机制,探索积极有效的治疗方案,本课题组唐艳丽[3]发现中药NDRF及联合MTX治疗AA家兔关节没有明显病理损伤,本研究从致骨关节损伤分子及基因变化方面阐述中药NDRF的作用机制,为其进一步的应用提供理论基础。
近年研究表明血管新生和血管翳的形成在RA的发生发展过程中起了非常重要的作用[6,7]。VEGF是目前已知作用最强的促血管新生的细胞因子,VEGF与其受体(VEGFR)特异性结合,具有促进血管内皮细胞增殖、促进炎症反应和新生血管的形成等多重作用,参与RA的发病机制与病理改变等[8-10]。基质金属蛋白酶(Matrix metalloproteinase,MMPs)是一组在结构上具有极大同源性,能降解细胞外基质蛋白的内肽酶的总称[11]。其中MMP-3属于基质分解素类,是MMPs中导致软骨降解最重要的蛋白酶,可直接降解不同的细胞外基质和基底膜成分,最终导致软骨与骨组织的基质成分的破坏。在RA致病过程中,MMP-3不仅降解细胞外基质和基底膜成分,而且可促进血管翳对软骨的侵蚀,在RA骨与软骨的破坏过程中发挥重要作用。
本研究结果表明,AA家兔模型滑膜组织MMP-3、VEGF细胞因子含量均明显增高,其mRNA的相对含量也明显增高,说明造模成功,同时也表明MMP-3、VEGF在 AA致炎中起重要作用;经中药NDRF及MTX治疗后,三个治疗组滑膜组织MMP-3、VEGF细胞因子含量及其mRNA相对含量均不同程度降低,其中联合组降低最为明显,其次为中药NDRF组、西药 MTX组,提示中药 NDRF可降低MMP-3、VEGF蛋白与基因的表达,且联合MTX的效果更为显著。分析以上结果,可见中药NDRF抑制致炎反应与MMP-3、VEGF的下调相关,为中药NDRF对AA的治疗提供了作用靶点,推测中药NDRF及联合MTX可能通过降低细胞因子VEGF水平,减轻细胞因子对滑膜细胞的刺激,同时减少MMP-3的分泌,从而抑制滑膜细胞的过度增生,抑制血管翳的形成,减轻软骨与骨的破坏,起到阻止关节炎病程进展的作用。通过分析AA家兔滑膜组织MMP-3、VEGF与各自相应mRNA水平相关性发现,二者均具有良好的正相关关系。从机理上讨论,中药NDRF联合MTX可能从基因水平影响MMP-3、VEGF的蛋白表达,这在我们进行家兔X线影像学改变(待发表),药物治疗前后在软组织肿胀、骨侵蚀和关节间隙改变的评分方面看到相同的规律。
综上所述,本研究结果表明 MMP-3、VEGF在AA模型的发病和关节损伤中起着重要作用;中药NDRF可降低AA家兔滑膜组织中MMP-3、VEGF的产生,且联合MTX作用更为明显,说明中药组方NDRF及联合MTX可以减轻炎性细胞浸润,抑制滑膜组织增生,减轻软骨与骨的破坏,对AA家兔模型起到治疗作用,本研究为进一步探讨中药及中西医结合治疗RA的机制提供理论基础。
[1]Szekanecz Z,Koch AE.Angiogenesis and its targeting in rheumatoid arthritis[J].Vascular Pharmacology,2009,51(1):127-129.
[2]桂 环,刘 霞,戴生明.类风湿关节炎滑膜的侵袭性及相关机制[J].中华风湿病学杂志,2010,14(4):278-280.
[3]唐艳丽,孙万邦,邵 予.中药组方羌活、独活、防风及木瓜联合甲氨蝶呤对佐剂性关节炎兔滑膜病理形态及白细胞介素-6、白细胞介素-8 的影响[J].免疫学杂志,2013,29(7):595-600.
[4]Szekanecz Z,Besenyei T,Paragh G,et al.New insights in synovial angiogenesis[J].Joint Bone Spine,2010,77(1):13-19.
[5]李宝丽,唐 方.中药复方对类风湿关节炎抗炎作用的实验研究[J].中国免疫学杂志,2007,23(8):702-708.
[6]Marrelli A,Cipriani P,Liakouli V,et al.Angiogenesis in rheumatoid arthritis:a disease specific process or a common response to chronic inflammation?[J].Autoimmun Rev,2011,10(10):595-598.
[7]Murakami M,Nishimoto N.Inflammatory cytokines in rheumatoid arthritis[J].Clin Calcium,2012,22(11):1737-1746.
[8]Ho Q T,Kuo C J.Vascular endothelial growth factor:Biology and therapeutic applications[J].Biochemistry and Cell Biology,2007,39(7-8):1349-1357.
[9]王立丹,余成新.VEGF在类风湿关节炎血管生成中的作用及其研究进展[J].山东医药,2008,48(20):90-101.
[10]Heard BJ,Martin L,Rattner JB,et al.Matrix metalloproteinase protein expression profiles cannot distinguish between normal and early osteoarthritic synovial fluid[J].BMC Musculoskelet Disord,2012,23(2):126-129.
[11]Shiozawa S,Tsumiyama K,Yoshida K,et al.Pathogenesis of joint destruction in rheumatoid arthritis[J].Arch Immunol Ther Exp,2011,59(2):89-95.
