白芍总苷对实验性变态反应性脑脊髓炎大鼠脑组织IL-17含量影响的研究
2014-11-26陈俊先李作孝
陈俊先,李作孝
多发性硬化(Multiple sclerosis,MS)目前普遍认为是一种自身免疫功能异常的慢性疾病,以中枢神经系统(Central nervous system,CNS)白质炎性脱髓鞘为主要特点。病变可累及脑室周围白质、脑干、小脑、脊髓、视神经等重要部位。MS 的具体发病原因及机制均有待进一步研究。目前更倾向认为MS 的发病机制与自身免疫反应相关。对MS 治疗多采用皮质类固醇激素等免疫抑制剂抑制炎性脱髓鞘反应,起到抗炎和免疫调节的作用。但长期使用不良反应多。故发挥祖国中医学的优势,从中药中发现对MS治疗的有效成分值得进一步研究。白芍总苷(Total glucosidesofpaeony,TGP)是从中药白芍根中提取的复合物,目前临床已用于治疗自身免疫性疾病如类风湿关节炎、干燥综合症、系统性红斑狼疮等。但TGP用于治疗MS 的研究较少。实验性自身免疫性脑脊髓炎(Experimental autoimmune encephalomyelitis,EAE)模型其临床表现与MS 相似,被公认是研究MS 的理想动物模型。本实验通过制作大鼠EAE模型及TGP对发病大鼠的干预治疗,探讨TGP 对EAE 大鼠发病及脑组织IL-17含量的影响。
1 材 料
1.1 实验动物 30只雌性大鼠,7~8周龄,体重180~220g;5 只豚鼠,体重400~450g。由泸州医学院实验动物科提供。饲养均为统一鼠饲料及饮用水。喂养期间保证动物房的通风、清洁及温度。
1.2 主要实验试剂 氟氏完全佐剂(美国Sigma 公司);IL-17 ELISA 试剂盒(深圳晶美生物工程有限公司);白芍总苷胶囊(浙江宁波立华制药有限公司);中性甲醛固定液由病理教研室提供。
2 方 法
2.1 实验动物分组 将统一饲养的30只雌性大鼠随机分为三组,每组10 只,分别为正常对照组、EAE 对照组及TGP治疗组。
2.2 建立EAE 模型[1]处死豚鼠后,无菌操作下快速剥离出其脊髓,去掉马尾与脊膜,称重后放入玻璃均浆器,加入生理盐水研磨成50%匀浆,与等量福氏完全佐剂混合后装入无菌玻璃注射器,并来回推动封好的注射器,反复抽打成油包水乳液,从而制得合格的EAE 造模抗原。分别将所制的抗原以每只每侧0.2ml 的剂量注入EAE 对照组和TGP 治疗组大鼠双后肢足掌皮下。正常对照组注射等剂量生理盐水。
2.3 模型药物干预 成功建立EAE模型后常规饲养各组。从造模当天开始,连续20 天TGP 治疗组每日一次给予TGP180mg/(kg.d)灌胃,正常对照组及EAE对照模型组连续20天每日给予等量生理盐水灌胃。
2.4 实验动物神经功能评分及评分标准 于建模成功后第1天开始,每日上午10时由同一人单盲观察发病情况,对各组大鼠行神经功能障碍评分。评分标准:0 分:无症状;1 分:后肢不全瘫痪;2 分:后肢完全瘫痪;3分:后肢全瘫伴前肢不全瘫;4分:四肢全瘫或死亡;5分:趋于死亡。症状介于两条标准之间者以±0.5分计。得分高说明神经功能受损重。
2.5 确定终止实验时间 将出现连续3 天症状评分无加重、四肢瘫痪、死亡的发病大鼠时间作为EAE发病的高峰期,并在此时处死动物;未发病的动物观察一月后处死。
2.6 大鼠脑组织IL-17含量的测定 实验终止时,每只大鼠用生理盐水灌注心脏后,逐层剥开大鼠枕顶部皮肤,用镊子打开颅盖骨,避免破坏脑组织。将生理盐水与所取出脑组织按9:1的比例制成10%脑组织匀浆,然后采用固相夹心法联免疫吸附实验(ELISA)测定IL-17的含量。
2.7 统计学方法 统计学处理由SPSS 17.0 软件完成。采用均数加减标准差(±s)表示各组实验数据结果,采用t 检验进行两组间样本均数比较,采用LSD检验进行两两比较。
3 结果
3.1 发病情况 正常对照组大鼠精神活动可,体重正常增加。EAE对照组及TGP治疗组发病动物表现为精神差、摄食活动减少、毛色暗淡、体重下降、共济失调、瘫痪等,严重伴大小便失禁、抽搐、死亡等,但TGP治疗组发病较EAE对照组症状轻。EAE对照组和TGP治疗组发病潜伏期、进展期、高峰期症状评分见表1。
表1 各组发病潜伏期、进展期、高峰期症状评分比较(±s)
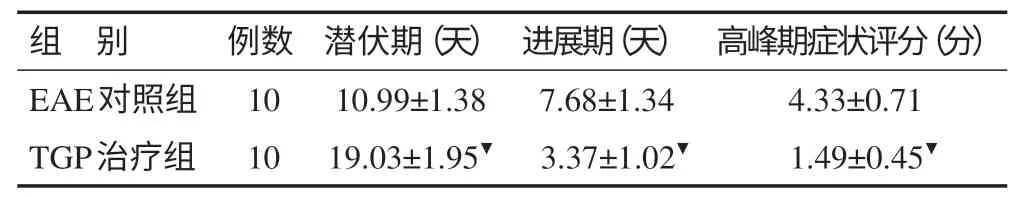
表1 各组发病潜伏期、进展期、高峰期症状评分比较(±s)
注:▼与EAE对照组比较,P<0.01。
3.2 EAE对照组、TGP治疗组及正常对照组大鼠IL-17水平变化,见表2。
表2 各组大鼠脑组织IL-17含量(±s)

表2 各组大鼠脑组织IL-17含量(±s)
注:▼与正常对照组比较,P<0.01;★与EAE 对照组比较,P<0.01。
从表2结果可以看出:EAE对照组和TGP治疗组IL-17含量均高于正常对照组,差异具有统计学意义;EAE对照组和TGP治疗组比较,TGP治疗组IL-17含量明显降低,差异具有统计学意义。
4 讨论
目前认为MS是自身免疫性疾病,而细胞因子是在免疫系统疾病免疫应答中起重要作用。目前研究认 为TCD4+Th 细胞亚群主要分3 类:Th1、Th2、Th17。Th1 型细胞因子与EAE 发病相关,包括IL-1、IL-2、IL-6、TNF-α、INF-γ等;Th2 型细胞因子可抑制EAE 的发病,包括IL-10、IL-4 等。新发现的Th17 型细胞因子主要产生IL-17,IL-17是有很强促炎作用的细胞因子。IL-17 作为炎症介质参与炎症反应、自身免疫性疾病的发生和发展[2],可以刺激靶细胞释放炎症细胞因子及动员中性粒细胞发挥作用,诱导IL-6、PGE2、NO 的产生,上调TNF-a、INF-r 的基因表达致炎症进展。IL-17还可以提高CXC趋化因子表达,上调共刺激分子、主要组织相容复合物抗原等促进DC成熟,协同刺激T 细胞的活化;可通过信号转导促进各因子的转录及蛋白合成。IFN-γ可在靶组织中持续较长时间,IL-17 峰在EAE 模型中出现在IFN-γ之前,因此IL-17、IFN-γ可能在诱导自身免疫性疾病中起协同作用[3]。EAE大鼠体内产生IL-17炎性细胞因子参与髓鞘破坏,直接作用内皮细胞破坏血脑屏障而进入中枢神经系统导致进一步脱髓鞘改变,引起EAE 病情加重。Th17 细胞在EAE 发病中也有不可或缺的作用。
白芍总苷(total glucosides of paeony,TGP)是从中药白芍根中提取的复合物,其主要活性成分为芍药苷。具有免疫调节、抗炎、镇痛镇静、保护脑缺血等作用。近期也有一些关于TGP 针对IL-17 治疗相关疾病的研究报道。其中任晓丽等[4]研究发现慢性荨麻疹患者的血清中存在高水平的IL-4和IL-17。TGP可能通过影响Th2、Th17细胞相关因子来发挥治疗慢性荨麻疹的作用,经TGP 治疗后其血清中IL-4 和IL-17明显降低。贺勤等[5]研究发现TGP 能降低银屑病皮损中IL-17的含量。TGP其对银屑病的治疗作用可能涉及对患者皮肤Th17细胞的影响。张宇虹等[6]研究发现TGP 可治疗银屑病。其机制可能与通过调节Th17细胞相关细胞因子IL-17和IL-23发挥治疗银屑病作用。刘国玲等[7]研究发现TGP能抑制佐剂关节炎大鼠的炎症反应。其作用机制可能是TGP可降低炎性细胞因子IL-17 和血清VEGF 的产生,下调NFκB/p65蛋白的表达,最终抑制炎性细胞浸润及血管增生。综上可以得出TGP可以通过下调Th17细胞相关细胞因子IL-17 水平减轻炎症反应,缓解相关症状有着重要作用。
目前国内多将白芍总苷用于治疗类风湿关节炎、干燥综合征、系统性红斑狼疮、强直性脊柱炎、糖尿病肾病、银屑病等。而鲜有TGP用于EAE和MS方面的报道。而TGP对MS是否具有预防治疗作用,同时对EAE 和MS 中IL-17 含量是否有影响,朱骏[8]观察了TGP主要的药物活性成分芍药苷(pae oniflori,PF)对MOG EAE 小鼠模型的神经保护作用及其机制。研究结果发现PF 在MOG EAE小鼠模型中能够缓解炎性脱髓鞘过程,改善临床症状。机制与上调抑制性细胞因子、下调致炎性细胞因子、减低淋巴细胞增殖反应、上调CD4+CD25+调节性T 细胞、激动A1AR 而抑制神经炎性反应和发挥神经保护作用相关。
本实验数据分析提示正常对照组大鼠未发病,EAE 对照组大鼠均出现不同程度的EAE 症状,故造模成功。通过各组大鼠的发病症状比较及对各组大鼠脑组织IL-17 含量测定可以得出以下结论:正常对照组大鼠脑组织匀浆中IL-17 的含量未升高,EAE 对照组、TGP 治疗组大鼠脑组织匀浆中IL-17 的含量均明显升高;TGP治疗组大鼠发病晚、病情轻,脑组织匀浆中IL-17的含量也较EAE对照组低。说明IL-17有促进EAE 作用,抗IL-17 抗体能防止IL-17 在脑内的表达和EAE 的发生[9]。TGP 治疗组大鼠的脑组织匀浆中IL-17的含量下降,则大鼠的EAE症状可得到明显缓解。故对EAE具有明显的保护作用。说明TGP可通过降低EAE 大鼠脑组织中的IL-17 水平来起到抑制EAE的作用。
Th17 型细胞因子主要产生IL-17,IL-17 对EAE发病起促进作用,故下调抑制IL-17分泌可对EAE起到防治作用。虽然TGP 在治疗MS 还处于EAE 的实验研究阶段,但随着对其治疗机制及MS病因的深入研究。发挥TGP其抑制Th17型细胞因子等作用可能是MS临床治疗的一种新的选择和方向。
[1]董梅,刘瑞春,郭力,等.Wistar大鼠实验性变态反应性脑脊髓炎的模型建立[J].脑与神经疾病杂志,2004,12(6):425-428.
[2]Marcal JR,Samuel RO,Fernandes D,et al.T-helper cell type 17/regulatory T-cell immunoregulatory balance in human radicular cysts and periapical granulomas[J].J Endod,2010,36(6):995-999.
[3]Pahan K.Neuro immune pharmacological control of EAE[J].J Neuro immune Pharmacol,2010,5(2):165-167.
[4]任晓丽,苏振兴.白芍总苷对慢性荨麻疹患者血清中IFNγ、IL-4 和IL-17 的影响[J].中国伤残医学,2012,11(2):42-44.
[5]贺勤,李慎秋.白芍总苷对寻常型银屑病患者皮损IL-17表达的影响[J].医学导报,2012,7(7):898-900.
[6]张宇虹,郭在培.白芍总苷对轻、中度寻常性银屑病患者血清中IL-17 和IL-23 的影响[J].中国皮肤性病学杂志,2012,26(5):391-392.
[7]刘国玲,张玉霞.白芍总苷对大鼠佐剂关节炎抗炎作用及机制研究[J].现代预防医学,2012,39(20):5348-5350.
[8]朱骏.芍药甙在MOG EAE 小鼠模型中的神经保护作用及其机制的研究[D].上海:复旦大学,2007.
[9]Moqi M,Harada M,Riedererp P,et al.Tumor necrosis Factoralpha(TNF-alpha)increases both in the brain and in thecerebro spinal fluid fromparkinsonian patients.[J].Neurosci.Lett,1994,165(1-2):208-210.
