HP感染后TGF-β1及NF-κB蛋白在胃癌组织中的表达
2014-11-25柳兴源孟海
柳兴源,孟海
(1.辽宁医学院基础医学院;2.辽宁医学院附属第一医院病理科,辽宁 锦州 121000)
有研究显示,胃癌的发生同幽门螺杆菌(HP)的感染在流行病学上有诸多的相关性[1]。但HP 感染在胃癌发生中的确切机制尚不清楚。本研究采用组织化学和免疫组织化学等方法,探讨HP 感染后胃组织癌变发生的可能的分子生物学机制。
1 临床资料与方法
1.1 研究对象
以辽宁医学院附属第一医院2010—2013 年间113 例手术胃癌切除标本为研究对象进行临床病理学研究,并从本医院2006—2010 年病理档案中随机抽取HP 相关性胃炎活检标本57 例作正常对照。所有研究对象标本均由本医院主治医师以上人员采用双盲法进行HE 染色切片复读确认。全部标本均经过10%福尔马林固定,石蜡包埋,作3 μm 厚连续切片,以备本研究所用。
1.2 实验方法
1.2.1 改良Giemsa 染色 (1)石蜡切片装入染色架,70 ℃烤片8~10 min;(2)二甲苯中脱蜡3~6 min,重复2 次;(3)依次通过100%,95%,90%,80%,70%乙醇溶液各5 min,入自来水,冲洗约5 min,至切片清晰;(4)直接入3%Giemsa 染液中染色25~30 min;(5)自来水洗去染液;(6)直接入100%乙醇中脱水;(7)常规脱水、透明、封片;(8)室温观察。
参与本实验共113 例胃癌组织,应用组织学改良Giemsa 染色检测HP 感染,试剂变为红色者为阳性,不变色者为阴性。57 例慢性胃炎组织,应用组织学改良Giemsa 染色检测HP 感染,试剂变为红色者为阳性,不变色者为阴性。根据文献,HP 阳性的判定方法为:改良Giemsa 染色是阳性者为HP 感染阳性,是阴性者判定为HP 感染阴性。
1.3 免疫组织化学染色
一抗分别为鼠抗人TGF-β1 和NF-κB,稀释度均为1∶100。组织切片常规脱蜡至水,柠檬酸热抗原修复,SP 法操作,DAB 显色。用已知阳性片作为阳性对照,PBS 代替一抗作阴性对照。光学显微镜下观察组织切片的显色反应,选择5 个以上的高倍镜视野(×200)不少于1 000 个细胞进行计数。以磷酸盐缓冲液(PBS)代替一抗作阴性对照,用己知阳性切片作阳性对照。
免疫组化结果判定方法:TGF-β1 蛋白在胃癌组织中主要分布于细胞浆及细胞核[2],呈棕灰黄色颗粒状,按照细胞的染色比例分级方法进行结果判断,以细胞核染色为阳性计数标准进行统计。细胞浆染色忽略,核染色>50% (+++),核染色(++),核染色<10% (+),未着色(-),认定前2 个等级为阴性表达,后2 个等级为阳性表达。
NF-κB 蛋白在胃癌组织中除主要表达在胞浆外,尚可见部分胞核转位。染色程度评分可按如下标准:着色深为2 分,着色淡为1 分,基本不着色为0 分。染色细胞百分率评分可按如下标准:着色细胞数比视野中计数细胞数的百分率,76%~100%为4 分,51%~75%为3 分,26%~50%为2分,6%~25%为1 分,0~5%为0 分,将每张切片染色程度得分与染色细胞百分率得分相加的和为最后得分,>7 分为强阳性(+++),5~6 分为中等阳性(++),3~4 分为弱阳性(+),0~2分为(-)认定后1 个等级为阴性。
1.4 统计学方法
用SPSS19.0 统计软件包进行统计学分析,结果分析采用t 检验、χ2检验和精确概率法。
2 结 果
2.1 HP 的检测结果
结果发现,在胃癌组中HP 阳性者88 例,HP阴性者25 例,感染率为77.9%。在慢性胃炎组中HP 阳性者29 例,HP 阴性者28 例。感染率为50.9%。胃癌组织中的HP 感染率明显高于慢性胃炎组,(χ2=12.87,P <0.01,见表1)。
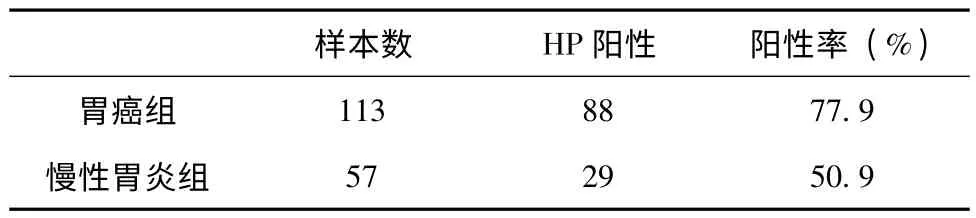
表1 胃癌组织和慢性胃炎组织的HP 感染情况比较
2.2 HP 感染与胃癌组织临床病理特征之间的关系
由表3 可见,胃癌患者的肿瘤部位、大小、远处转移、分化程度、有无淋巴结转移与HP 感染无相关性(P >0.05),而与胃癌组织浸润深度有关。浸润至肌层的胃癌组织HP 感染率为71.0%,浸润至浆膜面的胃癌组织HP 感染率为88.6%,浸润至肌层的胃癌组织HP 感染率明显低于浸润至浆膜面的胃癌组织HP 感染率,(χ2=4.84,P <0.05)。
2.3 免疫组织化学检测结果
2.3.1 TGF-β1 蛋白在HP (+)和HP (-)胃癌组织中表达 TGF-β1 蛋白在胃癌组织中主要分布于细胞浆及细胞核,呈棕灰黄色颗粒状,按照细胞的染色比例分级方法进行结果判断,以细胞核染色为阳性计数标准进行统计。结果表明TGF-β1 蛋白在HP+和HP-胃癌组织中的阳性表达率分别为76.1%和52.0%,(χ2=5.49,P <0.05,见表4)。
2.3.2 NF-κB 蛋白在HP (+)和HP (-)胃癌组织中表达 NF-κB 蛋白在胃癌组织中除主要表达在胞浆外,尚可见部分胞核转位。根据染色程度评分进行统计,结果表明NF-κB 蛋白在HP(+)和HP (-)胃癌组织中的阳性表达率分别为62.5%和40.0%,(χ2=4.03,P <0.05,见表5)。
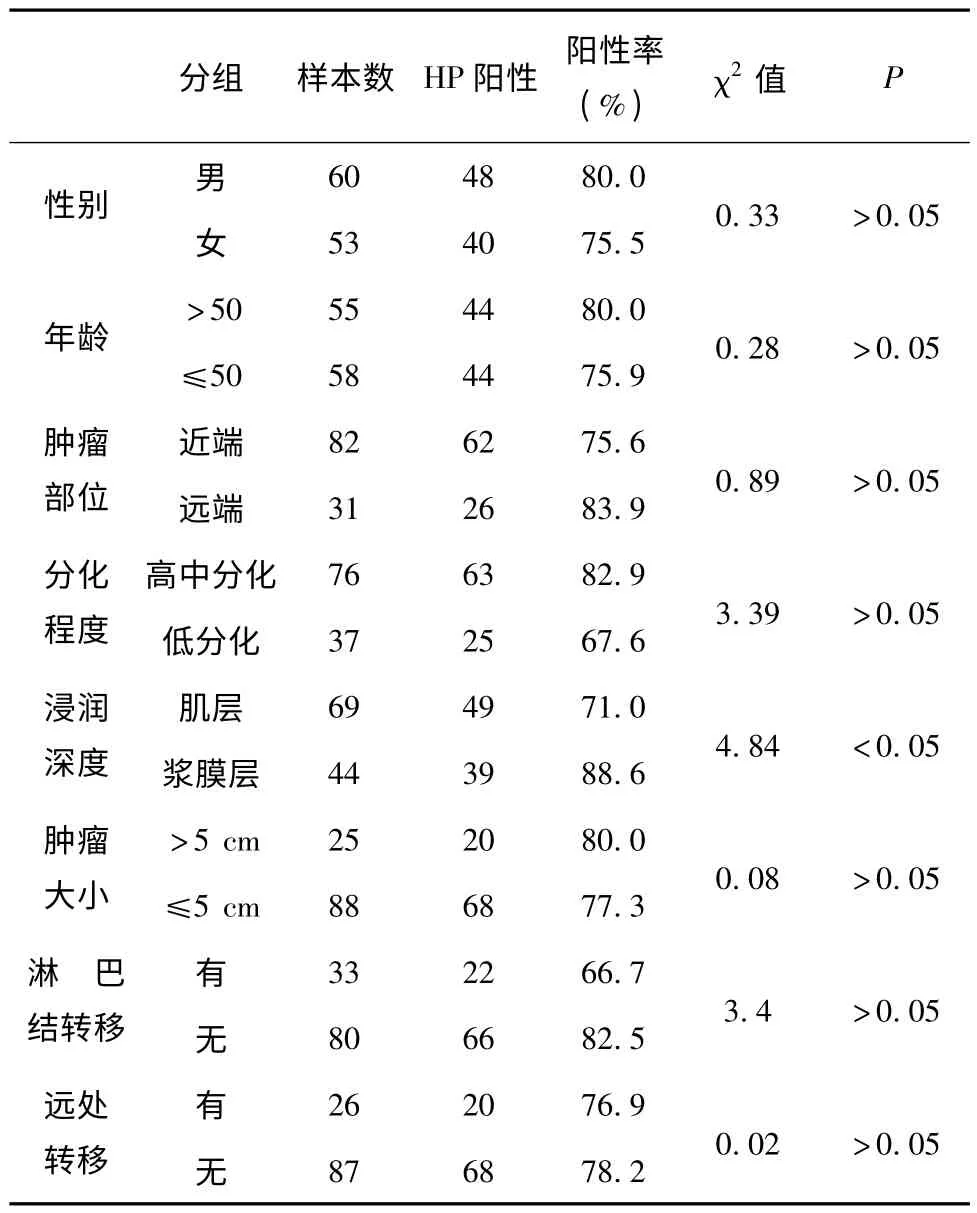
表2 HP 感染与胃癌组织临床病理特征之间的关系
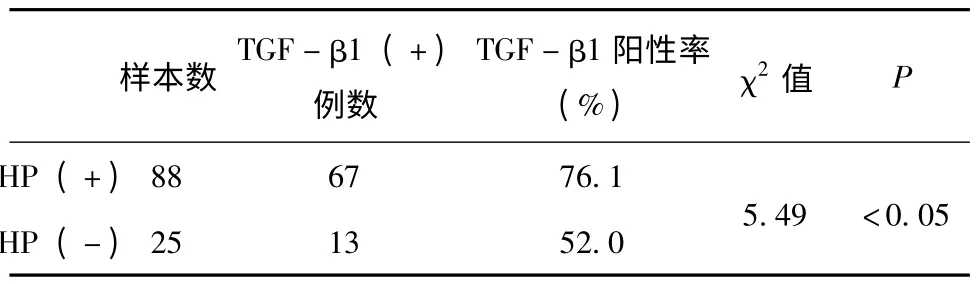
表3 TGF-β1 蛋白在胃癌组织HP (+)组和HP (-)组的阳性表达情况
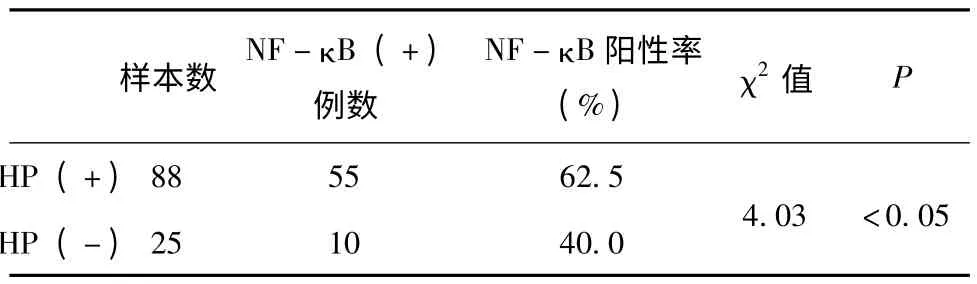
表4 NF-κB 蛋白在胃癌组织HP (+)组和HP (-)组的阳性表达情况
3 讨 论
胃癌是一种常见的消化道恶性肿瘤,目前我国胃癌患者数量呈持续增加趋势[3]。HP 感染是胃癌发生的主要诱发条件,被认为是癌变的前体状态。在本研究中胃癌组中HP 阳性者88 例,HP 阴性者25 例,感染率为77.9%;在慢性胃炎组中HP 阳性者29 例,HP 阴性者28 例,感染率为50.9%。胃癌组织中的HP 感染率明显高于慢性胃炎组。(χ2=12.87,P <0.01)这个结果显示,在HP 在胃癌的发生发展中可能起到了重要作用。
本研究针对HP 感染与胃癌患者性别、年龄、肿瘤部位、大小、分化程度、远处转移、有无淋巴结转移以及胃癌组织浸润深度的相关性进行了统计。结果发现,胃癌患者的肿瘤部位、大小、远处转移、分化程度、有无淋巴结转移与HP 感染无相关性(P >0.05),而与胃癌组织浸润深度有关。浸润至肌层的胃癌组织HP 感染率明显低于浸润至浆膜面的胃癌组织HP 感染率。(χ2=4.84,P <0.05)这个结果可能与HP 本身的性质有关。HP是一种革兰阴性微需氧菌,一般定植在胃上皮细胞表面,具有良好的动力及粘附功能。HP 菌株可引起慢性胃炎、萎缩性胃炎、肠上皮化生、胃粘膜糜烂及胃溃疡,长期感染浸润较深者胃癌发生率较高。来自人体的主要阻止肿瘤浸润、恶化和转移的壁垒是基底膜和细胞外基质(ECM),降解ECM和基底膜的能力是肿瘤的侵袭和转移首要条件[4]。HP 感染后分泌多种酶类降解ECM 和基底膜的胶原,促使细胞侵袭相邻结缔组织进入血管和淋巴管,最后继发组织器官扩展性生长。
TGF 是一类具有转化作用的多肽类生长因子超家族,它能够调节细胞增殖,分化,形态形成及刺激ECM 分泌,抑制免疫反应[5]。TGF-β 使肿瘤细胞免疫逃避,肿瘤细胞增殖加快。TGF-βl 是TGF-β 家族的主要成员之一,是调节正常细胞生长发育分化等功能的主要因子。近年来有学者报道,TGF-βl 与胃癌、前列腺癌、乳腺癌、结直肠癌的发生、发展有关。在多种恶性肿瘤中呈过表达状态,TGF-βl 的过度表达在肿瘤浸润、恶化和转移中起到重要的作用并与肿瘤预后密切相关[6]。对正常细胞,TGF-βl 可看作一种抑癌因子,通过其信号通路使细胞停止在Gl 期抑制细胞增殖。但当细胞恶变时,TGF-βl 信号通路发生改变,TGF-βRl (TGF-βl 受体)发生改变,下游smdas 蛋白表达发生变化,导致细胞对TGF-βl 不敏感。在肿瘤的早期阶段,TGF-βl 对肿瘤的早期发展有抑制作用;在肿瘤的发展阶段,TGF-βl 的抑制增殖作用消失,细胞出现优势生长;在肿瘤的晚期阶段,TGF-βl 对肿瘤的晚期发展有促进作用,通过细胞播散、刺激血管生成、免疫抑制、合成ECM等途径,提供适宜于肿瘤生长浸润、恶化和转移的细胞环境[7]。本实验发现,结果表明TGF-β1 蛋白在HP (+)和HP (-)胃癌组织中的阳性表达率分别为76.1% 和52.0% (χ2=5.49,P <0.05)。HP 感染后,TGF-β1 对肿瘤的发展有促进作用。另外还有学者认为胃癌细胞产生的TGFβ 能刺激成纤维母细胞增殖,而使胃壁僵硬,形成所谓的“皮革胃”[8]。
近年研究发现,当核转录因子NF-κB 的调节紊乱是许多肿瘤的发生的重要原因,在癌症组织中NF-κB 的过表达可能是肿瘤细胞能够产生凋亡作用的主要途径[9]。当NF-κB 通道激活后,可以产生较强的抗凋亡信号因子,从而产生促进肿瘤的发展的作用。本研究结果表明NF-κB 蛋白在HP +和HP-胃癌组织中的阳性表达率分别为62.5%和40.0%。(χ2=4.03,P <0.05)HP 感染后,胃粘膜形成胃炎后可通过多种信号传导途径激活NF-κB,NF-κB 具有调节细胞基因转录及信号传导等功能,可进一步激活其下游靶基因促进胃癌的形成。已有许多研究示,HP 的感染与NF-κB 蛋白的高表达有密切的关联[10]。
本研究提示HP 感染后可能通过TGF-β 及NF-κB 两条通路调节细胞基因转录及信号传导在胃癌的浸润、恶化和转移过程中起重要作用。TGF-β 及NF-κB 通路可能成为判断胃癌的重要指标。检测TGF-β 及NF-κB 联合表达可以更进一步的了解肿瘤发生的分子生物学和细胞生物学行为从而解释肿瘤浸润、恶化和转移的机制。同时也提供了一个新的胃癌靶点,为研究新的抗肿瘤药物奠定了理论基础。
[1]Chung WC,Jung SH,Joo KR,et al.An Inverse Relationship between the Expression of the Gastric Tumor Suppressor RUNX3 and Infection with Helicobacter pylori in Gastric Epithelial Dysplasia [J].Gut Liver,2013,7 (6):688-695.
[2]纪雪松,赵春歌,潘彦珞,等.NF-κB 及其对靶基因的调控在幽门螺杆菌感染与胃癌发生的关系初探[J].华北煤炭医学院学报,2008,10 (2):144-146.
[3]冯水土,陈玉强,陈毅德,等.NF-κB 在幽门螺杆菌阳性和阴性胃癌中的[J].中国肿瘤临床,2012,39 (21):1626-1629.
[4]Vinagre RM,Vilar-E-Silva A,Fecury AA.Role of helicobacter pylori infection and lifestyle habits in the development of gastroduodenal diseases in a population from the brazilian Amazon[J].Arq Gastroenterol,2013,50 (3):170-174.
[5]宋国庆,王强.RCK,MMP-9 及TGF-β1 在胃癌组织中的表达及其相互关系[J].世界华人消化杂志,2007,15(15):1731-1737.
[6]李乐平,靖昌庆,刘洪俊,等.TGF-β 及其伙伴分子Smad4 在胃癌组织中的表达[J].中国现代普通外科进展,2007,10 (3):194-197.
[7]蔡跃芳,张明亮,严悦卿,等.胃癌中COX-2 及NF-κB的表达与其病理特征的关系[J].中国现代医学杂志,2005,15 (12):1830-1833.
[8]李子红,潘宏铭,汤元兴,等.NF-κB 表达与胃癌的相关性研究[J].浙江临床医学,2006,8 (2):114-115.
[9]刘正新,陈宝雯,柳平,等.PCNA、EGFR、TGF-βRI、TGF-βRI 在胃癌组织中表达的临床意义[J].中国肿瘤临床,2005,32 (7):378-381.
[10]Krebes J,Morgan RD,Bunk B,et al.The complex methylome of the human gastric pathogen Helicobacter pylori [J].Nucleic Acids Res,2013,41 (22):62-69.
