猪附红细胞体阳性血清的制备研究
2014-11-24贾杏林朱珍珍李晓云
周 伟,刘 凡,贾杏林,唐 丽,朱珍珍,李晓云
(湖南农业大学动物医学院,湖南长沙 410128)
猪附红细胞体阳性血清的制备研究
周 伟,刘 凡,贾杏林※,唐 丽,朱珍珍,李晓云
(湖南农业大学动物医学院,湖南长沙 410128)
猪附红细胞体寄生于红细胞表面或游离于血浆、组织液及脑脊液中,引起猪发热、溶血性贫血和黄疽等主要症状。本试验用猪附红细胞体抗原和弗氏佐剂乳化制备免疫原,免疫健康仔猪,并通过酶联免疫吸附试验(ELISA)检测血清的效价,当测得免疫猪血清的OD值与阴性对照猪的血清值之比(P/N)为8.16(P/N>2.1),采集免疫猪血分离阳性血清,本试验探索出了猪附红细胞体阳性血清的制备方法。
猪附红细胞体;阳性血清;免疫;ELISA
猪附红细胞体病是由附红细胞体(Mycoplasma suis)寄生于红细胞表面或者血浆,组织液,脑脊液和骨髓中引起的一种疾病[1]。该病临床症状表现为贫血、黄疸、发热、毛产量及乳、肉产量减少、生育力下降,而且还引起较重的临床表现及死亡等主要症状[2]。1932年,Doyle首次报道了猪附红体病,
并认为其病原体是类立克次体,其病原体的形态结构也尚未完全研究清楚,也没有有效可用的疫苗[3~5]。迄今为止,世界近30多个国家和地区发现该病的发生,我国已有22个省、市、自治区陆续报道了此病,对养猪业造成严重危害[6~8]。免疫血清在疾病的紧急预防、治疗、疾病诊断和病原鉴定方面有很大的作用[9],本研究进行了猪附红细胞体阳性血清的制备研究。
1 材料和方法
1.1 试验仪器和试剂
仪器设备:微量分光光度计(Thermo NANO DROP 2000)、酶标仪、无菌操作台、高速离心机、高压灭菌锅。
试剂:弗氏完全佐剂、TMB购自Sigma公司;酶标二抗(1∶1 000)购自索莱宝公司。
试验动物:健康仔猪A 5.34kg,健康仔猪B 5.80kg,购自长沙县某规模猪场。猪附红细胞体抗原由湖南农业大学动物医学院李晓云博士等人提供。
2 试验内容
2.1 抗原乳化
在无菌条件下取出的抗原溶液,12 000r/min离心约10min,弃上清液,加一定的无菌生理盐水离心洗涤2次后,加入一定量的无菌生理盐水悬浮抗原,用微量分光光度计A260/A280测定蛋白浓度,将抗原溶液稀释到8.333mg/mL,加等量的弗氏完全佐剂乳化,使抗原溶液乳化均匀。
2.2 免疫
无菌取1.5mL的猪附红细胞体12 000r/min离心10min,弃掉上清液后,加入等量的生理盐水重悬猪附红细胞体,多次洗涤以后,再加入等体积弗氏佐剂均匀混合。利用磁力搅拌器使得猪附红细胞体悬液、弗氏佐剂乳化均匀,抗原含量为4.38×108/mL。在饲喂7d后,观察仔猪的精神状态、测定其体温、呼吸、脉搏等生理指标,确定仔猪健康后采用肌肉注射的方式对仔猪进行多点免疫,首免后7d加免1次、加免后15d再加免1次,首免后每天测定体温,以后隔3d测体温,并观察仔猪的精神状态和食欲情况,前腔静脉采血,分离血清4℃保存,用行ELISA检测血清中的抗体水平变化,当抗体达到较高值时,心脏采血,分离到的血清即为阳性血清,-20℃保存备用。
2.3 间接ELISA检测抗体
通过方阵试验,当抗原浓度为80μg/mL,血清1∶40倍稀释时P/N值最大,所以选择该条件为最佳抗原,以最佳抗原浓度包被抗原,4℃过夜,用1%BSA封闭,加入1∶40稀释后的血清,作用一定时间后加入1∶1 000稀释的酶标二抗,37℃作用45min,洗涤 5 次后,加 TMB,37℃显色 15min,用酶标仪测定波长450nm的吸光值。
2.4 动物免疫后生理状况以及抗体消长情况
测定各阶段的体温,并观察其生理状况变化。按照上述确定的最佳包被浓度和血清稀释倍数后进行ELISA对免疫后的血清进行检测,观察在不同的免疫时间后的抗体水平的变化。
2 试验内容
2.1 抗原乳化
在无菌条件下取出的抗原溶液,12 000r/min离心约10min,弃上清液,加一定的无菌生理盐水离心洗涤2次后,加入一定量的无菌生理盐水悬浮抗原,用微量分光光度计A260/A280测定蛋白浓度,将抗原溶液稀释到8.333mg/mL,加等量的弗氏佐剂乳化,使抗原溶液乳化均匀。
2.2 免疫
无菌取1.5mL的猪附红细胞体12 000r/min离心10min,弃掉上清液后,加入等量的生理盐水重悬附红细胞体,多次洗涤以后,再加入等体积弗氏佐剂均匀混合。利用磁力搅拌器使得猪附红细胞体悬液、弗氏佐剂乳化均匀,抗原含量为4.38×108/mL。在饲喂7d后,观察小猪的精神状态、测定其体温、呼吸、脉搏等生理指标,确定小猪健康后,采用肌肉注射的方式对小猪进行多点免疫,首免后7d、15d加免2次,首免后每天测定体温,以后隔3d测体温,并观察小猪的精神状态和食欲情况,前腔静脉采血,分离血清4℃保存,用行ELISA检测血清中的抗体水平变化,当抗体达到稳定时,心脏采血,分离到的血清即为阳性血清,-20℃保存备用。
2.3 间接ELISA检测抗体
通过方阵试验,当抗原浓度为80μg/mL,血清1∶40倍稀释时P/N值最大,所以选择该条件为最佳抗原,以最佳抗原浓度包被抗原,4℃过夜,用1%BSA封闭,加入1∶40稀释后的血清,作用一定时间后加入1∶1 000稀释的酶标二抗,37℃作用45min,洗涤 5 次后,加 TMB,37℃显色 15min,用酶标仪测定波长450nm的吸光值。
2.4 动物免疫后生理状况以及抗体消长情况
测定各阶段的体温,并观察其生理状况变化。按照上述确定的最佳包被浓度和血清稀释倍数后进行ELISA对免疫后的血清进行检测,观察在不同的免疫时间后的抗体水平的变化。
3 试验结果
3.1 猪附红细胞体免疫后体温变化
观察小猪精神状态和饮食情况正常,进行免疫后呼吸和脉搏均处于正常范围内。第1次免疫后小猪的体温略升高,但在正常范围内波动,以后几次免疫后小猪的体温无变化。由图1可知,第1次免疫后猪的体温变化不大。

3.2 脉搏和呼吸
进行免疫后呼吸和脉搏均处于正常范围内。
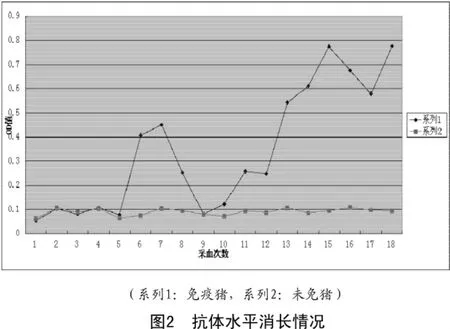
3.3 抗体水平消长
由图2可知,免疫后每隔3d对猪采血分离血清,第1次免疫后,免疫猪和未免猪血清的OD值变化不大且值比较小,7d再免疫一次后,注射抗原免疫猪血清的OD值升高,第2次免疫后15d再免疫一次,免疫猪的抗体OD值逐渐达到较高的水平,对照猪血清的OD值变化不大。通过酶联免疫吸附试验(ELISA)检测血清的效价,当测得免疫猪血清的OD值与阴性对照猪的血清值之比(P/N)为7.76(P/N>2.1),采集免疫猪血分离阳性血清。
4 讨论
猪附红细胞体免疫猪后体液免疫水平和临床指标变化影响疫苗的研究,研究体液免疫也可以为该病的控制提供依据,本研究中免疫后猪体温变化不大,提示该免疫反应很少伴随发热反应。本次试验通过多次免疫,重复采样,用ELISA方法检测OD值,与对照进行比较,当免疫猪血清的OD值与阴性对照猪的血清值之比(P/N)为8.16(P/N>2.1时,采血制备出了免疫血清,该血清可以为猪附红细胞体胶体金试纸的研制和ELISA试剂盒的研制提供阳性血清,也可用于猪附红细胞体黏附阻抑的研究。本研究也表明用灭活抗原免疫猪后可以产生体液免疫反应,这为猪附红细胞体灭活疫苗的研制提供了前期参考。
[1] 李晓云,贾杏林,石德时,等.猪附红细胞体的体外连续培养[J].畜牧兽医学报,2008,39(8):1142-1146.
[2] 舍 英,杜跃峰,侯金凤,等.附红细胞体病的研究现状[J].中国人兽共患病杂志,1995,(1):49-50.
[3] Doyle,L.P.A rickettsia-like or anaplasmosis-like disease in swine[J].J Am Vet Ass,1932,(8):668-671.
[4] Schilling V.Eperythrozoon coccoides,eine neue durch Splenektomie aktivierbare Dauerinfektion der weissen Maus[J].Kiln Wochenschr,1928:1854-1855.
[5] 唐 丽,李晓云,贾杏林.猪附红细胞体分子生物学研究进展[J].中国畜牧兽医,2013,40(7):81-83.
[6] 贾杏林,张武林,李晓云.猪附红细胞体致病机理的研究进展[J].中国畜牧兽医,2010,37(5):149-151.
[7] 唐 丽,夏雨婷,贾杏林,等.兔抗猪附红细胞体阳性血清的制备研究[J].湖南畜牧兽医,2014,(1):13-14.
[8] 刘芳宁,杨增岐,张淑霞.附红细胞体病病原学研究概况[J].动物医学进展,2003,24(3):31-34.
[9] 王占伟,邵国青,陈笑娟.动物抗血清及其制备技术要点与应用进展[J].江西农业学报,2009,21(7):149-152.
S855.9
A
1006-4907(2014)05-0019-03
10.3969/j.issn.1006-4907.2014.05.009
湖南农业大学研究性学习和创新性试验计划项目(XCX13110)。
周 伟(1991~),男,湖北洪湖人,在读本科生。※通讯作者:贾杏林(1970~),男,教授,研究领域为动物输血与血液病,E-mail:jxl1709@yahoo.com.cn。
2014-08-15
