基于不同烟碱转化株鉴别标准的白肋烟品种改良效果
2014-11-24孙红恋周海燕王瑞云宋莹丽孙军伟王新中轩书章史宏志
孙红恋,周海燕,王瑞云,宋莹丽,孙军伟,王新中,轩书章,史宏志
1 河南农业大学烟草学院/国家烟草栽培生理生化研究基地,郑州,450002;
2云南省烟草公司大理州公司,云南,大理671000;
3云南烟草宾川白肋烟有限责任公司,云南,宾川671600
基于不同烟碱转化株鉴别标准的白肋烟品种改良效果
孙红恋1,周海燕1,王瑞云1,宋莹丽1,孙军伟2,王新中2,轩书章3,史宏志1
1 河南农业大学烟草学院/国家烟草栽培生理生化研究基地,郑州,450002;
2云南省烟草公司大理州公司,云南,大理671000;
3云南烟草宾川白肋烟有限责任公司,云南,宾川671600
为明确不同转化株鉴别标准的科学性,探讨基于不同转化株鉴别标准的白肋烟品种改良效果。在采用不同烟碱转化株鉴别标准对TN86进行改良的基础上,对不同改良种的烟叶经济性状、烟碱转化率和TSNAs含量进行比较分析。结果表明,以烟碱转化率低于2.5%作为选择标准得到的改良种1(PNC<2.5)烟碱转化率稳定,上部叶比常规种低37.7%,中部叶低38.3%;总TSNAs含量低,比常规种低17.9%;产量、产值及上中等烟比例也明显优于其他改良种,且后代变异系数最小。改良种2(PNC<3)和改良种3(PNC<5)的烟碱转化性状分离明显,TSNAs含量较高。综合来说,烟株烟碱转化率2.5%作为区别转化株和非转化株的标准较为可靠,选择PNC<2.5的烟株进行留种或制种可以保证后代群体中出现转化株的频率最低,能够更有效地降低降烟碱含量和烟草特有亚硝胺的形成和积累,提高烟叶的香味品质。
烟碱转化株;鉴别标准;白肋烟;品种改良;烟草特有亚硝胺
烟碱是白肋烟的重要化学成分,其含量高低和烟叶品质及可用性有十分密切的关系[1-2]。普通烟草属于烟碱积累型,其烟碱含量占总生物碱含量93%以上,但在栽培品种的烟株群体中,一些烟株会因为基因突变而形成烟碱去甲基能力,导致烟碱含量显著降低,降烟碱含量相应增加[3-4]。烟碱向降烟碱转化可显著影响烟叶香味品质,并促进烟草特有亚硝胺之一亚硝基降烟碱的形成和积累[5-9],从群体中去除转化株是降低烟叶和产品中TSNAs 含量及提高和改善烟叶香味品质的有效途径。烟碱转化的发生是显性突变的结果,烟碱转化是显性基因控制,并具有加性效应[10-11],因此品种材料转化株的多少和烟碱转化率高低将直接影响后代表现。烟碱转化主要发生在白肋烟的调制阶段,通过遗传改良途径去除烟碱转化株,必须在开花前对留种烟株或亲本材料进行转化性状诱导,并根据生物碱分析结果和烟碱转化率进行转化株的鉴别[12]。国外曾把烟碱转化率大于5%作为转化株的标准,后来修改为大于3%作为标准,但研究中发现一些烟碱转化率低于3%的烟株自交后代仍出现显著的烟碱转化性状分离,近期研究表明,烟碱转化率高于2.5%作为转化株的鉴别标准具有更大的科学性,且烟碱转化率低于2.5% 的烟株在不同叶位间和叶点间比较稳定,而烟碱转化率高于2.5% 的烟株表现出叶位间和叶点间的较大变异,而且自交后代仍会出现烟碱转化性状的分离[13-14]。本研究基于不同的烟碱转化株鉴别标准对云南白肋烟主栽品种TN86进行遗传改良,旨在明确不同转化株鉴别标准的科学性、改善烟叶品质和降低TSNA含量,为白肋烟品质育种和品种改良提供依据。
1 材料与方法
1.1 试验材料和地点
本试验分别于2011年和2012年在云南省宾川县进行。2011年对主栽品种TN86进行转化株早期诱导,按不同转化株鉴别标准得到改良种和株系,分别为TN86改良种1(PNC<2.5)、TN86改良种2(PNC<3)、TN86改良种3(PNC<5)、高转化株系1(5<PNC<20)、高转化株系2(PNC>20)。
2012年设置田间试验对不同改良种和株系进行农艺性状、化学成分和品质性状的比较。以当地白肋烟主栽品种TN86常规种作为对照。试验田面积0.2 hm2,前茬为水稻,地势平坦,排灌方便,肥力中等,种植密度16500株/hm2。
1.2 试验方法
2011年在TN86移栽后30 d定株编号,每株取中下部叶1片烟叶进行转化株的诱导[13],摘取烟叶后,均匀喷施0.3%乙烯利(2-氯乙基磷酸)水溶液,充分湿润,后保湿晾制4 d,待烟叶充分变黄后,将叶片烘干磨碎,测定烟碱和降烟碱含量,计算烟碱转化率。
将所有测定烟株套袋自交,所获种子按测定的烟碱转化率采用不同的标准将种子混合形成上述3个改良种和两个株系。于2012年按常规方法进行育苗,5月10日移栽。对比试验采用随机区组设计,重复3次。移栽后30d,在每个改良种和株系中随机选取20株挂牌编号,每株摘取中下部叶1片,采用乙烯利进行烟碱转化诱导,以使具有烟碱转化能力的植株在早期表达烟碱转化性状,测定烟碱转化率的株间分布。
烟叶成熟后,整株砍收,统一挂在白肋烟标准晾房里晾制。晾制结束后,采收不同改良种和株系与两个对照的上部叶和中部叶的烟样进行混合样品常规化学成分、生物碱、TSNA含量的测定。
1.3 化学成分测定
生物碱:样品在60 ℃下烘干粉碎,过60目筛,称取0.1 g烟叶样品,用无水乙醚萃取,加0.5 mL 2NAOH润湿,再加5 mL乙醚振荡1 h提取生物碱;气相色谱仪为Agilent-6890,检测器为FID,具体操作和参数设定按Burton等[15]的方法进行。转移上清液1 mL于色谱瓶中,用气相色谱仪进行烟碱、降烟碱、假木贼碱和新烟碱含量分析。烟碱转化能力用烟碱转化百分率表示,即降烟碱含量占烟碱和降烟碱含量之和的百分比:
烟碱转化百分率(%)=[降烟碱含量/(烟碱含量+降烟碱含量)]×100
TSNA测定:样品送至美国肯塔基大学测定,测定方法为气相色谱-热能分析联用仪(TEA),具体参数按Burton等[15]方法进行。
常规成分测定:烟叶总氮、还原糖、钾、氯等含量采用德国BRAN+LUEBBE公司制造的AA3型流动分析仪测定。
1.4 数据分析与处理
运用SPSS17.0和Excel统计软件进行数据的处理和分析。
2 结果与分析
2.1 TN86常规种植的烟碱转化率分布
图1是白肋烟品种TN86常规种植的烟株间烟碱转化率的分布图,其烟碱转化率的变异范围为1.245%~40.115%。变异系数为154.98%,烟株间烟碱转化率变异较大,说明白肋烟TN86在种植过程中烟碱转化性状分离明显,出现较高比例的烟碱转化株。
表1是2011年TN86常规种进行烟碱转化率测定后,按照不同的转化株鉴别标准得到的3个改良种和两个株系及平均烟碱转化率。由表1可知,按照2.5%作为区分转化株和非转化株鉴别标准得到的TN86改良种1(PNC<2.5)平均烟碱转化率最低,为1.73%。

图1 TN86自然群体单株烟碱转化率分布Fig.1 Distribution of nicotine conversion ratio for individual plants of TN86

表1 TN86改良种及株系母代烟碱转化率范围及平均烟碱转化率Tab.1 Range of nicotine conversion ratio and average nicotine conversion ratio of parental plants of improved TN86 varieties and high converter lines
2.2 不同改良种和株系早期诱导后烟碱转化率株间分布
2.2.1 TN86改良种1(PNC<2.5)烟碱转化率的株间分布
由图2可知,改良种1的烟碱转化率变异幅度为1.00%~9.43%,变异系数为49.58%,烟碱转化性状分离不明显,表明烟碱转化率在小于2.5%之间的烟株性状稳定,仅有少量低转化株出现。
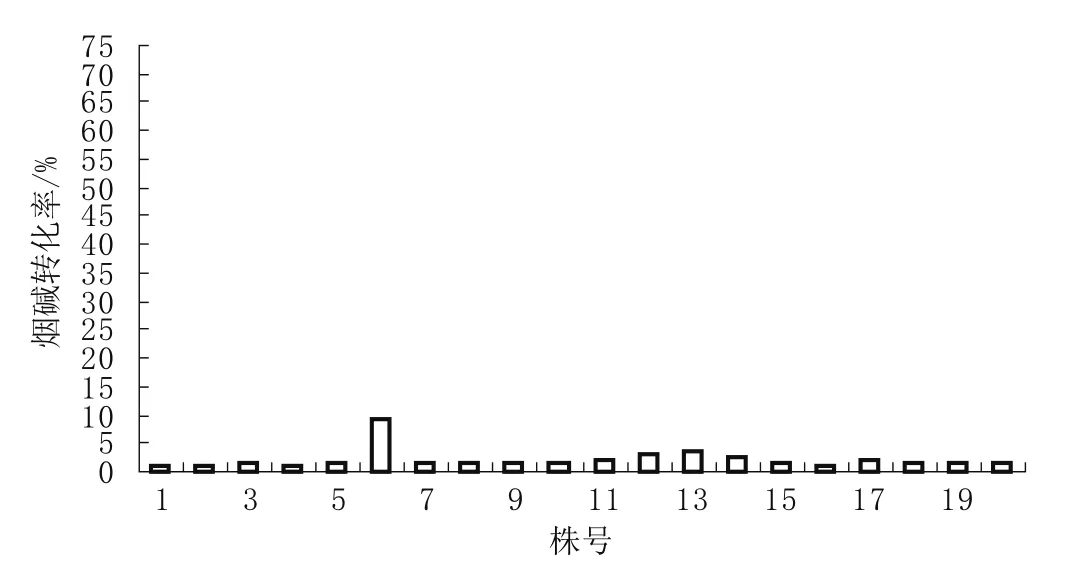
图2 TN86改良种1(PNC<2.5)烟株烟碱转化率的株间分布Fig.2 Distribution of nicotine conversion ratio for individual plants of improved TN86-1(PNC<2.5)
2.2.2 TN86改良种2(PNC<3)烟碱转化率的株间变异和分布
由图3可知,改良种2烟碱转化率变异幅度为1.52%~16.07%,变异系数为91.93%,烟碱转化性状分离突出,表明烟碱转化率低于3%的烟株群体中存在转化株。

图3 TN86改良种2(PNC<3)烟株烟碱转化率的株间分布Fig.3 Distribution of nicotine conversion ratio for individual plants of improved TN86-2 (PNC<3)
2.2.3 TN86改良种3(PNC<5)烟碱转化率的株间分布
由图4可知,改良种3的烟碱转化率变异幅度为1.702%~45.931%,变异系数为128.18%,变异系数较高,性状分离明显,表明群体中含有一定数量的转化株,后代群体中可分离出不同程度的转化株。

图4 TN86改良种3(PNC<5)烟株烟碱转化率的株间分布Fig.4 Distribution of nicotine conversion ratio for individual plants of improved TN86-3 (PNC<5)
2.2.4 高转化株系1(5<PNC<20)烟株烟碱转化率的株间分布
为了验证转化株的分离规律, 研究中选择了高转化株进行对比试验。高转化株系1(5<PNC<20)烟株烟碱转化率的株间分布如图5,其烟碱转化率变异幅度为1.73%~57.41%,变异系数为118.88%,烟碱转化性状分离相对明显,且不同程度转化株呈连续分布,其中包含一定数量的高转化株。

图5 高转化株系1(5<PNC<20) 烟株自交后代烟碱转化率的株间分布Fig.5 Distribution of nicotine conversion ratio for individual plants of TN86 high converter line 1 (5<PNC<20)
2.2.5 高转化株系2(PNC>20)烟株自交后代烟碱转化率的株间分布
由图6可知,高转化株系2的烟碱转化率变异幅度为3.93%~89.84%,变异系数为43.92%,变异系数较低,烟碱转化性状分离不明显,表明烟碱转化率PNC>20的烟株性状较稳定,后代烟株均为转化株。

图6 高转化株系2(PNC >20)烟株自交后代烟碱转化率的株间分布Fig.6 Distribution of nicotine conversion ratio for individual plants of TN86 high converter line 2 (PNC>20)
2.3 TN86不同改良种和株系转化株和非转化株比例
由表2可以得出,TN86改良种1(PNC<2.5)群体中非转化株比例为80%,低转化株比例为20%,平均烟碱转化率为2.07%(小于2.5%),烟株的性状稳定。TN86改良种2(PNC<3)和TN86改良种3(PNC<5)种植的后代群体中出现大量低转化株,烟碱转化性状较不稳定,后代分离出现转化株的比例较高。高转化株系1(5<PNC<20)非转化株比例占15%,平均烟碱转化率为12.65%。TN86高转化株系2(PNC>20)在种植的后代中全为转化株,低转化株的比例仅占10%,平均烟碱转化率62.67%。TN86改良种1与改良种2、3差异性不显著,与高转化株系1和2差异性显著。
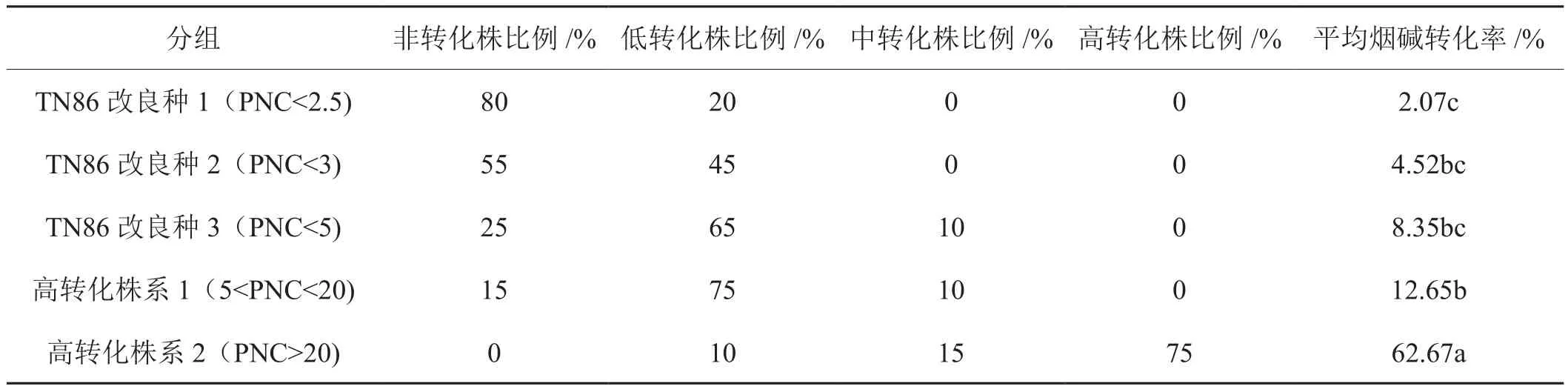
表2 白肋烟不同改良种和株系的转化株鉴定结果Tab.2 Identification results of converter from improved varieties and high converter lines
2.4 调制后不同改良种和株系经济性状分析比较
从表中可以看出改良种1(PNC<2.5)的产量最高。改良种1(PNC<2.5)的产值较高,高转化株系2(PNC>20)的产值最低。TN86不同改良种和株系与TN86常规种的上等烟比例、中等烟比例以及均价之间差别较小。不同改良种和株系的中等烟比例表现为差异性不显著。不同改良种和株系的产值和产量之间表现为差异性显著。从表3中可以看出,TN86改良种1(PNC<2.5)优于其他的改良种和株系。
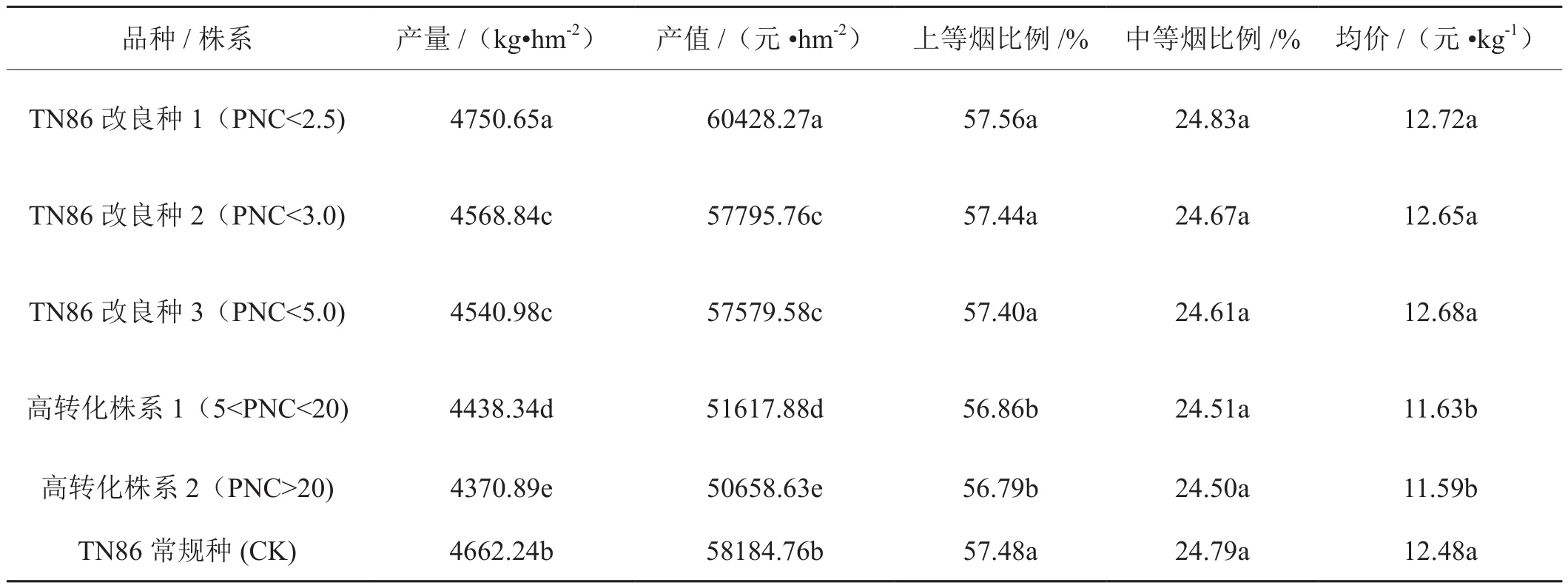
表3 白肋烟TN86改良种和株系与TN86常规种经济性状的比较分析Tab.3 Comparison of economic characters between TN86 regular variety and improved varieties and high converter lines
2.5 调制后不同改良种和株系化学成分分析比较
从表4可知,上部叶的还原糖,各个品种间均在适宜范围内,以改良种2(PNC<3.0)最大;烟碱含量存在较大差异,改良种1(PNC<2.5)显著高于TN86常规种和高转化的株系,这是因为改良种的烟碱转化性状得到了改良,烟碱转化株减少,烟碱转化率降低。不同改良种和株系间总氮含量、Cl含量和K含量变化差异较小。不同改良种和株系间的上部叶烟碱含量多表现为差异性显著。中部叶的还原糖和总氮明显大于上部叶的含量;中部叶烟碱含量明显低于上部叶。

表4 白肋烟不同改良种和株系与TN86常规化学成分的比较Tab.4 Comparison of chemical components between TN86 regular variety and improved varieties and high converter lines
2.6 调制后不同改良种和株系的烟碱转化率分布
由图7、8可知,以PNC<2.5作为转化株的标准进行品种改良得到的改良种烟碱转化率最低,上部叶比常规种降低1.36个百分点,降低37.7%,中部叶比常规种降低1.37个百分点,降低38.3%。以PNC<3和PNC<5为转化株标准进行品种改良,所得到的改良种烟碱转化率也较对照种相应降低,但降低的幅度相对较低。改良种1与改良种2和改良种3的上部叶和中部叶的烟碱转化率差异性不显著,同高转化株系差异性显著。所选择的高转化株系的调制后烟叶烟碱转化率处于较高水平,且与转化株系的基础水平密切相关。

图7 白肋烟改良种和株系调制后上部叶烟碱转化率比较Fig.7 Comparison of nicotine conversion ratios among cured upper leaves of different improved varieties and lines
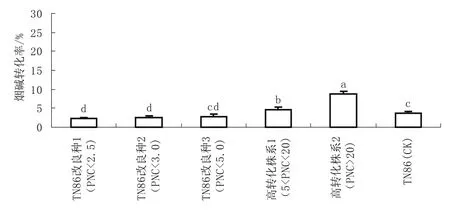
图8 白肋烟改良种和株系调制后中部叶烟碱转化率比较Fig.8 Comparison of nicotine conversion ratios among cured middle leaves of different improved varieties and lines
2.7 不同改良种和株系调制后烟叶TSNAs含量比较
由表5可知,TN86常规种TSNA总量为3.001µg/g,以NNN含量最高,NAT含量其次(表5)。TN86改良种1(PNC<2.5)的总TSNA含量最低,比常规种降低 17.9%, 其次为 TN86改良种 2(PNC<3.0)。总TSNA含量的降低主要是由NNN含量的降低引起的,两个TN86改良种比常规种NNN含量分别降低34.3%和27.9%。TN86改良种1的TSNA总含量与改良种2和改良种3差异不显著,与高转化株系1、高转化株系2和TN86常规种(CK)差异性显著。因此,通过严格选择烟碱转化率低的非转化株进行留种,可以显著降低后代群体中烟碱转化株比例和烟碱转化率,进而降低NNN和总TSNA含量。
3 讨论
烟碱转化是白肋烟生产中的突出问题,特别是我国不少白肋烟品种由于在品种选育和种子繁育过程中没有进行降烟碱含量的测定和选择, 所以群体中存在大量转化株,直接造成香味品质下降和烟草特有亚硝胺含量增加,对烟叶品质和烟叶安全性造成不利影响。烟碱转化是隐性基因向显性基因突变造成的,NtabCYP82E4位点在转录上的重新激活使其在衰老叶片中产生烟碱去甲基形成降烟碱[16]。因此,烟碱转化性状可在群体中不断积累,对栽培品种进行系统改良十分必要。
在烟株生长早期阶段进行转化株和非转化株的鉴定对于品种改良是必需的,科学制定区分转化株和非转化株的标准至关重要,在前期研究中,我们通过不同烟碱转化率与新烟草碱/降烟碱比值的关系以及具有不同烟碱转化率烟株自交后代的表现提出了烟碱转化率2.5%可以作为区分转化株和非转化株的标准[13-14],在本研究中,我们首次将该标准应用到对白肋烟TN86的改良中,并与采用其它标准得到的改良种进行比较,通过对不同改良种烟碱转化株的比例和转化程度分布、调制后烟叶样品化学成分、烟碱转化率、烟草特有亚硝胺含量等的分析,表明以烟碱转化率2.5%作为区分转化株和非转化株的标准进行品种改良是科学和有效的。改良种1(PNC<2.5)后代变异系数小,烟株性状稳定,其化学成分和经济性状明显优于其它改良种。改良种1(PNC<2.5)上部叶烟碱含量显著高于TN86常规种和高转化的株系,这是因为改良种的烟碱转化性状得到了改良,烟碱转化株减少,烟碱转化率降低。调制后改良种1(PNC<2.5)的总TSNA含量最低,比常规种降低17.9%。改良种2(PNC<3)和改良种3(PNC<5)的后代株间变异大,烟碱转化性状分离明显,表明这两个改良种群体中仍含有一定比例的转化株,因此不能达到最佳的改良效果。虽然在改良种1的群体中仍出现个别低转化株,这可能是由于烟叶在进化过程中形成的非转化基因很不稳定,所以经过严格选择的非转化株群体后代仍会出现一定比例的转化株[10]。因此对品种的选择和改良不是一劳永逸的,需要持续进行。
4 结论
采用烟碱转化率2.5%作为区分转化株和非转化株的标准,严格选择烟碱转化率低于2.5%的烟株进行留种或制种可以保证后代群体中出现转化株的频率最低,从而更有效地降低降烟碱含量和烟草特有亚硝胺的形成和积累,提高烟叶的香味品质。
[1]史宏志, 张建勋.烟草生物碱[M].北京: 中国农业出版社,2004: 1-11.
[2]Bush L P, Fannin F F, Chelvarajan R L, et al.Biosynthesis and Metabolism of Nicotine and Related Alkaloids [M]// Corrod J W, Wahren J, eds.Nicotine and Related Alkaloids.London: Chapman & Hall, 1993: 101-128.
[3]史宏志 李进平 Bush L P,等.烟碱转化率与卷烟感官评吸品质和烟气TSNA含量的关系[J].中国烟草学报,2005(11)2:9-14.
[4]史宏志,李进平, Bush L P, 等.白肋烟杂交种及亲本烟碱转化株的鉴别 [J].中国烟草学报, 2005,11(4):28-31.
[5]史宏志, Bush L P, Krauss M.烟碱向降烟碱转化对烟叶麦斯明和TSNA 含量的影响[ J].烟草科技, 2004 (10) : 27-30.
[6]Bush L P, Cui M W, Shi H Z, et al.Formation of tobacco specific nitrosamines in air-cured tobacco [J].Rec Adv Tob Sci, 2001, 55:23-46.
[7]史宏志, 李进平, Bush L P, 等.烟碱转化率与卷烟感官评吸品质和烟气TSNA 含量的关系[J].中国烟草学报, 2005,11(2) : 9-14.
[8]史宏志, 凌爱芬, 刘国顺, 等.白肋烟烟碱转化对烟叶中性和碱性香气成分含量的影响[J].华北农学报, 2007, 22( 5) :43-46.
[9]Shi H Z, Kalengamaliro N E, Hemp fling W P, et al.Difference in nicotine conversion between lamina and midrib in burley tobacco and its contribution to TSNA formation[C]/ / 56th Tobacco Science Research Conference, Lexington, KY, USA, 2002.
[10]Wernsman E A, Davis D L, Beeson D.Genetic instability at a nicotine to nornicotine locus in burley tobacco and its consequences on secondary amine alkaloids and TSNAs [C].CORESTA, Lisbon, Portugal, 2000.
[11]Chelvarajan R L, Fannin F F, Bush L P.Study of nicotine demethylation in Nicotiana otophora [J].J Agric Food Chem,1993, 41: 858-862.
[12]Shi H Z, Fannin F F, Burton H R, et a1.Identification of nicotine to nornicotine converters in burley tobacco[C]//55thTobacco Science Research Conference, Greensboro, NC, USA, 2001.
[13]史宏志,赵永利,杨兴有,等.白肋烟不同类型转化株烟碱转化率的叶位间和叶点间变异[J].中国烟草学报,2009,15(5):28-32.
[14]赵晓丹,史宏志,杨兴有,等.白肋烟不同程度烟碱转化株后代烟碱转化率株间变异研究[J].中国烟草学报, 2012,18(1):29-34.
[15]Burton H R, Bush L P, Djordjevic M V.Influence of temperature and humidity on accumulation of tobacco-specific nitrosamines in stored burley tobacco [J].J Agric Food Chem, 1989, 37: 1372-1377.
[16]Gavilano L B, Coleman L P, Burnley L, et al.Genetic engineering of Nicotiana tabacum (L.) for reduced nornicotine content [J].J Agric Food Chem, 2006,54(24): 9071-9078.
Improvement effect of burley varieties based on identification standard of different nicotine converter
SUN Honglian1, ZHOU Haiyan1, WANG Ruiyun1,SONG Yingli1,SUN Junwei2, WANG Xinzhong2, XUAN Shuzhang3, SHI Hongzhi1
1National Tobacco Cultivation & Physiology & Biochemistry Research Center, Henan Agricultural University, Zhengzhou 450002, China;
2 Yunnan Dali Tobacco Company, Dali 671000, China;
3Binchuan Burley Tobacco Co.Ltd., Binchuan 671600, China
Different improved TN86 varieties with different screening standards for identifying nicotine converter and non-converters were compared for economic character, nicotine conversion ratio, and content of TSNAs.Results showed that the improved variety 1(PNC<2.5)with nicotine conversion ratio of less than 2.5% as benchmark was more stable with ratio of upper tobacco 37.7% lower than conventional breed and 38.3% lower for middle part tobacco.Total content of TSNAs was 17.9% lower than conventional breed, and yield, output value and the proportion of middle and superior tobacco were better than other improved varieties with the lowest variable coefficient.The separations of nicotine conversion characters of improved variety 2(PNC<3) and improved variety 3(PNC<5) were significant, and the content of TSNAs was higher.Generally speaking, there was reliable difference between converter and no-converter with nicotine conversion ratio of 2.5%.Choosing tobacco with PNC<2.5 can ensure lower ratio of appearance of converted plant, and more effectively reduce formation and accumulation of nornicotine and TSNAs, thereby improving aroma quality.
nicotine converter; identification standard; burley; variety improvement; TSNAs
10.3969/j.issn.1004-5708.2014.03.009
S572.01 文献标志码:A 文章编号:1004-5708(2014)03-0056-07
云南省烟草公司科技项目“宾川优质白肋烟技术开发与应用”(2011YN36)
孙红恋(1987—),在读硕士,主要从事烟草栽培和生理研究,Email:sunhongluan1987@163.com
史宏志(1963—),博士,教授,博士生导师,主要从事烟草栽培和生理研究,Email:shihongzhi88@163.com
2013-07-03
