铜催化芳杂环C-H键区域选择性芳基化的研究进展*
2014-11-23黄国利刘波
黄国利, 刘波
(云南师范大学 化学化工学院,云南 昆明650500)
自20世纪初利用过渡金属催化芳基卤化物与有机金属化合物偶联反应,合成联苯类化合物之后,偶联反应被认为是形成C(sp2)-C(sp2)键最有效的合成途径之一.近年来,人们对绿色化学和反应原子经济性的关注增加,传统的交叉偶联反应所使用的有机金属试剂通常很难制备或比较昂贵,且以相应的芳烃为原料制备它们要经过多步反应,需要耗费大量资源,并会产生大量的金属盐副产物.因此,将传统交叉偶联反应中所使用的芳基金属试剂(如格氏试剂、有机硼试剂和有机锌试剂等)进行替代,直接采用各种芳烃(或杂芳烃)作为反应原料,与卤代芳烃等亲电试剂或者杂环芳烃之间原位生成芳基金属化合物实现偶联反应,采用直接芳基化反应合成联芳(杂)烃化合物具有重要的科学研究意义和应用价值,引起了人们的广泛关注.
利用钯、铑、铱和钌等贵金属来催化芳杂环C-H键直接芳基化反应近年来取得重大进展[1-5].而该领域研究的新方向是发展价格低廉且毒性低的过渡金属催化剂去实现该类反应[3,6].目前,铜催化的芳杂环C-H键直接芳基化反应已被大量研究并得以迅速发展,但是如何调控实现不同芳杂环C-H键的区域选择性官能团化反应,已成为制约有效地利用这种方法的关键.近年来,利用铜催化芳杂环C-H键区域选择性芳基化反应进展快速,为更好地了解该领域的最新动态,下面对其最新研究进展进行综述.
1 杂环芳烃与卤代芳烃等亲电试剂的反应
利用卤代芳烃等亲电试剂,实现与杂芳烃C-H键的直接芳基化反应,能保证反应具有较高的原子经济性和较好的选择性,是较为直接和实用的合成反应途径之一.2008年,Gaunt[7]课题组使用配体改良的铜催化剂和[Ph2I][OTf]作芳基化试剂,在吲哚的C-2和C-3位实现了区域选择性芳基化(图1).这种方法的反应条件相当温和,适用于不同的官能团,但是反应中所使用的碘代盐[Ph2I][OTf]在通常情况下难以制备且价格非常昂贵.值得注意的是,在这种反应体系下,区域选择性主要依赖于吲哚上氮原子的取代基,通过控制吲哚化合物氮原子上取代基(如H、Me、Ac等)的不同,可实现吲哚在C-3或C-2位的区域选择性直接芳基化反应,即吲哚或者N-烷基吲哚C-H键功能化发生在C-3位,而N-乙酰基吲哚发生在C-2位.这种选择性主要归结于C-H键功能化首先发生在C-3位,随后氮原子上的乙酰基发生螯合—异构化作用,从而实现C-2位芳基化.该方法具有反应收率高、能兼容其他方法难以保留的I、Br、Cl等取代基的优点,是对过渡金属催化的吲哚化合物C-H键区域选择性直接芳基化反应的重要补充和发展.

图1 铜催化吲哚的区域选择性芳基化Fig.1 Copper-catalyzed regioselective arylation of indoles
时至今日,单取代芳烃在间位选择性的C-H键功能化,一直都是困扰化学家的难题,此前一个多世纪中所报道的亲电芳香取代反应总是发生在芳环富电子取代基的邻对位(或吸电子取代基的间位).在以上工作基础上,Phipps等[8]采用Cu(OTf)2作催化剂,碘代盐[Ph2I][OTf]作芳基化试剂,成功地在苯基酰胺的间位实现了区域选择性芳基化(图2).目前其催化机理仍然不明朗,然而反应中涉及的具有较强亲电性的三价芳基铜应该是主要中间体,它进攻羰基对芳烃使其经历氧化—酮酸盐化过程.这种脱芳构化,导致在间位发生铜酸盐化作用,接着还原芳构化,最后还原消除得到间位芳基化产物(图3).

图2 铜催化苯基酰胺的间位选择直接芳基化Fig.2 Copper-catalyzed meta-selective direct arylation of pivanilide
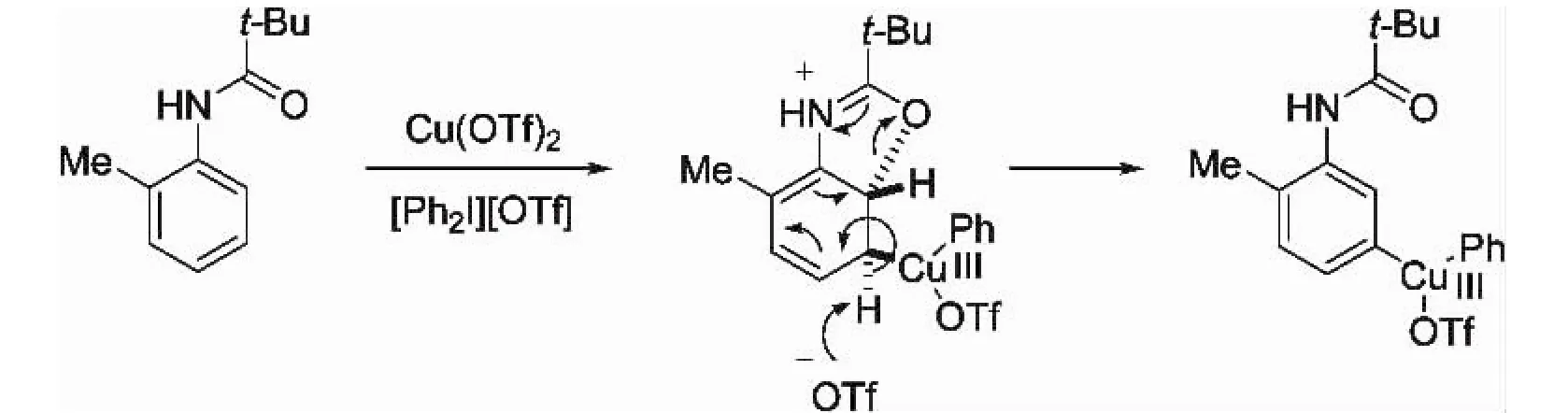
图3 铜催化间位选择芳基化的可能机理Fig.3 Proposed mechanism for copper-catalyzed meta-selective arylation
2011年,本课题组研究了稠杂环化合物(咪 唑并[2,1-b]噻唑)的不同C-H键的直接芳基化反应(图4)[9].该反应采用CuCl作催化剂,碘代芳烃为偶联试剂,不需要加配体,用叔丁醇锂作碱,高产率和区域选择性地得到咪唑并[2,1-b]噻唑C-H键C-2位芳基化产物.此外还对反应机理进行了初步研究,通过氘代实验,排除了“苯炔”机理和“傅-克”反应机理,提出该反应的机理如图5所示:首先Cu(I)亲核加成到咪唑并[2,1-b]噻唑上生成不稳定的阳离子中间体5-1,接着5-1的C(2)-H被碱移除得到有机铜化合物5-2,随后5-2经历碘苯的氧化加成生成Cu(III)中间体5-3,最后经还原消除生成产物.
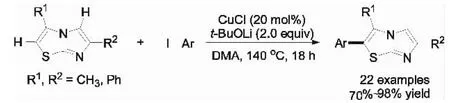
图4 铜催化咪唑并[2,1-b]噻唑的芳基化Fig.4 Cu-catalyzed arylation of imidazo[2,1-b]thiazoles

图5 铜催化咪唑并[2,1-b]噻唑芳基化的可能反应机理Fig.5 Possible reaction mechanism for Cu-catalyzed arylation of imidazo[2,1-b]thiazoles
2 芳(杂环)烃与杂环芳烃的偶联反应
采用钯等贵金属为催化剂,通过氧化偶联来实现芳(杂环)烃与芳烃(或杂环芳烃)的直接芳基化反应已经取得了重大的研究进展[1-2,10],但是利用廉价易得的金属—铜为催化剂实现此类反应却鲜有研究报道[11].2011年,Miura等[12]以醋酸铜为催化剂,在170℃和三甲基乙酸/1,3,5-三甲基苯体系中研究了2-苯基吡啶和1,3-氮杂环的偶联反应(图6).该反应具有较好的区域选择性和较高的产率,采用价格相对低廉的二价铜催化剂,这不仅可以很好的替代贵金属(钯、铑等),有效降低反应成本,且具有环境友好等优势,但是需要足量的催化剂.该反应在一系列2-(2-取代噁唑杂环)芳基取代吡啶有机化合物的制备中表现出良好的应用潜力.此外他们对反应机理进行研究,在动态同位素效应(KIE)实验中,发现没有明显的H/D交换.在体系内加入自由基抑制剂TEMPO,对反应结果也没有抑制作用.基于以上有趣的实验现象,Miura等推断该反应不是常规铜调控单电子转移的机理,而同亲电金属化作用历程类似.
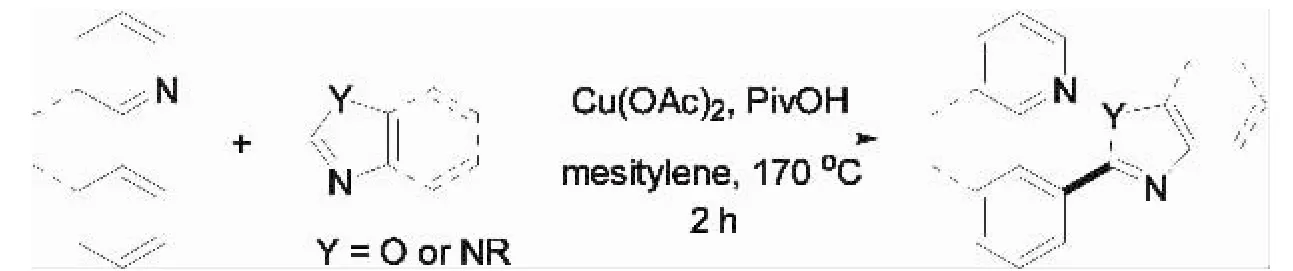
图6 铜调控2-芳基吡啶和1,3-氮杂环偶联反应Fig.6 Copper-mediated direct coupling of 2-arylazines with azoles
在以上研究工作的基础上,该课题组报道了 吲哚和1,3-氮杂环在2-位嘧啶基螯合定位的双重C-H 键活化分子间偶联反应(图7)[13].当吲哚的N-2位为甲基、苯基和2-吡啶磺酰基时,反应不能发生.值得注意的是,该反应采用二价铜作为催化剂,相对于此前用于催化该类反应的Pd和Ru,催化剂价格更为低廉,氧气为氧化剂,Cu/O2催化体系提供了一种直接去氢偶联的新方法,而且该方法可用于制备不同杂环取代的吲哚衍生物,丰富了铜催化杂环C-H键官能团化的研究领域.Miura等提出该反应可能经历如图8所示的机理:首先羧酸盐—配体协同作用下与苯并噁唑生成杂芳基铜中间体8-1,接着 N-(2-嘧啶)吲哚的C-H键通过螯合金属化与8-1生成关键中间体8-2,之后在氧气的促进下发生还原消除生成偶联产物.
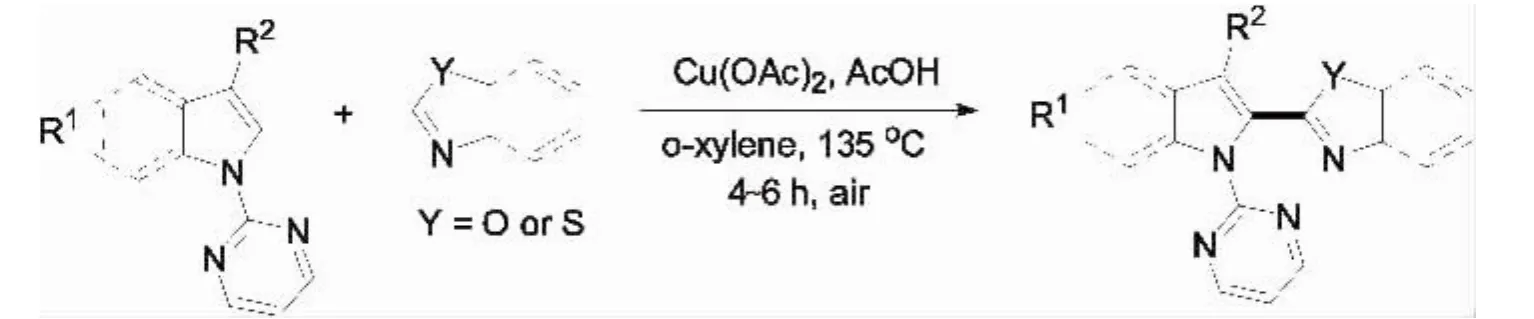
图7 铜促进分子间直接二芳基偶联Fig.7 Cu-promoted intermolecular direct biaryl coupling
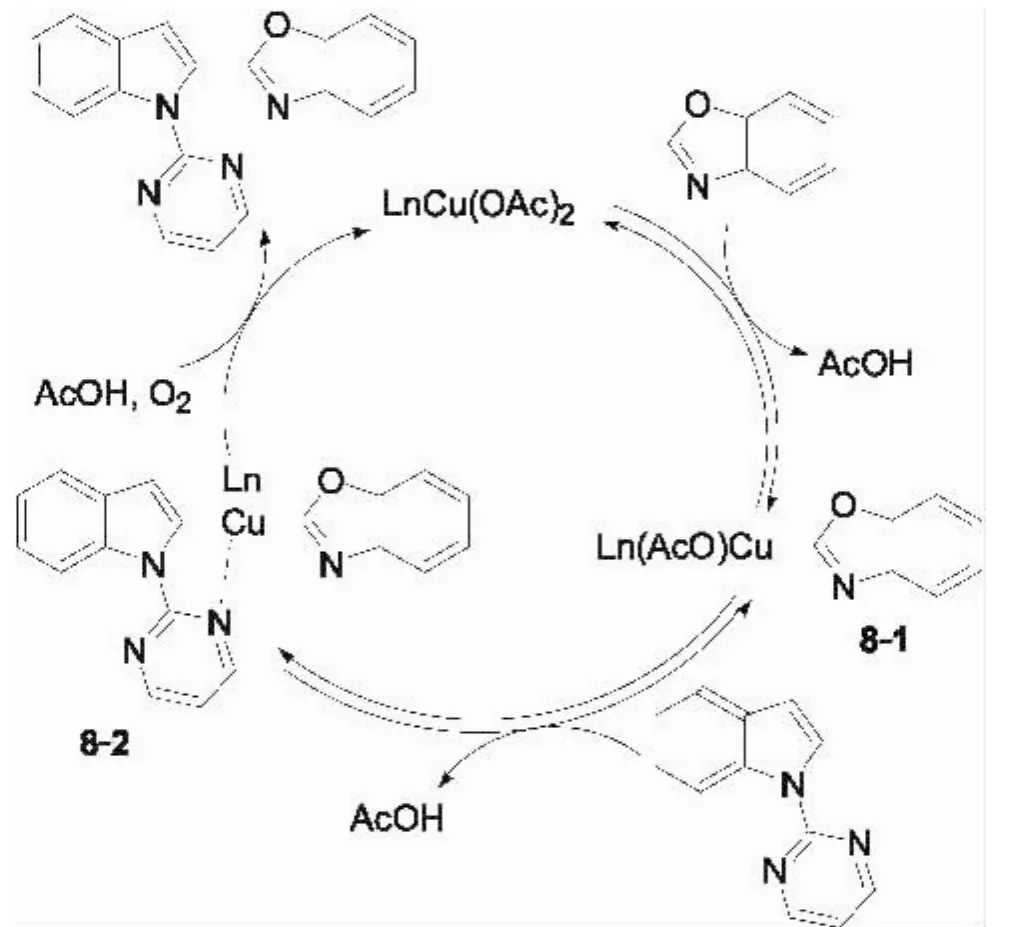
图8 N-(2-吡啶)吲哚和1,3-氮杂环偶联的可能反应机理(L= AcOH,O2,or solvent)Fig.8 Possible reaction mechanism for coupling of N -(2-pyridyl)indoles with azoles(L=AcOH,O2,or solvent)
2013年,Miura[14]课题组采用N,N-双齿配位策略,对铜促进N-(8-喹啉)芳基酰胺和1,3-氮杂环的C-H键偶联反应进行了深入研究(图9).其中,底物芳环上含有不同的吸电子(如卤素)或给电子取代基(如甲基、甲氧基等)以及其他杂环时,反应都能给出中等到优异的产率(34%~97%),在杂环C-H键直接官能团化反应中,二齿配位体系拓宽了底物的适用范围.

图9 铜促进的不同苯甲酰胺类衍生物与1,3-氮杂环C-H键偶联反应Fig.9 Copper-mediated C-H/C-H coupling of various benzoic acid derivatives with azoles
此外,他们对氘标记苯甲酰胺([D5]-1a)和 苯并噁唑([D1]-2a)的D/H交换反应实验进行反应机理分析(图10).一方面,发现存在苯甲酰胺时,氘代苯并噁唑([D1]-2a)有快速的 H/D交换反应.另一方面,当存在苯并噁唑时,氘代苯甲酰胺([D5]-1a)没有发生 H/D交换,而体系中不存在苯并噁唑时,氘代苯甲酰胺([D5]-1a)却有明显H/D交换.从这些有趣的实验现象,可以推断在相同反应条件下苯并噁唑的C-H键断裂是可逆的,苯甲酰胺的C-H键断裂是不可逆的,并且前者C-H键断裂速度比后者更快.基于上述实验分析,Miura等提出该反应可能经历如图11所示的机理:首先在醋酸根—配体协同作用下与苯并噁唑生成芳基铜中间体11-1,接着苯甲酰胺与配体交换生成N,N-双螯合配合物11-2,之后醋酸铜促进苯环上C-H键的氧化断裂,再经中间体11-3的还原消除得到偶联产物.
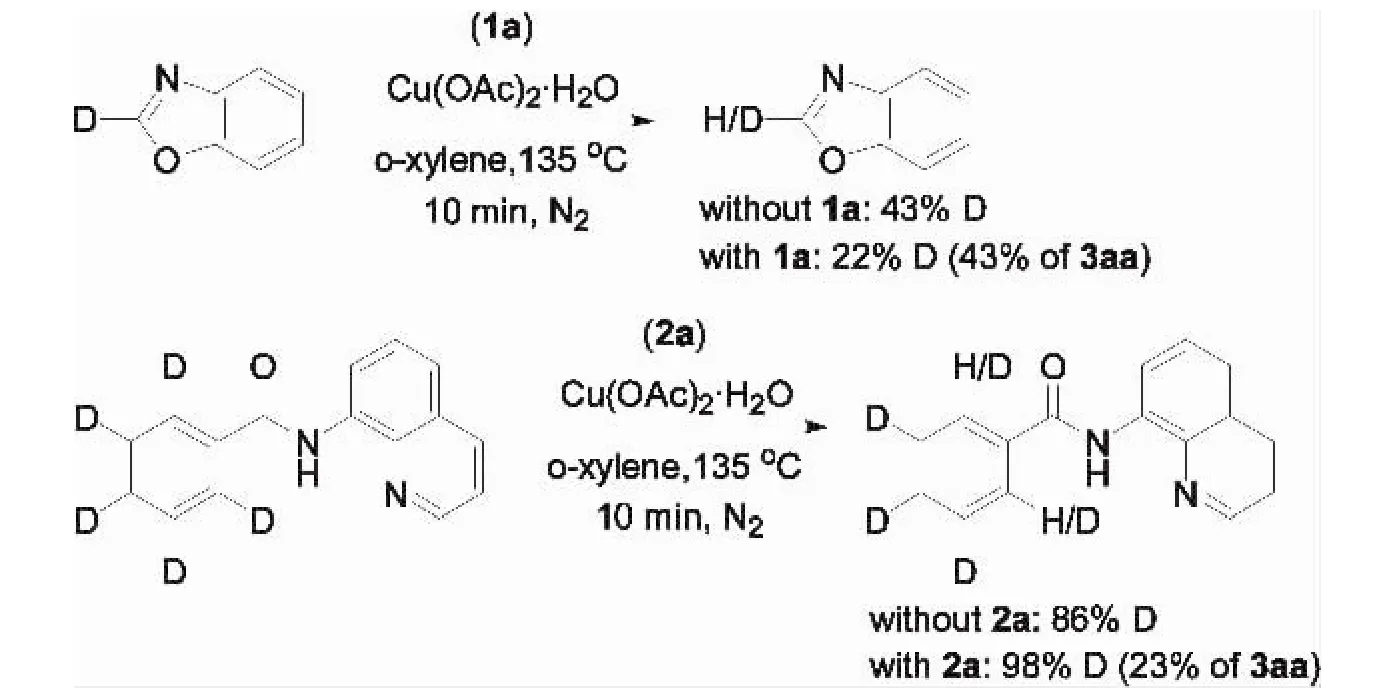
图10 H/D交换反应Fig.10 The H/D exchange reaction
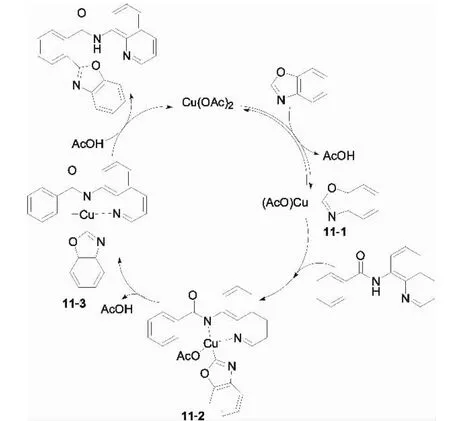
图11 苯甲酰胺类衍生物与1,3-氮杂环C-H键偶联的可能反应机理Fig.11 Possible reaction mechanism for coupling of benzoic acid derivatives with azoles
3 结论与展望
本文对近年来铜催化芳杂环C-H键区域选择性芳基化反应的最新研究进展进行了综述.各种铜盐催化剂廉价易得以及辅以廉价低毒或无毒的配体,使其催化反应常常表现出高区域/立体选择性,这都成为铜在催化应用中更受人们青睐和关注的原因.然而也应注意到,目前铜催化活化C-H键区域性选择性官能团化反应仍存在一些局限:1)部分反应仍需使用较高催化量甚至足量的铜盐才能保证反应转化率;2)反应选择性难以调控,多为铜催化sp2C-H键活化,而sp及sp3 C-H键反应研究较少.因此铜催化的芳杂环C-H键区域性选择性官能团化反应研究还有待进一步提升,其潜在应用领域还有待进一步拓展,相信在接下来的时间里,将会有更多的人关注和投身此研究之中,铜在此催化应用领域将会更加绿色、经济、实用和高效.
[1]ALBERICO D,SCOTT M E,LAUTENS M.Arylaryl bond formation by transition-metal-catalyzed direct arylation[J].Chem.Rev.,2007,107(1):174-238.
[2]MCGLACKEN G P,BATEMAN L M.Recent advances in aryl-aryl bond formation by direct arylation[J].Chem.Soc.Rev.,2009,38(8):2447-2464.
[3]DAUGULIS O,DO H Q,SHABASHOV D.Palladium-and copper-catalyzed arylation of carbon-hydrogen bonds[J].Acc.Chem.Res.,2009,42(8):1074-1086.
[4]CHEN X,ENGLE K M,WANG D H,et al.Palladium(II)-catalyzed C-H activation/C-C cross-coupling reactions:versatility and practicality[J].Angew.Chem.Int.Ed.,2009,48(28):5094-5115.
[5]ACKERMANN L,VICENTE R,KAPDI A R.Transition-metal-catalyzed direct arylation of(hetero)arenes by C-H bond cleavage[J].Angew.Chem.Int.Ed.,2009,48(52):9792-9826.
[6]ZHANG M.Copper-catalyzed/mediated aromatic C-H bond functionalization[J].Appl.Organomet.Chem.,2010,24(4):269-284.
[7]PHIPPS R J,GRIMSTER N P,GAUNT M J.Cu(II)-catalyzed direct and site-selective arylation of indoles under mild conditions[J].J.Am.Chem.Soc.,2008,130(26):8172-8174.
[8]PHIPPS R J,GAUNT M J.A meta-selective coppercatalyzed C-H bond arylation[J].Science,2009,323(5921):1591-1597.
[9]HUANG G L,SUN H S,QIU X J,et al.Ligandfree copper-catalyzed Regioselective C-2arylation of imidazo[2,1-b]thiazoles[J].Org.Lett.,2011,13(19):5224-5227.
[10]STUART D R,FAGNOU K.The catalytic crosscoupling of unactivated arenes[J].Science,2007,316(5828):1172-1175.
[11]SAKAMOTO T,YONEHARA H,PAC C.Efficient oxidative coupling of 2-naphthols catalyzed by alumina-supported copper (Ⅱ)sulfate using dioxygen as oxidant[J].J.Org.Chem.,1994,59(22):6859-6861.
[12]KITAHARA M,UMEDA N,HIRANO K,et al.Copper-mediated intermolecular direct biaryl coupling[J].J.Am.Chem.Soc.,2011,133(7):2160-2162.
[13]NISHINO M,HIRANO K,SATOH T,et al.Copper-mediated and copper-catalyzed cross-coupling of indoles and 1,3-azoles:double C-H activation[J].Angew.Chem.Int.Ed.,2012,51(28):6993-6997.
[14]NISHINO M,HIRANO K,SATOH T,et al.Copper-mediated C-H/C-H biaryl coupling of benzoic acid derivatives and 1,3-azoles[J].Angew.Chem.Int.Ed.,2013,52(16):4457-4461.
