猪瘟病毒间接ELISA抗体检测试剂盒的临床应用研究
2014-11-23范学政梁智选熊仲良吴赟竑宁宜宝赵启祖
徐 璐,范学政,梁智选,陈 静,余 勇,熊仲良,吴赟竑,宁宜宝,郑 然,赵启祖,王 琴
(1.中国兽医药品监察所,北京 海淀 100081;2.天津市动物疫病预防控制中心,天津 北辰 300402;3.山东省动物疫病预防控制中心,山东 济南 250022;4.四川省动物疫病预防控制中心,四川 成都 610041;5.重庆市动物疫病预防控制中心,重庆 渝北 401120;6.浙江省动物疫病预防控制中心,浙江杭州 310020)
猪瘟为我国的重大动物疫病。在《国家中长期动物疫病防治规划(2012-2020年)》中,将猪瘟作为我国优先防治和重点防范的16种动物疫病之一。我国对猪瘟防控主要采用猪瘟疫苗免疫加捕杀的策略,而抗体检测是免疫效果评价的主要手段。目前,世界动物卫生组织推荐的猪瘟抗体检测方法是ELISA检测方法和荧光抗体中和试验Fluorescent antibody virus neutralisation test,FVNT)[1],而FVNT对试验条件和操作人员的要求很高,且耗时长,仅适合专业实验室进行少量样本检测,不宜推广应用。因此可以说,ELISA方法是目前国际上承认的惟一适合大规模应用的血清检测方法。在进行ELISA检测方法评价时,最重要的两个指标就是敏感性和特异性,而二者又存在一定的矛盾性。当对一种检测方法的敏感性要求较高时,势必会损失一部分特异性;同样,当特异性要求较高时,势必会损失一部分敏感性。因此,对于一个好的检测方法来说,一定要寻找敏感性和特异性最佳的平衡点和结合点[2-4]。目前,用于猪瘟抗体检测的ELISA方法主要有液相阻断ELISA和间接ELISA两种原理。液相阻断ELISA使用了单克隆抗体,因此检测的特异性更高;而间接ELISA则更侧重于敏感性。因此,为了研究猪瘟病毒间接ELISA抗体检测试剂盒的临床应用效果,采用该试剂盒和进口阻断试剂盒对田间采集的临床血清样本进行检测,同时采用OIE推荐的FVNT进行符合验证,帮助读者在实际工作中选择更为合适的检测试剂。
1 材料与方法
1.1 材料
1.1.1 PK15传代细胞系、猪瘟病毒Thiveral株由中国兽医药品监察所鉴定、保存并提供。
1.1.2 猪瘟病毒单克隆荧光抗体 由中国兽医药品监察所鉴定、保存并提供。
1.1.3 试剂盒 猪瘟病毒间接ELISA抗体检测试剂盒(简称“间接试剂盒”)中国兽医药品监察所提供,批号为20130524。猪瘟病毒抗体检测试剂盒(简称“阻断试剂盒”):批号为A651,购自美国IDEXX公司。
1.1.4 血清样本 临床血清样本1 621份,分别采自四川省、重庆市、山东省、天津市、浙江省的种猪场、商品猪场和散养户(见表1)。其中,经猪瘟疫苗免疫猪血清1 245份,非免疫仔猪血清376份(见表2)。
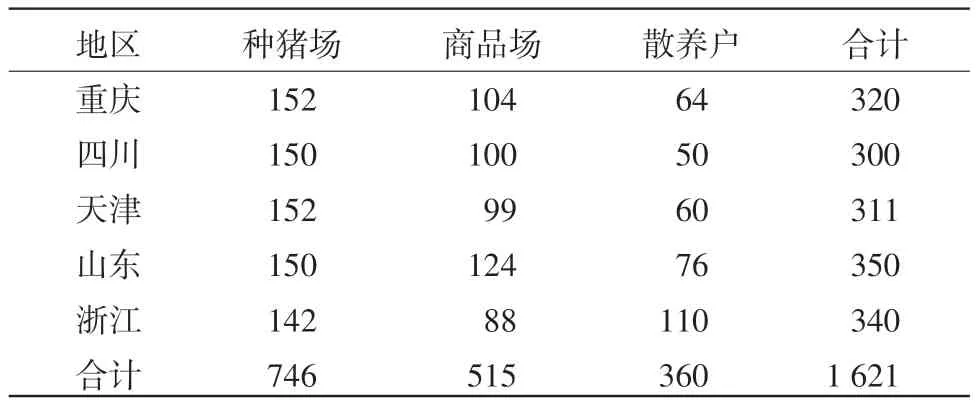
表1 临床样本来源统计
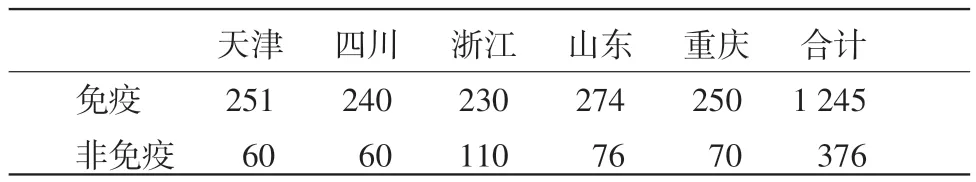
表2 临床血清样本免疫状况统计
1.2 方法
1.2.1 ELISA试剂盒检测 采用上述两种试剂盒分别对1 621份田间血清进行检测,每份血清重复2孔,检测步骤按照试剂盒说明书进行。计算两种试剂盒的符合率,结合血清的免疫背景,对检测结果进行分析。
1.2.2 荧光抗体病毒中和试验 将上述两种ELISA试剂盒检测结果有差异的血清用FVNT进行验证,具体操作方法参见《陆生动物诊断试剂和疫苗手册》[1]。比较两种试剂盒在检测田间样本时与FVNT的符合率。
2 结果
2.1 两种试剂盒的检测结果及符合率 在临床检测的1 621份猪血清样本中,用间接试剂盒检测出1 020份阳性,531份阴性,70份可疑;用阻断试剂盒检测916份阳性,628份阴性,77份可疑。检测结果不相符的样本为355份,其中有216份血清的检测结果相反(一种试剂盒为阳性,另一种为阴性),另有139份血清的检测结果存在可疑结果。两种试剂盒的总符合率为78.1%(见表3)。
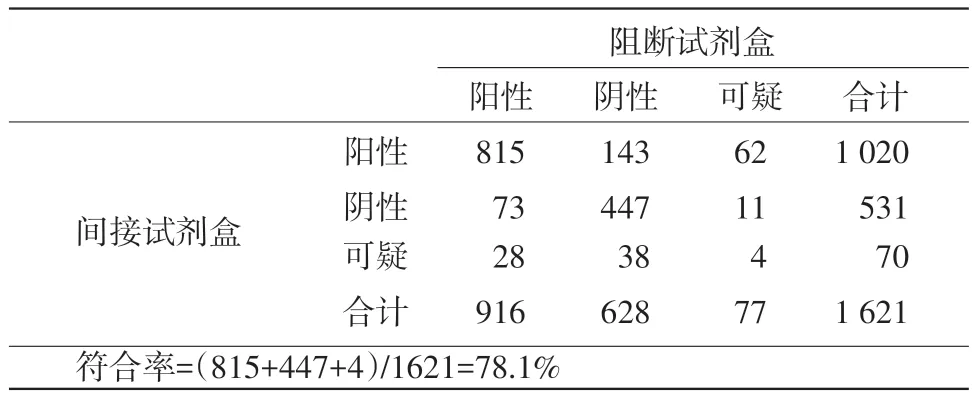
表3 间接试剂盒与阻断试剂盒符合率统计
2.2 荧光抗体病毒中和试验(FVNT)对两种试剂盒检测结果不符合血清的验证 在上述两种试剂盒检测结果不符合样本355份血清样本中,从中选出283份足量血清,采用FVNT方法进行验证性检测,比较FVNT与两种试剂盒的符合率(见表4和表5)。结果间接试剂盒与FVNT的符合率为69.26%,阻断试剂盒与FVNT的符合率为28.62%。FVNT检测结果代表性图片见中插彩版图1~4(其他血清照片略)。

图1 Thiveral株病毒接毒对照

图2 未接毒细胞对照
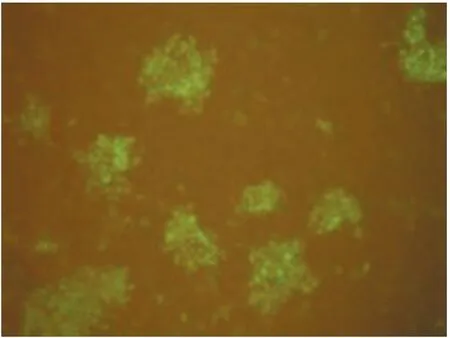
图3 非免疫血清

图4 免疫血清

表4 间接试剂盒与FVNT的符合率

表5 阻断试剂盒与FVNT的符合率
中插彩版图1为Thiveral猪猪瘟病毒接毒对照;中插彩版图2为未猪瘟病毒细胞对照;中插彩版图3为非免疫血清,样本中无猪瘟病毒抗体,与猪瘟病毒Thiveral株不发生中和反应,因此病毒能感染PK-15细胞,经培养后用猪瘟病毒荧光抗体进行染色,感染细胞出现特异性荧光(胞浆染色);中插彩版图4为免疫血清,样本中含猪瘟病毒抗体,与猪瘟病毒Thiveral株发生中和反应,使病毒丧失了对细胞的感染能力,经培养后用猪瘟病毒荧光抗体进行染色,在细胞中观察不到特异性荧光。
2.3 间接试剂盒与阻断试剂盒对免疫和非免疫血清的检测结果 在1 621份临床血清样本中,有免疫血清1 245份,非免疫仔猪血清376份。在1 245份免疫血清中,间接试剂盒检测出阳性1 008份,阳性率为80.96%(见表6);阻断试剂盒检出阳性835份,阳性率为67.07%。在376份非免疫血清中,间接试剂盒检出阴性323份,阴性率为85.9%;阻断试剂盒检出阴性296份,阴性率为78.72%(见表7)。
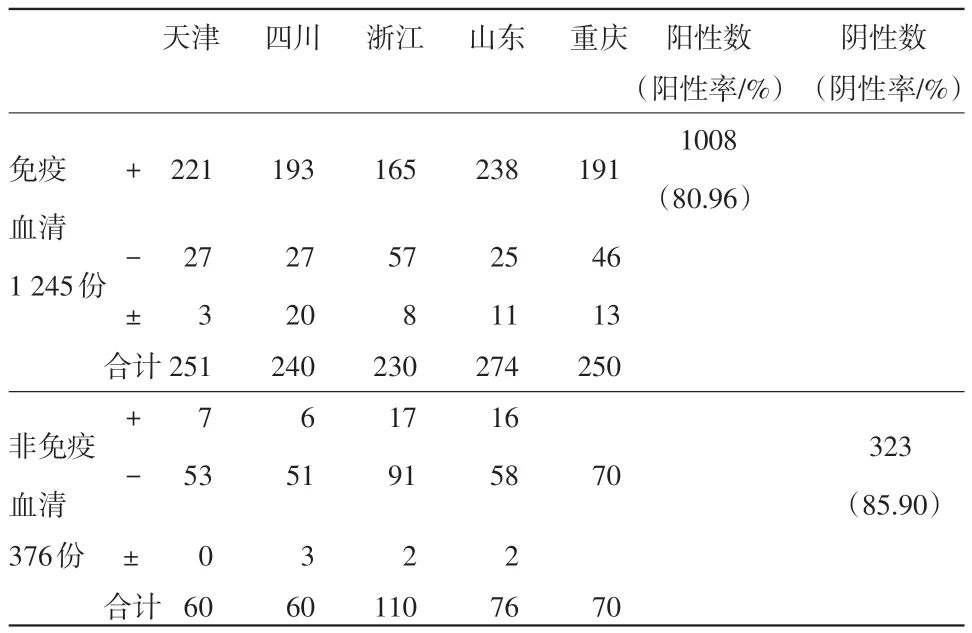
表6 间接试剂盒对临床样本检测结果统计
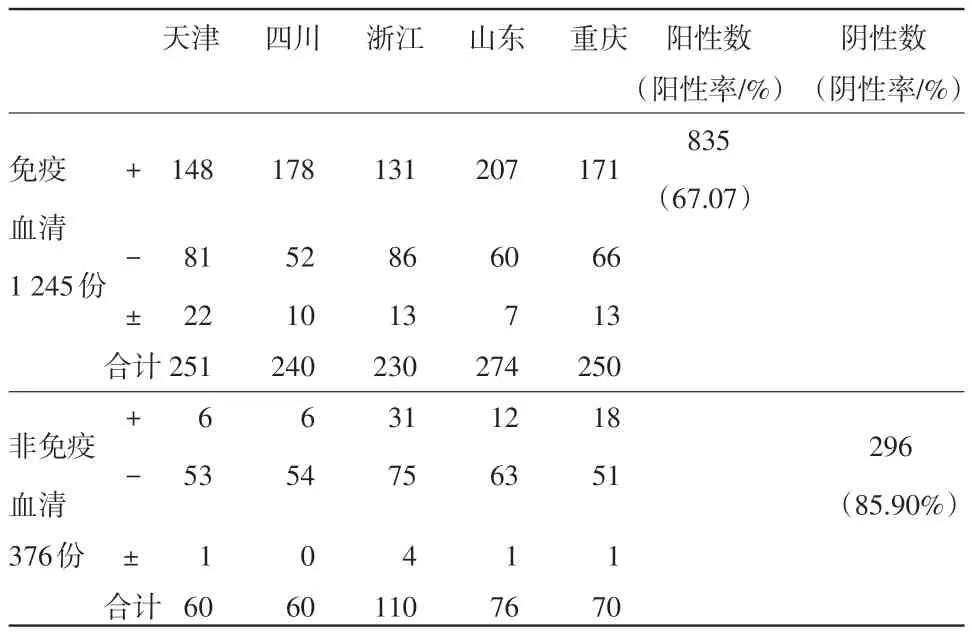
表7 阻断试剂盒对临床样本检测结果统计
3 讨论
猪瘟在我国属重大动物疫病。猪瘟疫苗为强制免疫疫苗。农业部规定,每年的春季和秋季都要集中进行免疫防疫,规模猪场和散养户必须按照规定的免疫程序进行全群免疫,而对免疫抗体水平监测是免疫效果评价的惟一手段。在农业部颁布的2010-2013年国家动物疫病监测方案中,规定可以采用阻断ELISA或间接ELISA等方法进行猪瘟抗体水平检测。因此说明,阻断ELISA和间接ELISA在实际应用过程中,均具有合理性。但是针对我国的大规模强制免疫现状,如何在不同的应用范围选择适合的试剂盒就成为一个重要问题。
3.1 试剂盒研制原理的差异 阻断试剂盒基于液相阻断原理[5],反应孔的颜色深浅与血清中的抗体含量成反比。阻断ELISA采用了单克隆抗体检测,可大大提高检测的特异性,但实际检测的对象却只是针对单一表位的抗体。因此,当阳性血清中针对该表位抗体丰度不高时,会导致检测的敏感性降低。
间接试剂盒基于间接ELISA原理[5],反应孔颜色深浅与结合在反应板中的特异性抗体的量成正比。由于间接ELISA检测的是针对包被抗原蛋白的多克隆抗体,因此会提高检测的敏感性;但如果包被抗原的特异性或纯化工艺不高,会导致较严重的非特异性反应,影响检测的特异性。
在进行田间大规模普查时,需要对某一地区,某一群体的整体免疫状况进行分析,因此对检测方法的敏感性要求较高。而针对某一规模化猪场来说,尤其是种猪场,需要对每头动物的抗体水平进行检测评价的同时,还要排除其他疫病阳性抗体的干扰,因此对检测方法的特异性要求较高。因此,上述两种ELISA检测方法具有各自的优势和局限性,在实际应用过程中,一定要对试剂盒的质量进行严格的甄选,并且根据实际应用对象选择适当的检测方法。
3.2 两种试剂盒与FVNT符合率差异 荧光抗体病毒中和试验(FVNT)是OIE推荐方法,为猪瘟抗体检测的“金标准”。此次试验所采用的猪瘟病毒荧光抗体为单克隆荧光抗体,引自英国AHVLA实验室,能够识别我国所有流行的猪瘟毒株[7],该株荧光单抗的使用,大大的提高了FVNT方法的敏感性与特异性。本次临床试验对两种ELISA抗体检测试剂盒检测结果存在差异的283份血清样本采用FVNT的方法进行了确认检测,结果显示,间接试剂盒与FVNT的符合率为69.26%,阻断试剂盒与FVNT的符合率为28.62%。不符合样本的确认结果表明,间接试剂盒能更真实地反映疫苗免疫后的中和抗体水平,而阻断试剂盒对阳性血清存在明显的漏检状况。
3.3 两种试剂盒检测结果与免疫背景之间的关系 猪瘟在田间的感染和流行情况较为复杂。在某些猪瘟流行地区,猪瘟疫苗免疫失败的情况比较常见。因此,田间采集的免疫血清中存在阴性血清。另外,某些仔猪会可能由于感染等原因产生猪瘟抗体,因此非免疫仔猪血清中也会有部分阳性血清。虽然存在一些不确定因素,但总体来说,一个地区的免疫状况基本能够反映该地区猪群的整体免疫水平。在此次的临床试验中,间接试剂盒和阻断试剂盒对免疫血清检测的阳性率分别为80.96%和67.07%,说明在临床的免疫血清中,确实存在一部分猪瘟抗体阴性血清;而对非免疫血清的阴性率检测结果分别为85.9%和78.72%,说明临床的非免疫血清中,存在阳性血清。因此对于田间采集的临床样本来说,如果以临床样本的免疫背景作为参考依据,间接试剂盒的敏感性和特异性均优于阻断试剂盒。
3.4 两种试剂盒检测结果产生差异的原因 在对1 621份田间样本进行检测时,两种试剂盒的总符合率为78.1%,较实验室研究结果低7.97%[6]。通过对各个地区的符合率结果分析发现,不同试验地区的符合率存在较大差异,最高为83.67%,最低仅为71.47%。从上述结果可以看出,由于各地区免疫状况复杂,不同地区猪群的抗体水平差异很大,导致临床试验中两种试剂盒的符合率也存在很大差异。而实验室研究中所检测的血清样本均采自生产状况良好、管理规范的规模化猪场,并且所有血清均经过FVNT方法的定性检测,因此实验室符合试验用阳性血清的抗体水平相对较高,检测结果更加容易判断。另外,不同地区、不同实验室人员的操作水平也是影响试剂盒符合率的一个重要原因。
4 结论
通过大量的田间试验数据表明,在我国猪瘟疫苗强制免疫的政策下,选择猪瘟病毒间接ELISA抗体试剂盒更适合我国实际情况。
[1]世界动物卫生组织.陆生动物诊断试验和疫苗手册(哺乳动物、禽鸟与蜜蜂)[M].5版.农业部畜牧兽医局/中国动物卫生与流行病学中心,译.2004.
[2]王骏,吴虹桥,宋兆琪,等.受试者作业特征曲线(ROC)及其在影像学中的应用[J].放射学实践,2000,15(3):201-202.
[3]杜雅丽,李道帆,李静,等.用ROC曲线评价心血管病危险因素聚集的相关因素及适宜切点的确定[J].广东医学,1999,24(9):993-995.
[4]陈卫中,倪宗瓒,潘晓平,等.用ROC曲线确定最佳临界点和可疑值范围[J].现代预防医学,2005,32(7):729-731.
[5]John R.Crowther,the ELISA guide book,Humana Press[M].2001.
[6]徐璐,范学政,徐和敏,等.猪瘟抗体间接ELISA检测试剂盒的研制和应用[J].中国兽医杂志,2012,48(9):21-24.
[7]Zhu Y,Shi Z,Drew T W,et al.Antigenic differentiation of classical swine fever viruses in China by monoclonal antibodies[J].Virus Res,2009,42(1-2):169-174.
