猪传染性胃肠炎病毒纤突蛋白抗原表位区的表达及其免疫原性分析
2014-11-23秦志华张明宇张传美
秦志华,张明宇,张传美,单 虎
(青岛农业大学山东省预防兽医学重点实验室,山东 青岛 266109)
猪传染性胃肠炎(TGE)是由冠状病毒科、冠状病毒属的猪传染性胃肠炎病毒(TGEV)引起的一种急性、高度接触性传染病,以呕吐、严重水样腹泻、脱水为特征。目前,世界上大多数国家免疫接种弱毒疫苗防治TGE,然而这些常规疫苗免疫存在成本高、易返祖、有潜在感染危险等缺陷[1]。因此,现在许多国家都在致力于基因工程疫苗的研究。
猪传染性胃肠炎病毒S蛋白突出于病毒粒子外,能够诱导机体产生保护性中和抗体,起到免疫保护作用[2]。S蛋白上含有A、B、C、D四个主要的抗原位点,所构成的抗原表位区产生的保护作用相当于整个S蛋白[3]。本文正是对S蛋白的抗原表位区进行免疫原性分析,为今后TGEV亚单位疫苗的研制和免疫保护性候选基因的筛选提供试验依据。
1 材料与方法
1.1 主要试剂及试验动物 His-Bind蛋白纯化回收试剂盒,购自Novagen公司;BamHⅠ和HindⅢ限制性内切酶,rTaq酶,购自宝生物工程(大连)有限公司;弗式佐剂,购自Sigma公司;体重约18 g,4~6周龄的SPF级昆明系小鼠,购自青岛派特福德白鼠养殖专业合作社。
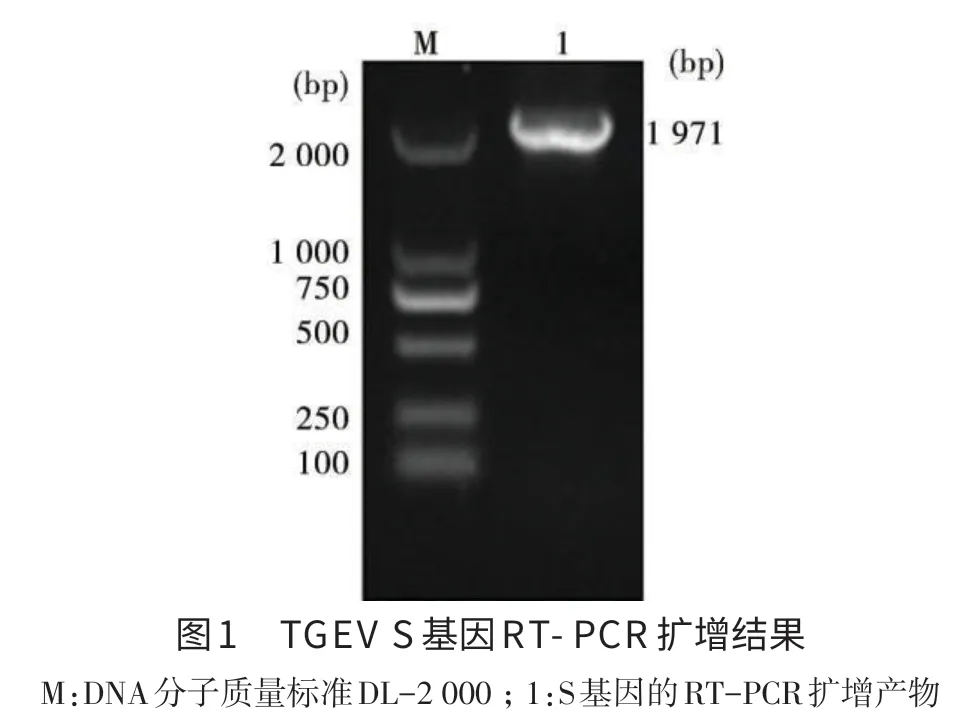
1.2 重组原核表达质粒pET30a-S的构建 根据GenBank收录的S基因序列(登录号:EU074218.2),利用Premier 6.0软件设计一对特异性引物P1:5′-CGGGATCCGGTAACCATTGGAATCTCA-3′,P2:5′-GCGAAGCTTGCAGGAATCTAGGTGTAGC-3′(分别加入BamHⅠ和HindⅢ酶切位点)。RT-PCR扩增产物大小为1 971 bp,包括S基因的抗原表位区。BamHⅠ和HindⅢ双酶切连接到pET30a质粒,鉴定后的阳性克隆送至北京六合华大基因科技股份有限公司测序分析。
1.3 重组质粒的诱导表达 将含重组质粒的菌液按1∶100比例重新接种于新鲜的LB液体培养基,37℃振荡培养至菌液浓度达OD600=0.6~0.8时,加入IPTG至终浓度为1.0 mmol/L,28℃诱导培养5 h,SDS-PAGE电泳鉴定蛋白表达情况。
1.4 Western-blot分析 将表达产物经半干式电转印转膜后,5%BSA封闭PVDF膜过夜,使用抗His标签兔多克隆抗体作一抗,羊抗兔IgG(HRP)作二抗孵育后进行ECL化学曝光。
1.5 试验动物分组及血清抗体水平的检测 将小鼠随机分成试验组和对照组,每组12只,其中试验组小鼠背部皮下注射纯化回收后的TGEV S蛋白,对照组注射生理盐水。初次免疫后每隔14 d加强免疫1次,共免疫3次。初免时蛋白免疫剂量为50 μg/只,加强免疫时蛋白免疫剂量为100 μg/只。分别于首免后第0天,14天,28天,42天采血,抗原包被浓度为2.5 μg/mL,血清抗体稀释度为1∶200时,间接ELISA检测免疫后小鼠的抗体水平。
2 结果
2.1 目的片段的扩增,克隆和鉴定 RT-PCR扩增产物经1%琼脂糖凝胶电泳鉴定,可见约1 971 bp的片段,与预期目的片段大小相符(见图1)。测序结果证明,已成功构建pET30a-S重组表达载体。
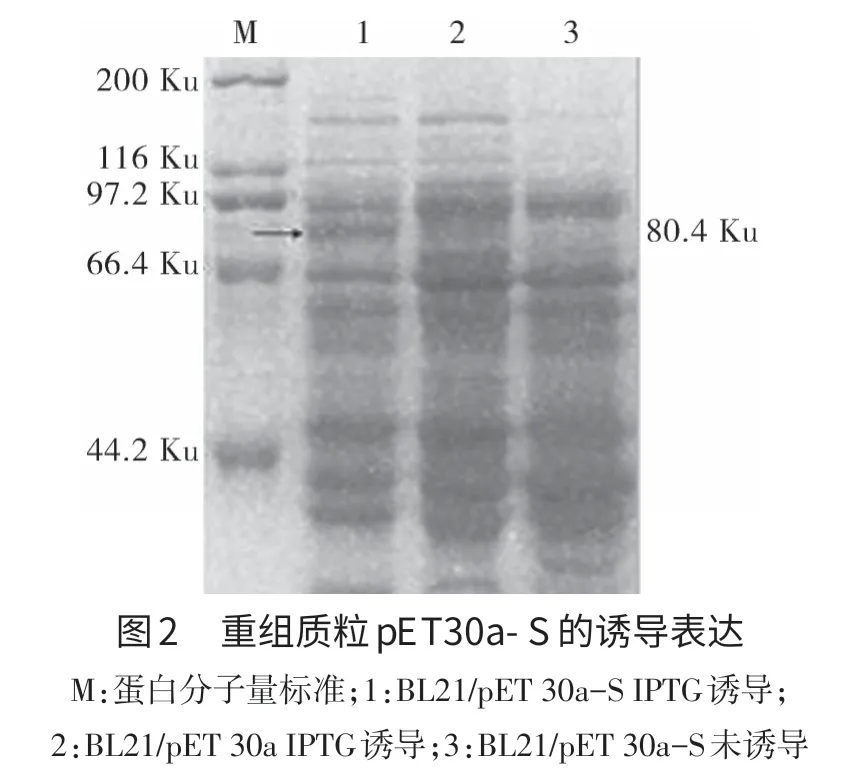
2.2 重组质粒的诱导表达结果 结果如图2显示,有80.4 Ku的与预期大小相符的目的蛋白条带,而在pET 30a空载体中则没有出现相应条带,说明该蛋白条带是由载体中目的基因所表达的。
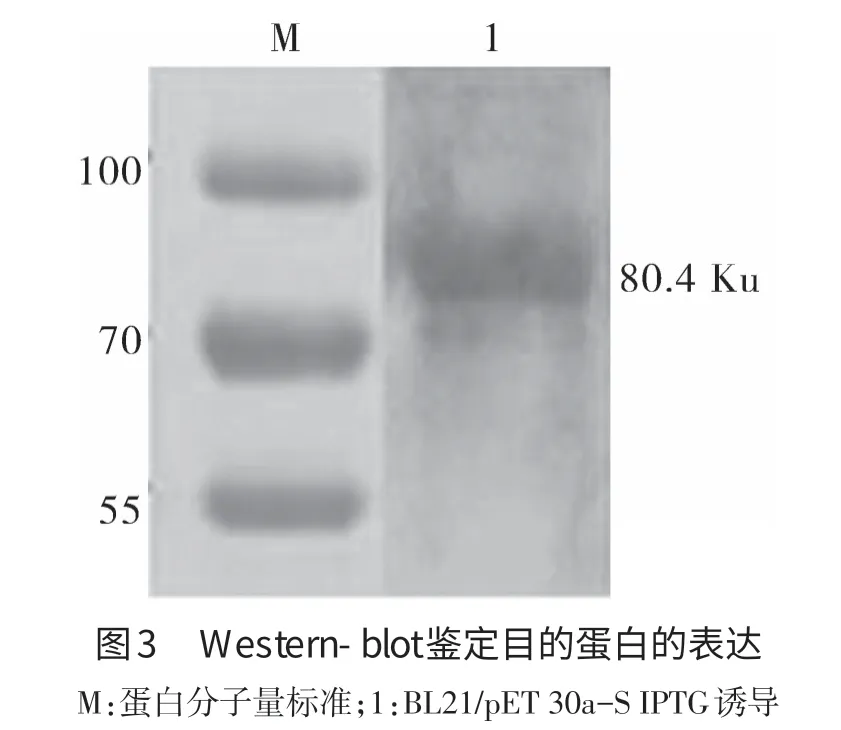
2.3 Western-blot分析 经Western-blot鉴定,将转印好的PVDF膜经一抗二抗孵育,ECL曝光后可见明显的特异性反应带(见图3),说明表达产物具有良好的抗原性。
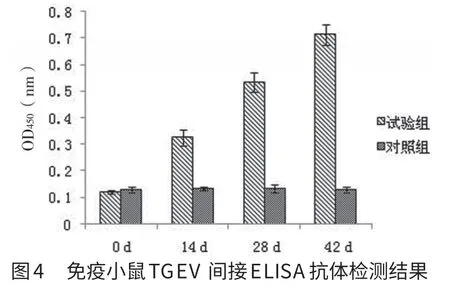
2.4 抗TGEV血清IgG抗体间接ELISA检测 从图4中可以看出,小鼠在免疫接种前均为TGEV抗体阴性。首免后第14天,试验组小鼠检测到抗体阳性,说明小鼠在免疫后产生了TGEV特异性抗体,随着免疫次数的增加,试验组抗体水平上升明显。在整个免疫过程中,对照组未检测到TGEV特异性抗体。
3 讨论
纤突(S)蛋白存在抗原位点、抗原亚位点和抗原决定簇3种水平的抗原结构,抗原分A、B、C、D四个位点,这些位点又可分为抗原决定簇,S蛋白共有11个抗原决定簇,其中5个是与中和作用相关的重要抗原决定簇[4]。S蛋白是惟一能诱导产生中和抗体和提供免疫保护作用的结构蛋白,所以S蛋白是基因工程研究的重中之重,尤其近年来国内外研究者在S蛋白的表达方面进行了不断的探索[6]。考虑到后期疫苗制备过程中的成本和效率问题,本研究初步选定使用原核表达系统进行蛋白表达,由于S基因编码序列全长为4.35 kb,若对S基因全基因进行克隆,可能会在蛋白表达过程中遇到困难,研究表明,A、B、C、D四个抗原位点诱导产生的保护作用相当于整个S蛋白,因此本试验结合前者的研究,基于S基因4个位点组成的抗原表位区设计引物,扩增出1 971 bp的目的片段,动物试验检测目的蛋白的免疫原性以验证其是否适合作为基因工程疫苗的潜在基因应用。
现已知TGEV的N蛋白在诱导产生细胞免疫应答中起着重要作用[6],在接下来的研究中可以设想将S蛋白和N蛋白共同表达。杨恒等[7]研究结果显示,S、N蛋白融合表达诱导的体液免疫和细胞免疫水平低于S蛋白单独表达,这可能是因为两个蛋白融合表达造成蛋白构象改变导致的,在进一步的研究中笔者认为可以尝试在S、N基因间插入一段接头序列(Linker)或构建双启动子表达载体。
本试验的结果显示,以猪传染性胃肠炎病毒S蛋白A、B、C、D四个抗原位点所表达的蛋白,能够刺激机体产生免疫反应,且有一定的效果,初步预示了其作为基因工程疫苗候选基因的可行性,这为猪传染性胃肠炎的防治提供了一个安全有效的途径,并为以后研究应用提供了可靠的保障和坚实的理论基础。
[1]Sirinarumitr T,Siddell S,Grahare F,et al.Porcine transmissible gastroenteritis virus induced apoptosis in swine testes cell cultures[J].Archives of Virology,1998,143(12):2471-2485.
[2]Barry J,Joseph MJilka,Lyle kesl,et al.A corn-based delivery system for animal vaccines:an oral transmissible gastroenteritis virus vaccine boosts lactogenic immunity in swine[J].Vaccine,2004,22(19):2420-2424.
[3]Ho P S,kang Jok,Lee Y K.Intragastric Administration of Lactobacillus casei Expressing Transmissible Gastroenteritis Coronavirus Sp ike Glycoprotein Induced Specific Antibody Production[J].Vaccine,2005,23(11):1335-1342.
[4]Peng S Y,Lv N,Zhang Y,et al.Immune response induced by spike protein from transmissible gastroenteritis coronavirus expressed in mouse mammary cell[J].Virus Res,2007,128(1/2):52-57.
[5]Penzes Z,Gonzalez J M,Izeta Z,et al.Complete genome sequence of transmissible gastroenteritis coronavirus PUR46-MAD clone and evolution of the purdue virus cluster[J].Virus Gene,2001,23(1):105-118.
[6]Liu C,Kokuho T,Kubota T,et al.DNA mediated inununization with encoding the nucleoprotein gene of porcine transmissible gastroenteritis virus[J].Virus Res,2001,80(l/2):75-82.
[7]杨恒,李春华,曹三杰,等.猪传染性胃肠炎病毒S、N基因核酸疫苗的构建与免疫原性试验[J].中国兽医学报,2011,11(31):1550-1554.
