盐酸多西环素注射液在猪体内药代动力学-药效学研究
2014-11-23黄耀凌胡海燕王亦琳徐士新
黄耀凌,徐 倩,胡海燕,王亦琳,孙 雷,徐士新
(中国兽医药品监察所,北京100081)
多西环素(Doxycycline)为四环素类抗生素,具有高效、长效、广谱等优点,广泛应用于兽医临床[1]。现国内外有较多关于多西环素制剂在猪、火鸡、羊等动物体内的药代动力学研究报道[2-4],但这些制剂消除半衰期较快,峰浓度相对较低。因此,本项目采用金属离子络合的方法,制备了缓释的盐酸多西环素注射液,以延长多西环素在动物体内的消除半衰期[5]。本研究旨在探讨自制盐酸多西环素注射液在猪体内的药物动力学规律,并通过药物剂量对时间-效应的关系(药代动力学(PK)/药效学(PD)参数),为制定合理的临床用药方案提供科学依据。
1 材料与方法
1.1 药品和试剂 20%盐酸多西环素注射液(规格:5 mL/瓶),批号为101021,自制,经测定含量为标示量的101.0%;盐酸多西环素对照品,含量为98.0%,批号 435239/1,BioChemika公司;乙腈、甲醇、乙酸乙酯、甲酸,色谱纯;氢氧化钠、Na2EDTA、Na2HPO4·12H2O、柠檬酸,分析纯。
1.2 仪器 超高效液相色谱仪:ACQUITY UPLC,美国Waters公司;组织匀浆机:日本NISSEI公司;低温高速离心机:德国Heldolph公司;涡旋混合仪:MS2德国 IKA公司;微量分析天平:AE240型,METTLER公司;氮吹仪:美国Organomation Associates公司;可微调加样器:德国Eppendorf公司;超纯水仪:美国 Millipore公司;SPE柱:HLB 3cc/60mg,美国Waters公司。
1.3 试验动物 三元杂交健康猪10头,雌雄各半,体重为15~50 kg,购自北京金牧阳实验动物养殖有限公司。试验前7 d,自由采食饮水,饲喂不加任何抗菌药物的全价配合饲料。试验前后各组饲养条件相同。
1.4 给药及血样采集 猪仰卧保定,颈部肌内注射药物,给药剂量按多西环素计均为10 mg/kg。前腔静脉采血,给药前采空白血样约5 mL。给药后,分别于 10、20、30、45 min 及 1、2、4、6、8、12、24、36、48、60、72 h采血。每次采血约6mL,置于肝素化的离心管中,3 000 r/min离心10 min,取血浆样品于-20℃冰箱保存,待测。
1.5 样品检测
1.5.1 血浆样品处理 取1mL待测血浆于50 mL离心管中,加入9 mL 0.1 mol/L Mcllvaine-Na2EDTA缓冲液,旋涡混匀1 min,15000 r/min高速离心5 min,取上清液于另一离心管备用。HLB固相萃取小柱,依次用甲醇、水各5 mL预洗。取上述上清液过柱,依次用水、5%甲醇水溶液各5 mL淋洗,减压抽干,用甲醇-乙酸乙酯溶液(1+9,V/V)3 mL洗脱,洗脱液用氮气吹干(温度低于40℃)。用20%乙腈水0.5 mL溶解残留物,过0.22 μm微孔滤膜后供Waters超高效液相色谱仪测定。
1.5.2 色谱条件 色谱柱:BEH C18(50 mm×2.1 mm,1.7 μm);流动相:0.3%的甲酸乙腈溶液-0.3%的甲酸水溶液(18+82,V/V);流速:0.6 mL/min;柱温:20℃;样品温度:15℃;进样量:5 μL。
1.6 数据分析 采用药代动力学软件WinNonlin6.3对血药浓度-时间数据处理,计算药代动力学参数。
2 结果与分析
2.1 血浆多西环素标准曲线制备 取空白血浆样品添加盐酸多西环素标准溶液使添加浓度为25、50、100、250、1000、2000、4000 μg/L(以多西环素计,如下同),经前处理后,供超高效液相色谱仪测定。将结果进行相关与回归分析,得到线性回归方程为:Y=18.189X-472.07,相关系数为0.9998。
2.2 检测限和定量限 按照《兽用化学药物临床药代动力学试验指导原则》的要求,对添加浓度为12.5 μg/L的样品,经提取后进行测定,LOD大于3倍信噪比,为方法的检测限;对添加浓度为25 μg/L的样品,经提取后进行测定,LOQ大于10倍信噪比,且准确度和精密度符合残留检测方法的要求,因此25 μg/L的添加浓度为方法的定量限。
2.3 回收率、准确度与精密度 取空白血浆1.0 mL,添加多西环素标准溶液使血浆中盐酸多西环素的浓度分别为 25、250、2000 μg/L三个不同浓度,各浓度取5个样品进行平行试验,重复3次,样品经处理后进超高效液相色谱测定,计算样品的浓度、回收率、批内、批间变异系数。结果如表1所示,样品在25~2000 μg/L添加浓度范围内,回收率在85% ~105%之间,批内变异系数为1.8% ~10%,批间变异系数为2.4% ~10%,符合方法学要求,可用于血药浓度检测。
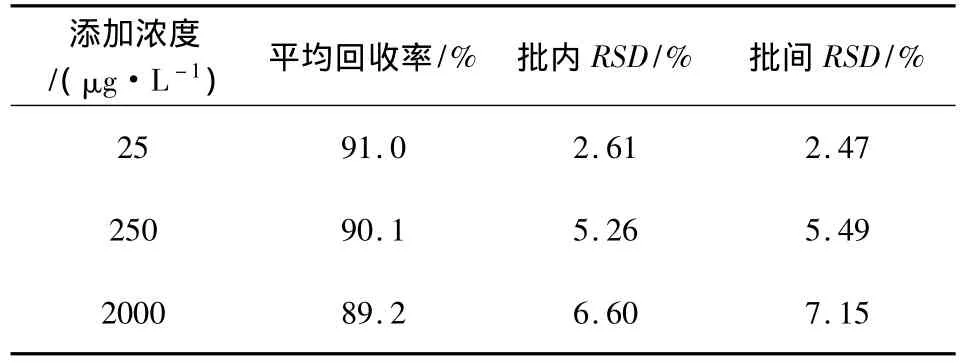
表1 猪血浆中添加盐酸多西环素的回收率与精密度表(n=5)
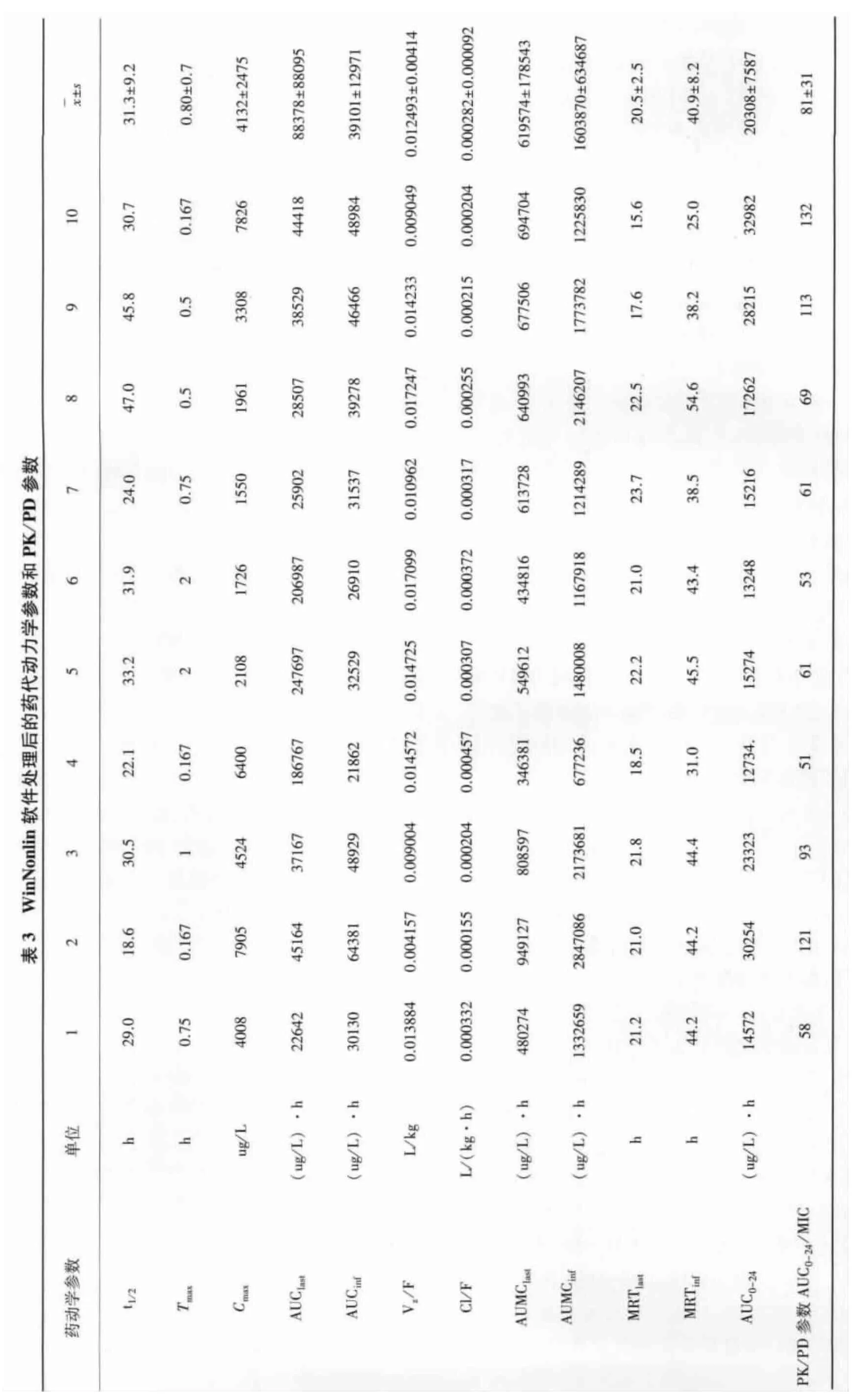
2.4 血药浓度数据与药代动力学参数 每头猪血药浓度-时间数据见表2,血药时间曲线见图1。药动学数据表明部分猪血浆中药物浓度在给药后,峰浓度之前,有迅速上升,甚至初始血药浓度高于峰浓度的突释(双峰)情况,不符合典型的房室模型,因此采用非房室模型分析血药浓度-时间数据。药代动力学参数见表3,结果显示,药物在猪体内的 t1/2为(31.3 ±9.2)h,Tmax为(0.80 ±0.7)h,Cmax为(4132 ±2475)μg/L,AUC 为(88378 ±88095)(μg/L)·h,MRT为(20.5±2.5)h。空白血浆、空白添加血浆样品和给药后的血浆样品色谱图分别见图2-图4,显示多西环素的保留时间约为2.3 min,其峰形良好。
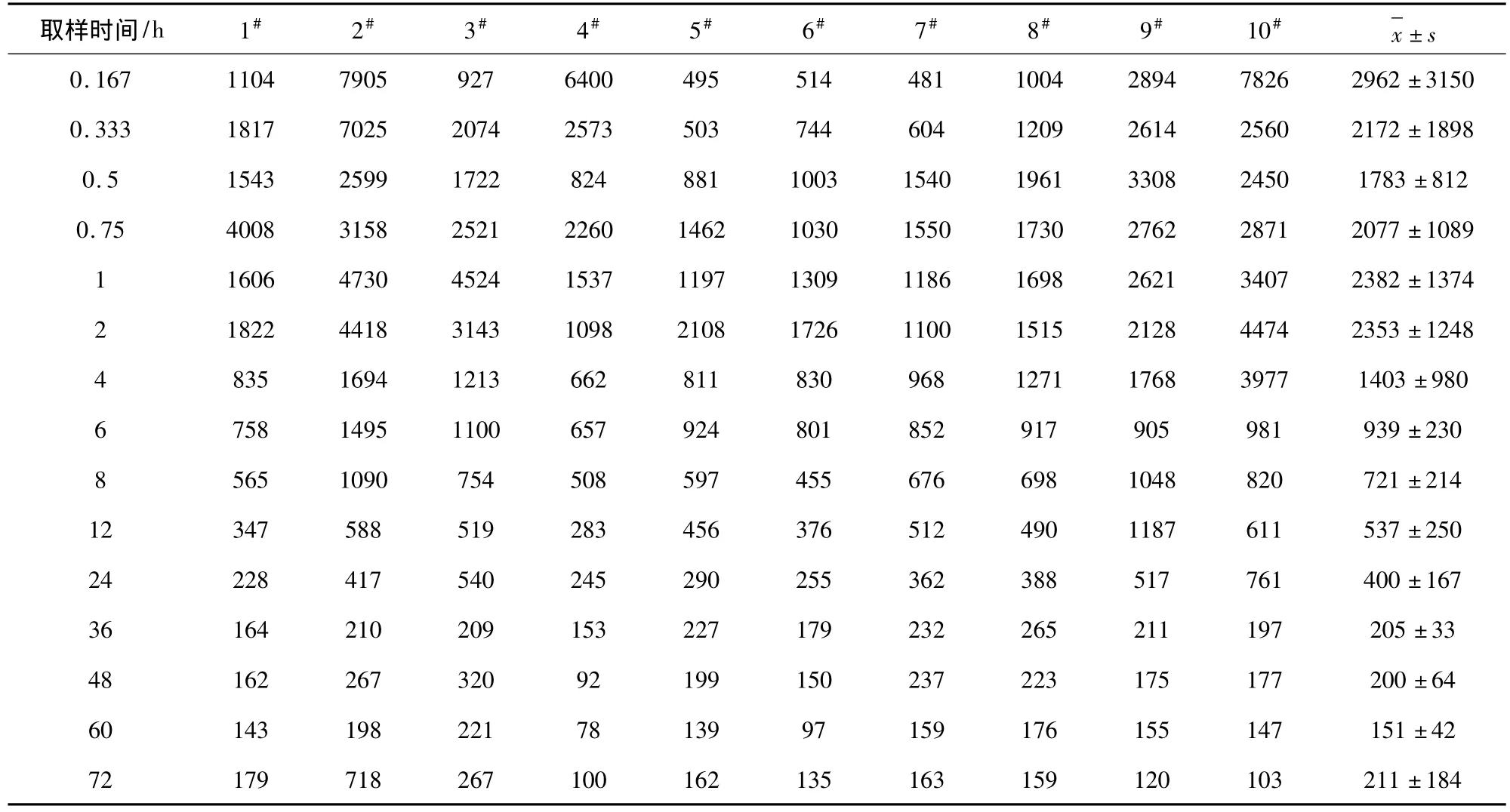
表2 盐酸多西环素注射液给药后1#~10#猪各时间点的血药浓度 (μg/L)
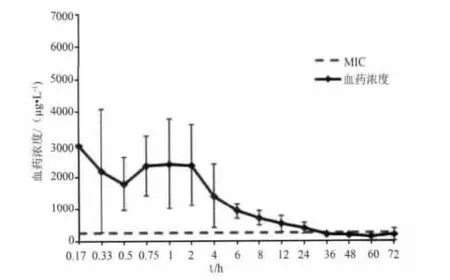
图1 猪肌内注射盐酸多西环素注射液的血药浓度-时间曲线图
2.5 PK/PD参数选择给药方案 根据文献资料,多西环素对敏感菌的MIC接近0.25 mg/L[6-10],对猪肺炎支原体(四个菌株)的MIC小于0.12 mg/L[11]。血药浓度-时间对数药动曲线图中,以多西环素对大多敏感菌MIC(250 μg/L)作横线与曲线相交,显示给药后24小时血药浓度均高于MIC。表明药物对猪常见病原菌有良好的抑制作用。多西环素为时间依赖性药物[12],采用 PK/PD参数 T>MIC选择给药方案[13-14]。一般,当%T>MIC在40% ~50%[15-17]时,药物发挥有效疗效。根据MIC数据和试验中血药浓度数据,T>MIC约为24 h,AUC0-24/MIC比值在50~130(表3)范围,表明盐酸多西环素注射液以10 mg/kg剂量肌内注射,两天给药一次为宜。
图2 空白猪血浆色谱图
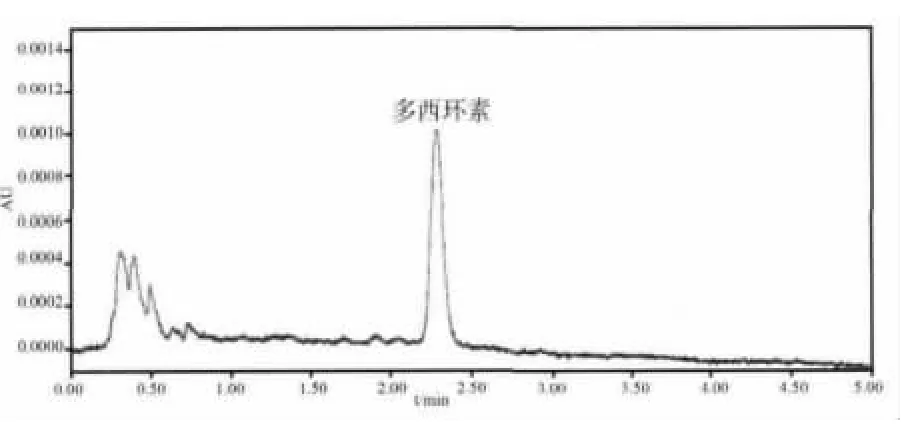
图3 空白猪血浆添加盐酸多西环素250μg/L浓度点的色谱图
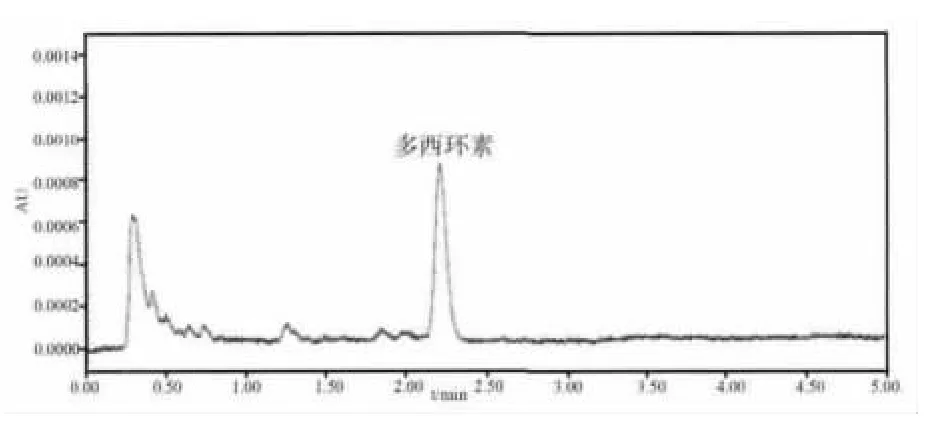
图4 给药后猪血浆样品色谱图
?
3 讨论与小结
3.1 药动学特征 在药动学数据处理时,采用了非房室模型,这是由于部分试验动物在给药之后,出现了血药浓度突释(双峰)现象。这可能是因为自制产品采用螯合反应将多西环素与金属离子络合,但在产品制备过程中,仍有部分多西环素未完全与金属离子络合,在给药后,游离部分的多西环素迅速进入血液循环。另外,动物个体差异等因素也造成对药物吸收的不均等,因此表现出给药后,峰浓度之前出现的血药浓度迅速上升。而血药浓度迅速上升并保持在较高浓度,发挥了快速抗菌作用,从而克服了缓释制剂给药后缓慢释放不能有效快速发挥抑菌或杀菌效果的缺点。
杨海峰[18]报道,普通多西环素注射液给猪10 mg/kg剂量肌内注射,t1/2β为 5.21 h 和 Cmax为2.31 mg/L;何家康[19]报道,猪以 10 mg/kg 剂量肌内注射盐酸多西环素注射液,MRT为15.18 h,Cmax为2.0 mg/L。与其他长效或缓释多西环素制剂相比,以同等剂量猪肌内注射,杨海峰[18]报道的长效多西缓释注射液,t1/2β为11.07 h和Cmax为1.24 mg/L;何家康[19]的缓释盐酸多西环素注射液,MRT为22.25 h,Cmax为 3.32 mg/L;班付国[20]报道的长效缓释多西环素注射液,t1/2β为 9.63 h和 Cmax为1.69 mg/L。而本项目研制的盐酸多西环素注射液,Tmax为 0.8 h,Cmax为 4132 μg/L,t1/2为 31.3 h,MRT为20.5 h。与上述的多西环素注射液相比,自制产品MRT更长,表明具有良好的长效作用。这其中原因与自制产品在制备过程中采用适宜的有机溶媒,以及药物与金属离子形成络合物,使在体内延缓了药物的释放有关。
3.2 给药方案选择 近年来,不少研究者通过药代动力学和药效学之间的关系来评价兽药对病原微生物的作用[13-16]。目前,被用来评价兽用抗菌药对微生物发挥有效疗效的PK/PD参数有Cmax/MIC,AUC/MIC 和%T>MIC。其中,参数 Cmax/MIC或AUC/MIC多用于浓度依赖性药物的评价;参数%T>MIC或AUC/MIC用于时间依赖性药物的评价,AUC/MIC主要用于中度和高度PAE时间依赖性药物的评价[13-17]。一 般,当%T>MIC占 40% ~50%[15-17]或 Cmax/MIC 比例为8~10 时[21],药物发挥有效疗效。而AUC/MIC比值在不同药物表现并不相同,虽然研究表明,氟喹诺酮类药物在AUC/MIC在100~125范围时,可以取得较为理想的疗效,但还没有证据可以将这个比值应用到其他抗菌药物[13]。
2007 年,Burgess发现四环素类药物在AUC/MIC>25时,治疗效果≥95%[9]。2013 年的报道也证明,当多西环素AUC/MIC>25时,治疗效果≥90%[10]。又据报道,多西环素对敏感病原菌的 MIC 为0.05 ~0.20 μg/mL[8-11]。Schreiner在对人的试验中,发现当MIC≤0.2 μg/mL时,患者治愈率接近95%[22]。Maaland试验认为,多西环素的敏感折点为0.125 mg/L[10]。因此在进行该制剂PK/PD参数计算时,MIC设定为0.25 μg/mL。
由于多西环素为中度时间依赖性药物,因此PK/PD参数%T>MIC和AUC/MIC可以作为评价其疗效的指标。根据MIC(0.25 μg/mL),比较试验的药时数据,超过MIC的时间(T>MIC)约为24 h。根据%T>MIC占40% ~50%时,药物可发挥有效的疗效,因此确定该制剂给药间隔可为两天一次。而根据表3结果,多西环素AUC/MIC比值>50,说明多西环素以10 mg/kg剂量给药有较好的治疗效果。因此,确定自制的盐酸多西环素注射液推荐给药方案为10 mg/kg剂量肌内注射,两天给药一次为宜。
本项目研制的盐酸多西环素注射液在猪体内具有吸收快,血药浓度较高,消除时间长的特点,而且以10 mg/kg肌内给药的PK/PD参数%T>MIC和AUC/MIC比值满足治疗要求。这说明,该注射液适用于猪的临床疾病治疗。
[1]李 伟,杨 阳.多西环素的药理学进展及临床应用概述[J].广东畜牧兽医科技,2009,(6):34:3-5.
[2]Riond J L,Riviere J E.Pharmacokinetics and metabolic inertness of doxycycline in young pigs[J].Am J Vet Res,1990,51(8):1271-1275.
[3]Croubels S.Vermeersch H.Backer P D,et a1.Liquid chromatographic separation of doxycycline and 4-epidoxycycline in a tissue depletion study of doxycycline in turkeys[J].J Chromatogr B,1998,708:145-152.
[4]Yamaoka K,Nakagaw T,Uno T.Application of Akaike’s information criterion(AIC)in the evaluation of linear pharmacokinet equations[J].J Pharmacokinetics Biopharm,1978,6:165-175.
[5]刘 伟.长效土霉素注射液的研制及其药动学研究[D].四川农业大学,2011.
[6]Brook I,Elliott T B,Pryor H I,et al.In vitro resistance of Bacillus anthracis Sterne to doxycycline,macrolides and quinolones[J].International Journal of Antimicrobial Agents,2001,18(6):559-562.
[7]Alexander A F,Sergey N V,Irene Y L,et al.Prevention of the selection of resistant Staphylococcus aureus by moxifloxacin plus doxycycline in an in vitro dynamic model:an additive effect of the combination[J].International Journal of Antimicrobial Agents,2004,23(5):451-456.
[8]Lever M S,Bewley K R,Dowsett B,et al.In vitro susceptibility of Coxiellaburnetii to azithromycin,doxycycline,ciprofloxacin and a range of newer fluoroquinolones[J].International Journal of Antimicrobial Agents,2004,24(2):194-195.
[9]Burgess D S,Frei C R,Lewis Ii J S,et al.The contribution of pharmacokinetic-pharmacodynamic modelling with Monte Carlo simulation to the development of susceptibility breakpoints for Neisseria meningitidis[J].Clin Microbiol Infect,2007,13(1):33-39.
[10]Maaland M G,Papich M G,Turnidge J,et al.Pharmacodynamics of doxycycline and tetracycline against Staphylococcus pseudintermedius:proposal of canine-specific breakpoints for doxycycline[J].J Clin Microbiol,2013,51(11):3547-3554.
[11]张纯萍,沈青春,胡海燕,等.猪肺炎支原体体外抗菌药物敏感性试验研究[J].中国兽药杂志,2013,47(4):10-12.
[12]Agwuh K N and MacGowan A.Pharmacokinetics and pharmacodynamics of thetetracyclines including glycylcyclines[J].Journal of Antimicrobial Chemotherapy,2006,58:256-265.
[13]Toutain P.Pharmacodynamics/pharmacokinetics integaraion in dosage regimen optimisation for veterinary medicine[J].Journal of Veterinary Pharmacology and Therapeutics,2003,26(Supplement 1):1-18.
[14]王 睿.抗菌药物pk/pd参数对合理设计给药方案的意义[J].中国药师,2003,6(12):806-809.
[15]Kim A,Banevicius M A and Nicolau D P.In vivo pharmacodynamic profiling of doripenem against Pseudomonas aeruginosa by simulating human exposures[J].Antimicrob Agents Chemother,2008,52:2497-2502.
[16]Bowker K E,Noel A R,Tomaselli S G,et al.Pharmacodynamics of the antibacterial effect of and emergence of resistance to doripenem inPseudomonas aeruginosa and Acinetobacter baumannii in an in vitro pharmacokinetic model[J].Antimicrob Agents Chemother,2012,56(10):5009-5015.
[17]陈佰义.PK/PD理论指导下的优化抗菌治疗[J].中华临床感染病杂志,2009,2(2):69-70.
[18]杨海峰,覃少华,王加才,等.2种多西环素注射液在健康猪体内的药动学比较[J].华中农业大学学报,2007,26:76-79.
[19]何家康,祝万菊,周丽光,等.盐酸多西环素缓释注射液在猪体内的药物动力学[J].中国兽医学报,2008,2(28):175-180.
[20]班付国,吴宁鹏.两种盐酸多西环素注射液在猪体内的药代动力学研究[J].中国兽药杂志,2013,47(8):22-25.
[21]Burch D G S,Ripley P and Burrows M.Colon contents concentration and area under the curve/minmum inhibitory concentration relationships for valnemulin-prevention,treatment and elimination of swine dysentery[J].Pig Journal,2004,54:198-205.
[22]Schreiner A,Digranes A.Pharmacokinetics of lymecycline and doxycycline in serum and suction blister fluid[J].Chemotherapy,1985,31:261-265.
