鸡肉和鸡蛋中金刚烷胺与金刚乙胺残留检测UPLC-MS/MS法研究
2014-11-23毕言锋王亦琳王鹤佳徐士新
尹 晖,孙 雷,毕言锋,王亦琳,王鹤佳,徐士新
(中国兽医药品监察所,北京100081)
金刚烷胺和金刚乙胺属于三环胺类抗病毒药物(化学结构式见图1),在人类上有广泛应用。但是,将人用抗病毒药物用于畜禽,不仅容易导致动物性食品中药物残留、动物中毒、动物机体产生免疫抑制和耐药性等问题,还可导致病毒发生变异,影响动物疫病控制及人用抗病毒药物的有效性[1-2]。我国农业部2005年第560号公告明确规定金刚烷胺和金刚乙胺等抗病毒药物在兽医上禁止使用,美国FDA于2006年也禁止将金刚烷胺和金刚乙胺等人类抗病毒药物用于畜禽类。因此,急需要建立动物性食品中该类药物的残留检测方法,以加强对该类药物的残留监管,有效保护人类健康。目前我国动物性食品中该类药物残留检测方法的报道较少,少数的报道主要集中在液相色谱法[3]、气相色谱法[4-5]和液相色谱 - 串联质谱法[6-9]。液相色谱-串联质谱法具有高效分离和多组分定性、定量的优点,因此成为近年兽药残留检测方法研究的主要方法,本研究以鸡肉和鸡蛋为试材,建立了同时可以检测金刚烷胺和金刚乙胺两种药物的UPLC-MS/MS检测方法,以有效解决此类药物在鸡肉和鸡蛋中的检测方法的欠缺,本方法灵敏度高、定性准确、前处理快速简便,为该类药物的残留情况进行有效监管提供了科学依据。

图1 金刚烷胺和金刚乙胺的化学结构式
1 材料与方法
1.1 仪器 Acquity UPLC-Quattro Premier质谱联用仪,Waters公司;AE260电子天平,Mettler Toledo公司;Biofuge Strators高速冷冻离心机,贺利氏公司;Organomation Associates氮吹仪,Jnc公司;SIR4漩涡混合器,IKA公司。
1.2 药品和试剂 金刚烷胺,纯度为99%;盐酸金刚乙胺,纯度为99.9%;金刚烷胺 -D6,纯度为99.8%,均购自北京振翔科技有限公司;甲酸、乙腈为色谱纯,均购自MERCK公司;无水硫酸钠、正己烷均为分析纯;所用水为超纯水。
1.3 对照溶液配制 精密称定金刚烷胺和金刚乙胺对照品适量,置于10 mL棕色量瓶中,用甲醇溶解并稀释成浓度为1 mg/mL的标准储备液;量取标准储备液适量,用甲醇稀释成10 μg/mL的标准工作液,再用20%乙腈稀释成100 ng/mL的标准工作液。
1.4 测定方法
1.4.1 色谱条件 色谱柱为BEH C18(50×2.1 mm,1.7 μm),流动相A相为0.1%甲酸乙腈溶液,B相为0.1%甲酸水溶液(梯度洗脱条件见表1),流速0.3 mL/min,柱温30 ℃,进样量10 μL。
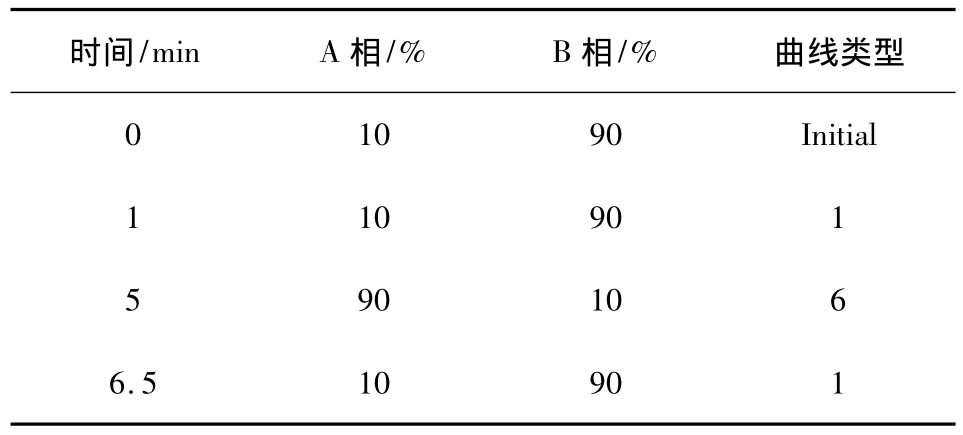
表1 流动相梯度洗脱条件
1.4.2 质谱条件 电喷雾离子源(ESI+),毛细管电压为3.0 kV,萃取电压为2.0 V,RF透镜电压为0.5 V,源温为110℃,雾化温度为350℃,雾化气速为650 L/h,锥孔气流速为50 L/h。多反应监测离子情况见表2。

表2 金刚烷胺及内标、金刚乙胺的特征离子、锥孔电压和碰撞能量
1.4.3 定性与定量 定性时试样溶液中色谱峰的保留时间,应与校正溶液的保留时间一致,容许偏差为±5%,试样溶液中的离子丰度比应与校正溶液的一致,容许偏差符合欧盟2002/657/EC决议要求。定量时金刚烷胺采用同位素内标法定量,金刚乙胺通过基质匹配标准溶液采用外标法定量。
1.4.4 标准曲线绘制 分别精密量取适量的金刚烷胺和金刚乙胺标准工作液,制得浓度为2、5、10、20、50、100 ng/mL(含金刚烷胺 -D6为 100 ng/mL)的系列对照溶液,以金刚烷胺特征离子质量色谱峰与内标峰面积比、金刚乙胺特征离子质量色谱峰面积为纵坐标,对照溶液浓度为横坐标,绘制标准曲线。
1.4.5 样品前处理过程 称取(2±0.02)g匀质的鸡肉或鸡蛋样品于50 mL离心管内,加3 g无水硫酸钠,再加入1%甲酸乙腈10.0 mL,涡旋1 min,然后水平震荡提取10 min,8000 r/min离心8 min,取5.0 mL上清液于温度50℃下氮气吹干,加入20%乙腈溶液1.0 mL,充分涡旋溶解,再加入20%乙腈溶液饱和的正己烷2 mL,充分涡旋混合,然后室温下静置5 min,吸取下层溶液0.5 mL,转移至1.5 mL塑料离心管内,12000 r/min离心5 min,取下层清液适量,过0.2 μm滤膜后供UPLC-MS/MS法测定。
1.4.6 方法灵敏度确定 将适量金刚烷胺和金刚乙胺加入到空白鸡肉和鸡蛋中,制成0.5、1、2 ng/g三个浓度添加样品,经上述方法进行前处理后,用UPLC-MS/MS检测,观察药物特征离子质量色谱峰信噪比(S/N)和对应药物浓度,S/N>3者定其为方法的检测限;S/N>10者定其为方法的定量限。
1.4.7 准确度和精密度的测定 采用标准添加法,在空白鸡肉和鸡蛋中各添加2、5、10 ng/g三个不同浓度药物进行回收率试验,各浓度进行5个样品平行试验,重复3次,求批内、批间RSD。
2 结果
2.1 标准曲线 按照上述系列标准溶液浓度进行线性回归,得到的回归方程及变异系数见表3。从表中可以看出金刚烷胺和金刚乙胺在2~100 ng/mL浓度范围内均呈现良好的线性关系,R2分别为0.9977和0.9988。

表3 金刚烷胺和金刚乙胺线性回归情况
2.2 方法灵敏度 按上述方法进行处理,当添加浓度为2 ng/g时,测得金刚烷胺和金刚乙胺的S/N>10,说明方法定量限为2 ng/g。当添加浓度为1 ng/g时,测得两种药物S/N>3,表明方法检测限为1 ng/g。2 ng/g添加试液中金刚烷胺、金刚乙胺及金刚烷胺-D6特征离子质量色谱图见图2、图3。
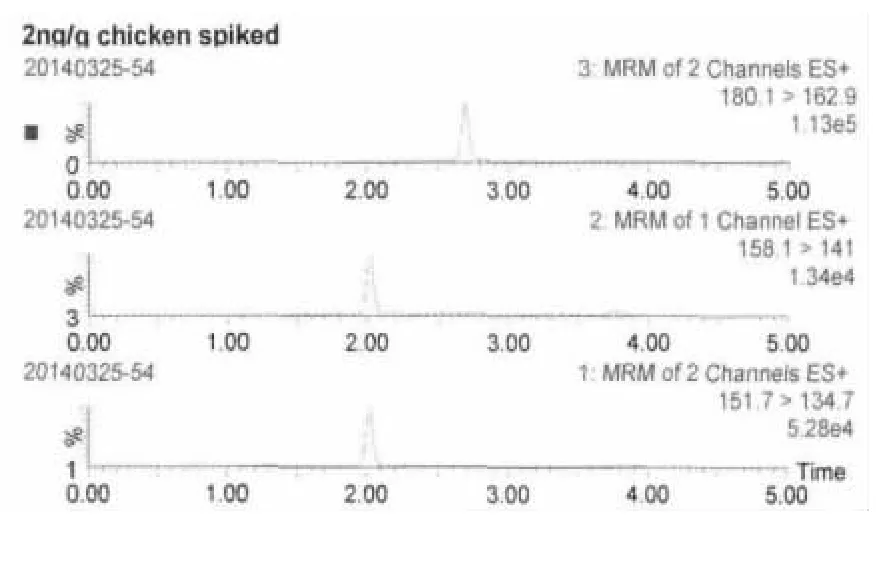
图2 2 ng/g空白鸡肉添加试液中药物及内标特征离子质量色谱图

图3 2 ng/g空白鸡蛋添加试液中药物及内标特征离子质量色谱图
2.3 方法准确度和精密度 在空白鸡肉和鸡蛋中各添加三个不同浓度金刚烷胺和金刚乙胺进行回收率试验,结果汇总见表4、表5。可以看出鸡肉中金刚烷胺平均回收率为79.6% ~107.5%,批内RSD为4.4% ~6.8%,批间RSD为6.1% ~7.1%;金刚乙胺平均回收率为78.4% ~101.2%,批内RSD为1.4% ~19.3%,批间RSD为2.5% ~11.3%。鸡蛋中金刚烷胺平均回收率为90.8%~111.1%,批内 RSD为3.7% ~11.7%,批间 RSD为7.4% ~9.2%;金刚乙胺平均回收率为75.4% ~87.4%,批内RSD为2.1% ~8.4%,批间RSD为5.0%~6.9%。可以看出,鸡肉和鸡蛋样品中两种药物的回收率均在70% ~120%之间,批内和批间RSD均小于15%。

表4 鸡肉中金刚烷胺和金刚乙胺添加回收率试验结果

表5 鸡蛋中金刚烷胺和金刚乙胺添加回收率试验结果
3 讨论
金刚烷胺和金刚乙胺属于三环胺类抗病毒药物,含有氨基,属于有机碱,在酸性溶液中易溶于水,因此,样品前处理时采用含有甲酸的乙腈溶液进行提取,用正己烷去除脂肪,采用高速离心的方式进一步去除蛋白质等杂质,通过样品测试发现净化效果较为理想,优化了样品前处理方法。鸡肉和鸡蛋等动物性食品基质较为复杂,通过充分的提取净化后该类药物在质谱检测时仍存在基质带来的影响。在流动相中加入0.1%甲酸溶液有利于化合物的离子化,并通过实验对比确定了最佳洗脱梯度,优化了液相色谱分离条件。通过对方法线性、灵敏度、回收率和精密度等技术参数的考察,发现均能满足残留检测方法的要求,另外,该方法简便、快速、杂质干扰少,是一种理想的确证检测方法。
[1]陆学胜,朱天夫,许 敏,等.金刚烷胺对帕金森病患者角膜内皮细胞损害作用的研究[J].世界临床药物,2010,31(7):417-421.
[2]叶金朝,叶 菲.美多巴及金刚烷胺诱发精神分裂症及下肢水肿病案分析[J].药物流行病学杂志,2002,11(4):219-220.
[3]朱胜平,钟 华,何 飞,等.高效液相色谱法测定盐酸美金刚烷胺片的含量[J].中南药学,2005,3(4):209-210.
[4]徐文彤,刘 红.气相色谱法测定硫酸金刚烷胺的含量[J].中国药师,2007,10(11):1082-1083.
[5]姜大为,范振莉.气相色谱法测定硫酸金刚烷胺的含量[J].黑龙江科技信息,2012,(7):32-32.
[6]刘正才,杨 方,余孔捷,等.液相色谱-电喷雾串联质谱法同时检测鸡组织中5种抗病毒类药物的残留量[J].色谱,2012,30(12):1253-1259.
[7]李 彦,关丽丽,牟 妍,等.QuEChERS-UPLC-MS/MS检测畜禽组织中金刚烷胺残留[J].食品研究与开发,2013,(23):37-40.
[8]陈慧华,韦敏珏,周 炜,等.液相色谱-串联质谱法测定动物组织中金刚烷胺和金刚乙胺的残留量[J].质谱学报,2013,34(4):226-232.
[9]魏秀丽,高迎春,陈 玲,等.超高效液相-串联质谱法测定鸡肉组织中金刚烷胺残留[J].中国兽药杂志,2013,47(6):53-55.
