赤芍、白芍煎剂对金黄色葡萄球菌诱导肺炎小鼠血清HMGB1水平影响的比较
2014-11-23王渠源李璐璐
陈 瑶,马 倩,张 莉,王渠源,李璐璐,聂 奎
(西南大学动物科技学院,重庆400715)
近年来,研究发现高迁移率族蛋白(High Mobility Group Protein,HMG)家族成员的HMGB1是一种重要的晚期炎症介质,参与了多种疾病的发生发展,在内毒素的致病过程和脓毒症中水平增高[1]。赤芍和白芍作为两种传统中药材,赤芍具有清热凉血,散瘀止痛功效,医学临床主要用于改善心血管系统、抗炎、抗肿瘤、抗氧化等[2];而白芍有养血调经,平肝止痛,敛阴止汗的作用,临床上用于抗炎、解痉、镇痛、护肝等[3]。鉴于赤芍、白芍都具有一定的抗炎功效,因此,采用炎症介质HMGB1水平的变化来比较两种芍药的抗炎作用,这对治疗脓毒症等晚期炎症的中药研究,尤其是为含赤芍、白芍的中药方剂的拆方研究奠定一定的药理基础。
1 材料与方法
1.1 材料
1.1.1 动物 昆明种健康小鼠70只,体重18~22 g,雌雄各半,购自重庆市中药研究院,批号:SCXK(渝)2012-0006。小鼠饲养于西南大学动物医院动物房,分组后分笼饲养。
1.1.2 试剂 赤芍、白芍购自重庆中药材市场。金黄色葡萄球菌标准菌株由重庆市动物疫病预防控制中心提供。地塞米松,西南药业股份有限公司,批号:120105。小鼠HMGB-1 ELISA试剂盒,美国Promega公司。
1.1.3 仪器 旋转蒸发器,上海亚荣生化仪器厂;切片机,德国Leica公司;ELX405TM洗板机,美国Biotek公司;Thermo酶标仪,美国Thermo fisher公司。
1.2 方法
1.2.1 赤芍、白芍煎剂制备 参照杨琪伟等[4]的方法,用水提醇沉法制备赤芍、白芍煎剂,使每毫升含生药1 g,灭菌后放入4℃冰箱冷藏保存。
1.2.2 小鼠肺炎模型建立 将金黄色葡萄球菌增菌培养,调整菌液浓度至1×109CFU/mL,参照刘颖等[5]的方法,用乙醚将小鼠麻醉,取金黄色葡萄球菌菌液对小鼠滴鼻感染(50 μL/只),建立金黄色葡萄球菌小鼠吸入性肺炎模型。
1.2.3 试验分组及给药 按随机数字法随机将70只小鼠随机分为5组:空白对照组、肺炎模型组、赤芍处理组、白芍处理组和地塞米松处理组。每组14只。金黄色葡萄球菌小鼠吸入性肺炎模型建立1 h后按组别进行药物处理,空白对照组、肺炎模型组小鼠给予生理盐水。各组均灌胃给药,剂量均为0.01 mL/g。之后每12 h给药一次,共6次。
1.2.4 血液样本采集 分别于金黄色葡萄球菌感染小鼠后 18、36、48、60、72 h每组随机选择小鼠 5只,采集小鼠尾部血液,将采集的血液离心得血清,分装标记后置-20℃保存备检。
1.2.5 石蜡切片制作 在72 h血液采集完成后处死小鼠,开胸摘取小鼠肺组织并投入固定液,按常规组织切片方法[6]:取材固定、脱水透明、浸蜡包埋、切片贴片、HE染色、脱水透明、封片,并进行镜下观察。
1.2.6 HMGB1检测 用ELISA法检测小鼠血清中HMGB1水平,按试剂盒所附的说明书进行操作。
2 结果
2.1 小鼠肺炎模型建立 感染小鼠12 h后,随机解剖感染后的小鼠和未经处理的小鼠各3只。经观察,感染小鼠肺组织均充血、肿大;未处理的小鼠肺组织均正常。金黄色葡萄球菌小鼠吸入性肺炎模型建立成功。
2.2 HMGB1含量变化 肺炎模型组小鼠与空白对照组小鼠相比,肺炎模型组小鼠HMGB1浓度值于感染小鼠后 18、36、48、60、72 h 均高于空白对照组,差异极显著(P<0.01)。赤芍处理组、白芍处理组、地塞米松处理组小鼠与肺炎模型组小鼠相比,赤芍处理组HMGB1浓度值于感染金黄色葡萄球菌后36 h时显著低于肺炎模型组,于48、60、72 h时极显著低于肺炎模型组;白芍处理组HMGB1浓度值于48、60、72 h极显著低于肺炎模型组;地塞米松处理组HMGB1浓度值分别于48、60、72 h极显著低于肺炎模型组。白芍处理组、赤芍处理组与地塞米松处理组相比,白芍处理组于18、60 h时显著、极显著低于地塞米松处理组;赤芍处理组与地塞米松处理组无显著差异。白芍处理组与赤芍处理组相比,白芍处理组于48、60 h时极显著低于赤芍处理组,72 h时显著低于赤芍处理组(表1)。
2.3 肺组织病理变化 感染小鼠后72 h小鼠肺组织切片中,空白对照组肺组织正常,肺泡结构完整。肺炎模型组肺泡壁显著增厚,肺支气管周围炎性细胞浸润,管腔充血。白芍处理组肺组织结构较完整,部分肺泡壁增厚,肺泡腔内无异物。赤芍处理组肺组织结构较完整,仅少许肺泡腔充血。地米处理组肺组织结构完整,部分肺泡壁增厚,少许肺泡腔充血(图1)。
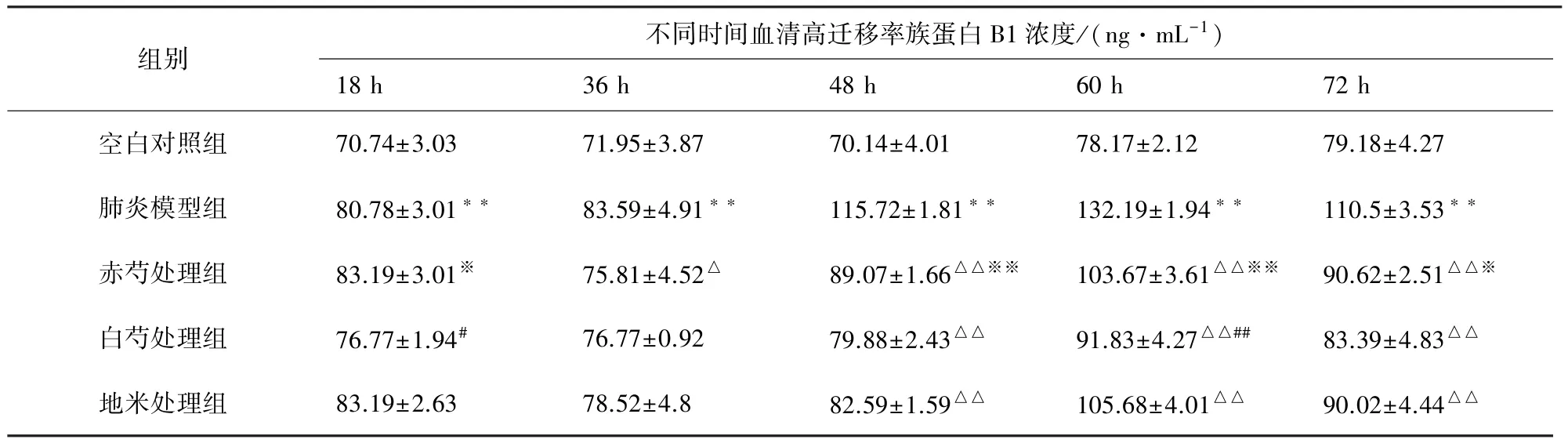
表1 赤芍、白芍煎剂对金葡菌诱导肺炎小鼠血清HMGB1水平影响的比较 (x ±s)
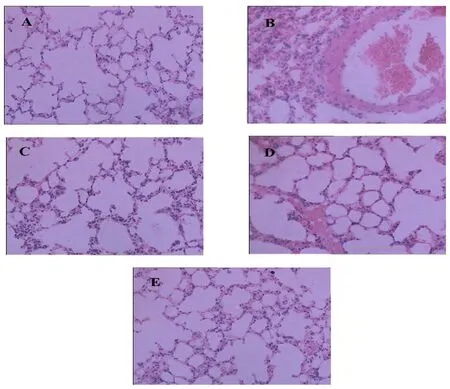
图1 赤芍、白芍干预下72 h小鼠肺组织切片(HE 200×)
3 讨论
1999 年,Wang等[7]发现 HMGB1 可以释放到胞外并介导炎症反应,为内毒素血症和脓毒症的重要炎症介质,并第一次把HMGB1认定为一种炎症晚期调节因子。研究已证明,巨噬细胞、单核细胞、中性粒细胞和坏死细胞在细菌、LPS、TNF-α、IL-1刺激下均可释放HMGB1至胞外,释放到胞外的HMGB1能再次激活单核细胞、巨噬细胞、内皮细胞和中性粒细胞,诱发IL-1、IL-8、TNF-α等多种炎症介质释放,而炎症介质又促进HMGB1的分泌,使炎症反应不断放大、加重。HMGB1在炎症因子网络中起着重要作用,在多种感染性疾病中均扮演着重要角色。
芍药是我国传统中药材,有赤芍、白芍之分;赤芍为毛茛科植物芍药或川赤芍,所直接使用的干燥根,而白芍为植物芍药水煮去皮后使用的干燥根[8]。现代医学研究表明,赤芍和白芍都具有改善血液流变学状态,调节机体微循环,抑制血小板聚集及机体内、外源性凝血,保护肝损伤组织等作用,中医临床上也多用于抗炎。之前,对赤芍、白芍抗炎的研究多集中 NF-κB、TNF-α、IL-6、IL-10、MCP-1等炎症介质[9-11],却未见有在炎症反应过程中是否能对炎症介质HMGB1水平产生影响的相关研究资料。本次试验结果显示,赤芍、白芍均能显著降低肺炎小鼠血清中HMGB1的水平,并明显减轻肺组织损伤程度,这提示两种药物具有减轻炎症反应的作用,但相对而言,白芍的抗炎效果优于赤芍。但在现代中药药理的试验研究中,多都以芍药苷作为研究对象。项亚西等[12]研究表明:赤芍的芍药苷含量达3.5%~7.98%,而白芍的芍药苷含量仅为1.86%~5.76%[12],二者的芍药苷含量存在有明显差异,故单从芍药苷这一角度无法真正表明二者的药理学作用。赤芍、白芍都含有芍药苷、羟基芍药苷,芍药内酯苷,苯甲酰羟基芍药苷。但是,除赤芍的芍药苷含量明显高于同基源的白芍外,含量差别较大的化学成分还有芍药内酯苷和儿茶素等[13],白芍的芍药内酯苷含量均值是赤芍样品含量均值的6倍以上[14],这是否说明芍药内酯苷是芍药中发挥抗炎作用的主要成分之一,值得进一步深入研究。
[1]Yang H, Wang H, Tracey K J.HMGB1 rediscovered as a cytokine[J].Shock, 2001, 15(4): 247-257.
[2]冀兰鑫,黄 浩,李长志,等.赤芍药理作用的研究进展[J].药物评价研究,2010,33(3):233-236.
[3]项亚西,张京红.赤白芍化学成分和药理作用的差异[J].海峡药学,2010,22(11):43-44.
[4]杨琪伟,杨 莉,熊爱珍,等.赤芍和白芍抗炎作用的UPLCMS代谢组学初步研究[J].中国中药杂志,2011,36(6):694-697.
[5]刘 颖,时宇静,时 瀚,等.银翘解毒软胶囊对流感病毒感染小鼠肺炎模型肺组织病毒载量及M1蛋白表达的影响[J].药学学报,2011,46(6):650 655.
[6]滕可导.彩图家畜组织学与胚胎学实验指导[M].北京:中国农业大学出版社,2008.
[7]Wang H,Bloom O,Zhang M,et al.HMG-B1 as a late mediator of endotoxin lethality in mice[J].Science, 1999, 285(5425):248-251.
[8]国家药典委员会.中华人民共和国药典二○一○年版[S].
[9]魏 晓.赤芍煎剂治疗重症胰腺炎及对大鼠体内炎症介质的影响[D].第二军医大学,2007.
[10]朱慧民,牟华明.赤芍对球囊损伤术后血管内膜单核细胞趋化蛋白-1基因表达的影响[J].中国中西医结合急救杂志,2008, 15(3): 138-141.
[11]李志军,刘 雁,梅永君,等.白芍总苷治疗强直性脊柱炎的疗效及其机制探讨[J].中药药理与临床,2009,25(3):68-70.
[12]项亚西,张京红.赤白芍化学成分和药理作用的差异[J].海峡药学,2010,22(11):43-44.
[13]周红涛,骆亦奇,胡世林,等.赤芍与白芍的化学成分含量比较研究[J].中国药学杂志, 2003, 38(9): 654-656.
[14]吴金雄.白芍、赤芍化学成分与活血功效的比较研究[D].广州中医药大学,2012.
