环二鸟苷酸(c-di-GMP)作为潜在免疫佐剂的研究进展
2014-11-23丛晓燕时建立孙文博杜以军吴家强王金宝
丛晓燕,时建立,孙文博,李 俊,杜以军,吴家强,陈 蕾,陈 智,王金宝∗
(1:山东省农科院畜牧兽医研究所,济南250100;2:山东省畜禽疫病防治与繁育重点实验室,济南250100)
随着基因工程亚单位疫苗、合成肽疫苗及DNA疫苗研究的兴起,人们发现新型疫苗有许多优点,但它们的抗原高度纯化,常常不能诱导产生较强的免疫应答,很多情况下,即使接种了疫苗,仍然会有一定的发病率或死亡率,因此亟需研发新的疫苗或者有效地疫苗佐剂以提高疫苗的免疫效果。目前,要使新型疫苗的缺点得到弥补,最常用的方法是以适当的佐剂与之配合使用。传统兽用疫苗中常用的佐剂有铝盐佐剂和油佐剂,但均存在一定的缺陷,如铝盐佐剂其在诱导细胞毒性T细胞及Th1型反应中作用很有限,同高纯度的小分子蛋白抗原共同使用时不能引起足够的抗体应答,因此铝盐在新型疫苗中的佐剂效果较差,但铝盐佐剂也是目前应用最广的佐剂[1]。油佐剂疫苗在抗体效价和免疫持久性方面都优于铝盐佐剂,但其不良反应较严重。如弗氏佐剂在注射后易产生局部持久性溃疡和肉芽肿。目前的研究热点细胞因子[2]、脂质体[3]、CpG-ODN 佐剂[4-6]、单磷酰基脂质 A[7]四类新型兽用疫苗佐剂,是得到学者们公认的毒副作用较小而佐剂作用相对较好的有应用前途的佐剂。此外还有近几年引起广泛关注的细菌第二信使环二鸟苷酸与TOLL样受体[8],主要是刺激与调节机体先天免疫。环二鸟苷酸(cyclic diguanylate,c-di-GMP)是细菌中普遍存在的第二信使分子,参与调节多种生理功能,研究发现环二鸟苷酸作为免疫调节剂作用于真核细胞可产生很好的免疫调节作用,实验研究表明其有可能成为具有潜力的疫苗佐剂[9]。本文着重介绍环二鸟苷酸作为免疫佐剂的研究。
1 c-di-GMP的结构与代谢
环二鸟苷酸是细菌中保守的第二信使分子,参与调节多种生理功能,包括细菌的运动,定置,分化、生物被膜形成、致病因子产生,细胞间通信等[10]。c-di-GMP是由2分子GTP缩合形成的环状二核苷酸,其结构如图1所示。细胞内c-di-GMP合成与降解代谢分别受二鸟苷酸环化酶(diguanylate cyclase ,DGC)和磷酸二酯酶(phosphodiesterase,PDE)调控,DGC和PDE活性中心为GGDEF和EAL结构域,GGDEF结构域能够将2分子GTPs催化合成一分子c-di-GMP,而EAL结构域能够将c-di-GMP降解为pGpG。
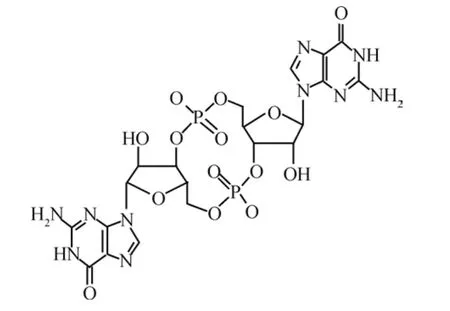
图1 c-di-GMP的化学结构及其类似物
2 c-di-GMP的免疫特性与作用机理
c-di-GMP对某些严重的细菌感染有着惊人的保护效果,Karaolis等[11]利用小鼠模型感染肺炎克雷伯氏菌(Klebsiella pneumoniae),发现 c-di-GMP通过协同作用,可显著降低肺脏中细菌浓度。该实验同时证明,c-di-GMP的抗菌作用,是由于c-di-GMP的免疫调节,而非直接的杀菌作用。免疫调节作用不仅限于机体系统免疫反应,其在采用滴鼻的免疫方式时也可产生一系列的免疫调节作用,而消灭部分入侵的细菌。Ogunniyi AD与Yan H在研究以小鼠为模型感染肺炎球菌的治疗时均证明,在滴鼻初始的保护疗效对呼吸道病原体尽管没有直接杀菌作用,但能显着降低肺部的细菌浓度和减少传播[12-13],也间接说明c-di-GMP是通过免疫调节作用降低了细菌的感染。
c-di-GMP可刺激机体的先天免疫是一种有效的免疫调节剂。c-di-GMP确实有强大的免疫刺激特性,能够初步刺激人未成熟树突状细胞表面组织相容性复合物MHCⅡ类抗原的表达,刺激分子CD 80/CD 86和成熟标志CD 83,增加分泌细胞因子和趋化因子(白细胞介素-12,干扰素-γ等),调节激活正常T细胞表达和分泌,并改变表达趋化因子受体。此外,c-di-GMP可增强细胞刺激活动[12-14]。 Yan H 等[13]证明 c-di-GMP 经腹腔注射或滴鼻免疫小白鼠,可诱导单核细胞、粒性白细胞、树突细胞的聚集、增强T细胞活化的协同调节因子CD40和CD80的表达,且c-di-GMP滴鼻免疫小鼠24 h后,肺部树突状细胞数量明显增加。
c-di-GMP有很好的免疫保护效果,但其作用机理近期才得以初步了解。先天免疫系统组成了机体对抗致病菌的第一道防线。当有致病菌入侵机体时,先天免疫系统中的模式识别受体可以感受致病菌中的一些核苷酸类的保守结构,从而激活机体合成多种细胞因子包括I型干扰素来对抗病原菌。病原菌侵入机体细胞后,在遗传物质复制的过程中,会有游离的双链DNA(dsDNA)释放到胞内,而这些外源的DNA会引起细胞的免疫反应。在这个过程中,干扰素刺激因子 STING(stimulator of interferon gnens)跨膜蛋白起着重要的作用,它能够促进干扰素的产生,并且在dsDNA从被检测出到TBK-IRF3的信号通路中起着连接作用。2011年9月,Burdette等[15]人发现,STING 在病原菌和病毒感染时角色不同:既是病原菌所分泌的第二信使c-di-GMP的感受因子(sensor),又是宿主感知病毒核酸产生I型干扰素反应的信号接头分子(adaptor)。
针对细菌的入侵,STING蛋白能够直接感应环二鸟苷酸的信号分子,从而激活下游信号转导通路,进而产生细胞因子及其它固有免疫反应。2012年,苏晓东[16]通过对STING及其与c-di-GMP复合物结构的解析,非常清楚地展示了STING感受和结合c-di-GMP的分子机制,为进一步的免疫治疗,及c-di-GMP作为疫苗佐剂的开发应用提供了非常重要的线索。同时,谷立川[17]揭示了先天免疫相关蛋白STING与细菌信号分子c-di-GMP的相互作用关系,STING以对称二体的形式存在,形成一个适合结合c-di-GMP的具有对称性的疏水腔;结合c-di-GMP后,STING的一个单体的β2-β3 loop会发生构象变化,这个构象变化能够让STING二体更紧密地结合c-di-GMP。这种结合方式与细菌蛋白结合c-di-GMP有着很大差别,前者主要以疏水相互作用为主,而后者则主要通过两个精氨酸的正电荷与c-di-GMP两个磷酸基团的负电荷的相互吸引结合在一起。这为理解内源免疫系统如何感应及防御微生物的感染提供了重要信息,也从分子水平上证明c-di-GMP可以作为优良的疫苗佐剂,在临床上具有很好的应用前景。
3 c-di-GMP作为免疫佐剂的研究
c-di-GMP刺激和调节宿主的先天免疫反应表明,c-di-GMP及其类似物可以是一个潜在的疫苗佐剂,2006年第一次由Karaolis[14]正式的提出这一概念。 随后,2007年 Ebensen T[18]首次评估了c-di-GMP及其类似物作为佐剂的可能性。采用标准的免疫程序模式抗原半乳糖苷酶与c-di-GMP的混合物皮下免疫小鼠,和单免抗原相比,其产生很强的体液免疫与细胞免疫,引起淋巴细胞增殖和干扰素,IL-2,IL-4和肿瘤坏死因子等的分泌。血清中检测出IgG1与IgG2a亚型和脾细胞中细胞因子,说明 c-di-GMP作为疫苗佐剂可以诱导Th 1、Th 2平衡免疫反应,c-di-GMP可以作为好的疫苗佐剂。Hu DL等[19]建立小鼠感染模型,小鼠在2周的时间内间隔免疫三次,以铝胶或c-di-GMP作为佐剂,1:1混合抗原耐甲氧西林金黄色葡萄球菌,粘附素或金黄色葡萄球菌肠毒素。实验表明以c-di-GMP作为佐剂的疫苗免疫的小鼠有更好地存活率,与铝胶佐剂相比,脾脏与肝脏细菌的感染量明显降低。另一小鼠模型,肺炎球菌PdB+c-di-GMP佐剂与肺炎球菌PdB+铝胶佐剂相比产生较高的特异性抗体,且产生很好的免疫保护[12]。
c-di-GMP在作为全身免疫佐剂研究的同时,发现其作为粘膜佐剂有着不错的免疫效果。Yan H等[20]首次证明c-di-GMP作为佐剂,可提高粘膜免疫反应,产生针对病菌入侵的保护性免疫。小鼠通过滴鼻免疫肺炎球菌表面黏附素A与c-di-GMP的混合物可刺激机体产生特异性抗体IgA、IgG1和IgG2a。粘膜和血清中的含有较高的特异抗体肺炎球菌表面黏附素A。McWhirter SM等[21]在哺乳动物细胞浆中发现c-di-GMP,其引发的转录反应与细胞内的DNA刺激机体产生的反应相似,通过调控基因TANK激酶1,干扰素调整因子3,核因子B和有活性的蛋白激酶,引发诱导产生Ⅰ型干扰素。这个反应与胞浆DNA引发的反应一样,可能会增加c-di-GMP作为小分子佐剂的价值。Madhun AS等[22]利用植源性的流感疫苗 H5N1,混合c-di-GMP作为佐剂。采用滴鼻或肌注的方式免疫小鼠,以肌注的方式免疫的小鼠没有提高H5N1的免疫应答,而以滴鼻方式免疫的小鼠引起强烈的粘膜免疫与体液免疫,另外,滴鼻的方式引起 Th1/Th2的平衡变化,出现大量多功能的Th1CD4细胞,说明c-di-GMP对植源性的流感疫苗H5N1是一种很有前途的粘膜佐剂。Pedersen GK等[23]应用小鼠模型免疫H5N1减毒活疫苗,混合c-di-GMP作为佐剂,采用滴鼻、舌下注射与肌注的方式免疫小鼠。舌下免疫可有效地诱导局部与全身的体液免疫和细胞免疫反应,但免疫效果明显低于滴鼻免疫,但高于肌注免疫。值得一提的是舌下免疫可产生大量针对H5N1的特异多功能CD4+细胞。三种免疫方式均产生了较高的血凝抑制抗体,其中唾液中的HI抗体仅由滴鼻与舌下注射免疫产生。通过对比一系列的免疫方式,滴鼻免疫的方式是最能提高c-di-GMP免疫效果的免疫方式,这也间接证实c-di-GMP作为佐剂,在粘膜免疫方面具有很好的效果。与目前佐剂研究的热点细胞因子,脂质体,CpG-ODN佐剂,单磷酰基脂质 A相比c-di-GMP可以明显提高抗体IgG1、IgG2a,干扰素-γ的水平与含量[24]。
4 结语
c-di-GMP能够刺激机体产生免疫反应,而启动了探讨其作为新型免疫增强剂的研究,新型疫苗佐剂一般具有来源广泛、价格低廉、高效低毒、作用机理研究比较清楚等特点[25-26]。c-di-GMP要成为切实可行的免疫佐剂还需大量的数据支持:体外的实验表明c-di-GMP对正常大鼠肾细胞或人类神经母细胞瘤细胞没有致死毒性,也没有不良的反应或是致癌作用[14-20],但在体内的安全性需要进行评估;c-di-GMP强大的免疫刺激特性可能导致对机体有害的炎症反应[27],这就需要对c-di-GMP进行结构修饰防止过度组织炎症。粘膜表面(如呼吸道,消化道和泌尿生殖道)是病原菌主要的入侵途径和定居部位。因此,发展佐剂和疫苗引起有效和持续的粘膜免疫反应,防止病原体的附着,入侵和复制,将在预防和治疗许多重要的传染病方面起到重要作用。c-di-GMP能否成为一种有效地粘膜佐剂必须经过更多方面的评估。另外,对c-di-GMP的作用机制的深入研究,是c-di-GMP成为粘膜免疫佐剂关键的一步。虽然,c-di-GMP或其相关衍生物成为切实可行的免疫佐剂任重而道远,但其值得期待。
[1]Harandi A M,Medaglini D,Shattock R J.Vaccine adjuvants:a priority for vaccine research[J].Vaccine,2010,28(12):2363-2366.
[2]Hu X D, Chen S T, Li J Y,et al.An IL-15 adjuvant enhances the efficacy of a combined DNA vaccine against Brucella by increasing the CD8+cytotoxic T cell response[J].Vaccine,2010, 28(12): 2408-2415.
[3]Suzuki Y,Wakita D, Chamoto K,et al.Liposome-encapsulated CpG oligodeoxynucleotides as a potent adjuvant for inducing Type 1 innate immunity[J].Cancer Res, 2004, 64(23): 8754-8760.
[4]Wang X J, Bao M S, Wan M A CpG oligo deoxy nucleotide acts as a potent adjuvant for inactivated rabies virus vaccine[J].Vaccine, 2008, 26(15): 1893-1901.
[5]Sun S, Zhang X, Tough D F,et al.Type I interferon-mediated stimulation of TCells by CpG DNA[J].J Exp Med, 1998, 188:2335-2342.
[6]Kindrachuk J, Jenssen H, Elliott M,et al.A novel vaccine adjuvant comprised of a synthetic innate defence regulator peptide and CpG oligonucleotide links innate and adaptive immunity [J].Vaccine, 2009, 27(34): 4662-4671.
[7]Boukhvalova M S, Prince G A, Soroush L,et al.The TLR4 agonist, monophosphory lipid A, attenuates the cytokine storm associated with respiratory syncytial virus vaccine-enhanced disease[J].Vaccine, 2006, 24(23): 5027-5035.
[8]Hemmi H, Takeuchi O, Kawai T,et al.A Toll-like receptor recognizes bacterial DNA [J].Nature, 2000, 408: 740-745.
[9]Shang G,Zhu D,Li N,et al.Crystal structures of STING protein reveal basis for recognition of cyclic di-GMP[J].Nat Struct Mol Biol, 2012 ,19(7):725-772.
[10]Urs J,Jacob M.Mechanisms of Cyclic-di-GMP signaling in bacteria[J].Annu Rev of Genet,2006,40:385-407.
[11]Karaolis D K,Newstead M W,Zeng X,et al.Cyclic di-GMP stimulates protective innate immunity in bacterial pneumonia[J].Infect Immun, 2007,75(10):4942-4950.
[12]Ogunniyi A D,Paton J C,Kirby A C,et al.C-di-GMP is an effective immunomodulator and vaccine adjuvant against pneumococcal infection[J].Vaccine, 2008,26(36):4676-4685.
[13]Yan H,Wang X,KuoLee R,et al.Synthesis and immunostimulatory properties of the phosphorothioate analogues of c-di-GMP[J].Bioorg Med Chem Lett, 2008,18(20):5631-5634.
[14]Karaolis D K.Inventor method for stimulating the immune,inflammatory or neuroprotective response[P].USA patent US 2006/0040887 A1, 2006.
[15 ]Burdette D L, Monroe K M, Sotelo-Troha K, et al.STING is a direct innate immune sensor of cyclic di-GMP[J].Nature,2011,478(7370):515-518.
[16]Huang Y H,Liu X Y,Du X X,et al.The structural basis for the sensing and binding of cyclic di-GMP by STING [J].Nat Struct Mol Biol, 2012,19(7):728-730.
[17]Shang G,Zhu D,Li N,et al.Crystal structures of STING protein reveal basis for recognition of cyclic di-GMP[J].Nat Struct Mol Biol, 2012,19(7):725-727
[18]Ebensen T, Schulze K, Riese P,et al.The bacterial second messenger cyclic diGMP exhibits potent adjuvant properties[J].Vaccine, 2007,25(8):1464-1469.
[19]Hu D L,Narita K,Hyodo M,et al.C-di-GMP as a vaccine adjuvant enhances protection against systemic methicillin-resistan t Staphylococcus aureus(MRSA) [J].Vaccine, 2009,27(35):4867-4873.
[20]Yan H,Wang X,KuoLee R,et al.Synthesis and immunostimulatory properties of the phosphorothioate analogues of cdiGMP [J].Bioorg Med Chem Lett, 2008,18(20):5631-5634.
[21]McWhirter S M,Barbalat R,Monroe K M,et al.A host type I interferon response is induced by cytosolic sensing of the bacterial second messenger cyclic-di-GMP[J].Exp Med, 2009,206:1899-1911.
[22]Abdullah S M,Lars R H,et al.Intranasal c-di-GMP-adjuvanted plant-derived H5 influenza vaccine induces multifunctional Th1 CD4+cells and strong mucosal and systemic antibody responses in mice[J].Vaccine,2011,29: 4973-4982.
[23]Pedersen G K,Ebensen T,Gjeraker I H,et al.Evaluation of the sublingual route for administration of influenza H5N1 virosomes in combination with the bacterial second messenger c-di-GMP[J].PLoS ONE,6(11): 1-12.
[24]Peter M G ,Gail F.Evidence for cyclic diguanylate as a vaccine adjuvant with novel immunostimulatory activities[J].Cellular Immunology, 2012 ,(278) : 113-119.
[25]Mestecky J, Michalek S M, Moldoveanu Z, et al.Routes of immunization and antigen delivery systems for optimal mucosal immune responses in humans[ J].Behring Inst Mitt, 1997,(98):33-43.
[26]Man A L, Prieto-Garcia M E, Nicoletti C.Improving M cell mediated transport across mucosal barriers:do certain bacteria hold the keys? [J].Immunology, 2004,113(1):15-22.
[27]Chen W X, Lee R K, Yan H B.The potential of 3_,5_-cyclic diguanylic acid(c-di-GMP) as an effective vaccine adjuvant[J].Vaccine, 2010, 28: 3080-3085.
