乙酰甲喹及其主要代谢物在鸡体内的残留消除规律研究
2014-11-23张亚平张桂君徐立萧杨海翠郑建龙方炳虎
张亚平,张桂君,徐立萧,张 怡,杨海翠,郑建龙,方炳虎
(华南农业大学兽医学院,广州510000)
乙酰甲喹(又名痢菌净,MEQ),化学名3-甲基-2-乙酰基喹噁啉-1,4-二氧化物,属于喹噁啉类衍生物。乙酰甲喹具有广谱抗菌性,抗菌效果显著,对密螺旋体有特效,又因其价格低廉使用方便,被广泛用于畜禽业中肠道疾病的治疗。我国尚未制定乙酰甲喹的休药期和最高残留限量(MRL),近年来由于乙酰甲喹的不合理应用,导致中毒事件时有发生[1-3],给养殖业造成较大的经济损失,也给人类健康带来潜在威胁。本文旨在应用HPLC-MS/MS法,对乙酰甲喹及其6种主要代谢物,脱二氧乙酰甲喹(M1)、N1-脱氧乙酰甲喹(M2)、N1-脱氧侧链羰基还原乙酰甲喹(M4)、脱二氧侧链羰基还原乙酰甲喹(M5)、侧链羰基还原乙酰甲喹(M6)和羰基还原羟化乙酰甲喹(M7)在鸡体内的残留消除规律进行研究,以期为乙酰甲喹的合理应用提供可靠依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 65只健康白羽鸡(AV500),采购于增城市某养殖厂。
1.1.2 药物与试剂 乙酰甲喹标准品(99.6%,HO111008),来源于中国兽医药品监察所。M1(98%)、M2(95%)、M4(95%)、M5(97%)和 M6(97%)均由中国农业大学动物医学院提供。M7(97%)由华南农业大学兽医学院合成而来。色谱级甲醇、乙腈和甲酸,购自美国Thermo Fisher公司;分析纯盐酸,购自衡阳化学试剂厂;实验用水为超纯水(Millipore-Q系统)。
1.1.3 仪器设备 美国Agilent公司1200型液相色谱仪串联美国ABI公司API 4000四极杆质谱仪;5804(R)型高速台式冷冻离心机,德国Eppendorf公司;T25型高速组织匀浆器,德国 IKA公司;HS501 digital型轨道式摇床,德国 IKA公司;Wat200609固相萃取装置,美国Waters公司;HH-1数显恒温水浴锅,金坛市富华仪器有限公司;OasisHLB固相萃取小柱(60 mg, 3cc),美国 Waters公司;0.22 μm有机相滤膜,天津津腾试验仪器公司。
1.2 方法
1.2.1 动物试验 65只鸡分为试验组(55只)和对照组(10只),给药前适应一周后,试验组以20 mg/kg体重灌服乙酰甲喹悬浊液,一天两次,连续三天。给药结束后宰杀空白组,并在 2、4、6、12、16、24、30、36、48、72和120 h分别宰杀5只试验组鸡(随机选取)。宰杀前翅下静脉采血,置于含肝素的离心管中,3000 r/min离心10 min后,取上清,-20℃冰箱储存。宰杀后,每只鸡均取肌肉、皮脂、肝脏和肾脏组织,均质后-20℃冰箱储存。
1.2.2 样品前处理 血浆样品处理:取0.5 mL血浆,加入0.5 mL乙腈,充分涡旋30~60 s,置于高速离心机中 15000 r/min,20 min,4 ℃。 离心后取上清,过0.22 μm有机相滤膜后装进样瓶,待测。
组织样品处理:该方法优化自Zeng等[4],称取(2.00 ± 0.02)g组织,加入12 mL浓度为2 mol/L的盐酸溶液,充分涡旋后,置于60℃水浴锅中,水浴1 h。 水浴后,326 mot/min 震荡 15 min,10000 r/min离心10 min,取上清再次离心10000 r/min,10 min 后取6 mL上清。开始过HLB柱,3 mL甲醇活化,3 mL水平衡,然后上样液,再 3 mL甲醇水(5:95 V/V)淋洗,最后3 mL甲醇洗脱。取1 mL洗脱液过0.22 μm有机相滤膜后装进样瓶,待测。
1.2.3 色谱条件 色谱柱为CNW C18(4.6 mm×150 mm,5μm);流动相A为0.1%甲酸水,流动相B为色谱乙腈,梯度洗脱条件见表1,进样量为5 μL。
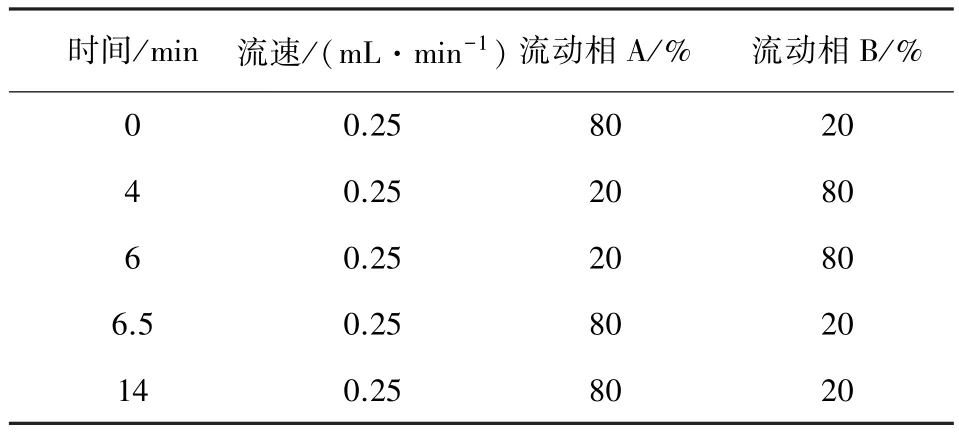
表1 梯度洗脱条件表
1.2.4 质谱条件 电喷雾离子源(ESI+);离子喷雾电压(IS),4500 V;离子源温度(TEM),维持在650 ℃;碰撞气 (CAD),5 psi;离子源 GS1,55 psi;离子源 GS2,50 psi;气帘气(CUR),20 psi;多重反应监测模式(MRM),离子参数见表2。

表2 质谱分析中的离子参数
1.2.5 基质校准 称取适量的乙酰甲喹及其6种代谢物溶于甲醇,配制成20、10、1、0.1 mg/mL 的储备液,并用储备液配成两个系列浓度的混合标准液:系列1为0.05、0.1、0.5、1、2、5、10 和 20 mg/mL;系列 2 为0.01、0.02、0.04、0.1、0.5、1、2、5、10 和20 mg/mL。 检测时采用基质添加标准曲线,取980 μL空白基质添加20 μL混和标准溶液配制而成。血浆标准曲线为2、4、20、40、80、200、400 和800 ng/mL 系列浓度,组织标准曲线为0.6、1.2、2.4、6、30、60、120、300、600 和 1200 ng/g 系列浓度。
1.2.6 方法验证 在 5、20 和 200 ng/g(ng/mL)三个添加浓度下,每个浓度5个平行,测3批,考察乙酰甲喹及其主要代谢物在鸡肌肉、皮脂、肝脏、肾脏和血浆中的回收率和精密度。
1.2.7 样品测定 对于预试验中浓度比较高的相应时间点样品,在正式试验中样品稀释后上机检测。
1.2.8 数据分析 运用Analyst1.5软件测算药物浓度,WinNonlin5.2.1软件中的非房室模型计算血浆和各组织中乙酰甲喹及其6种代谢物的消除参数。
2 结果
2.1 方法考察结果 建立的HPLC-MS/MS方法,灵敏度高,乙酰甲喹及其6种代谢物在鸡可食性组织和血浆中的检测限(LOD)不超过2 ng/g,定量限(LOQ)不超过5 ng/g,详见表3。基质添加标准曲线相关系数均大于0.99,线性关系良好(表4)。在三个批次三个添加浓度下,回收率为67.4%~106.1%(表5),批内变异系数为4.6%~13.7%,批间变异系数低于15%(表6),说明该方法符合残留检测要求。
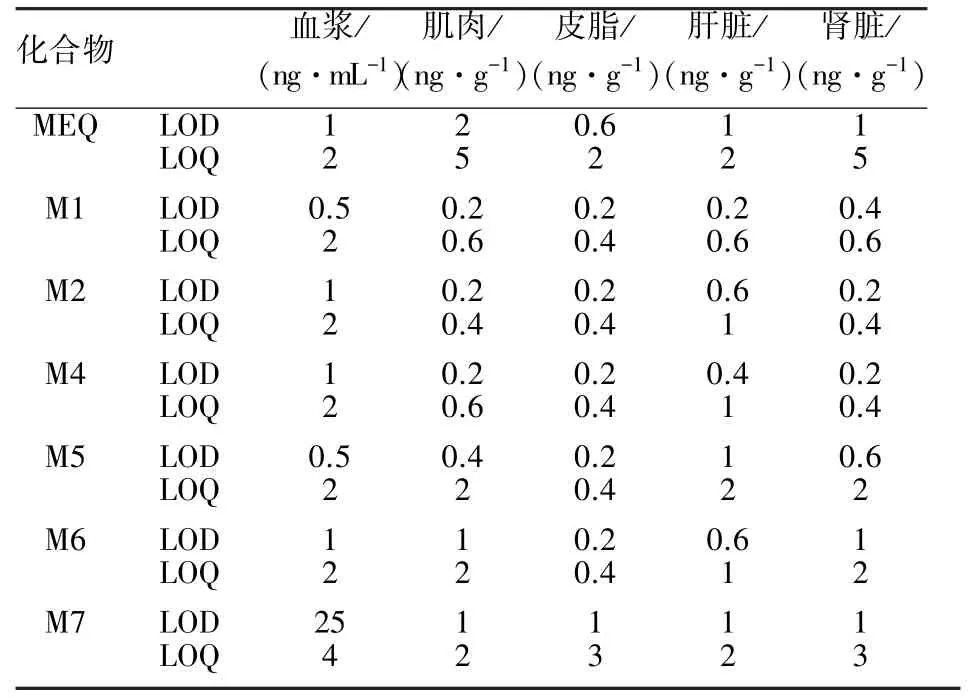
表3 乙酰甲喹及其6种代谢物的检测限(LOD)和定量限(LOQ)
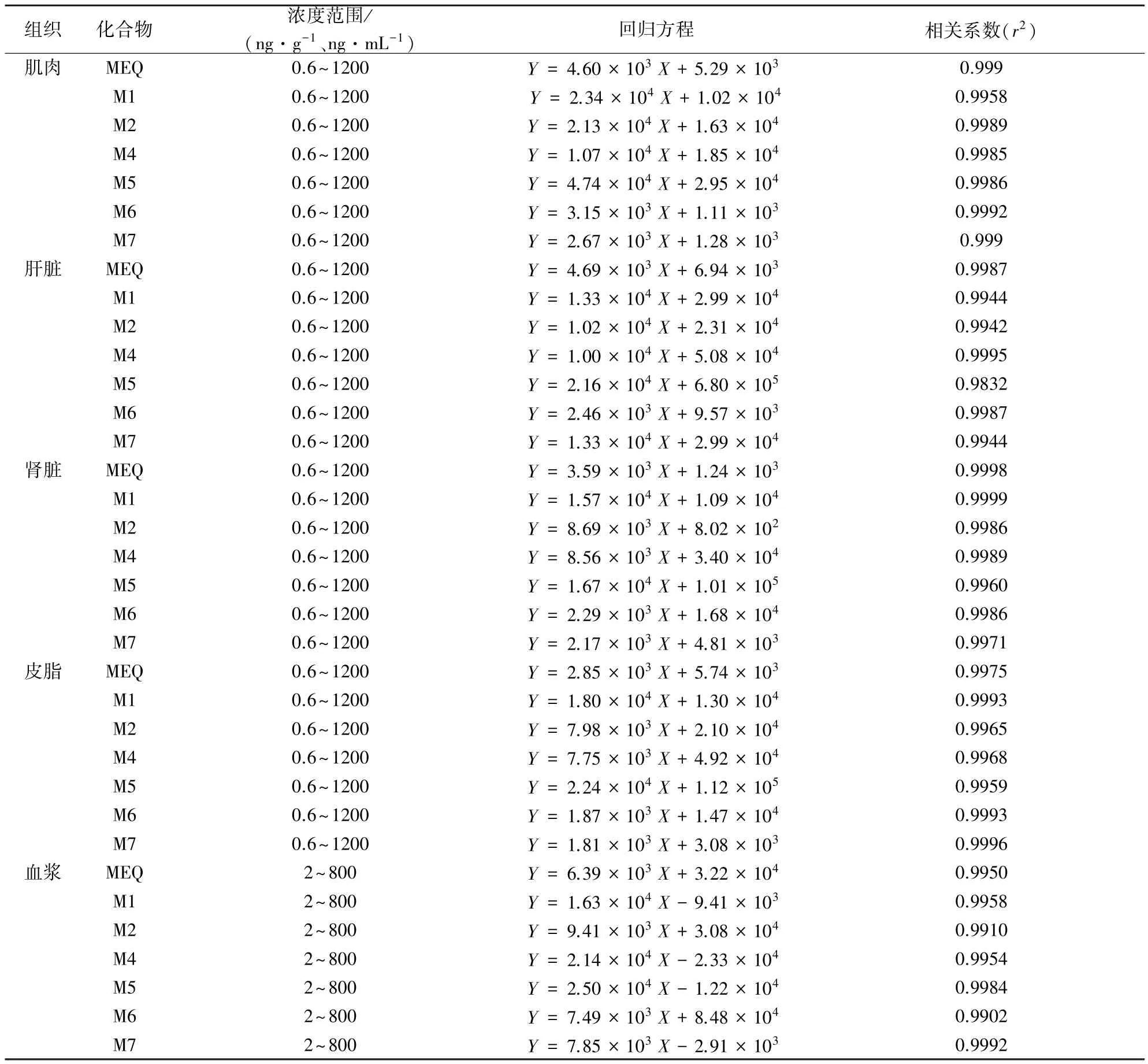
表4 基质标准曲线的回归方程和相关系数

表5 在5、20、200 ng/g(ng/mL)三个添加水平下乙酰甲喹及其6种代谢物在鸡可食性组织和血浆中的回收率 %

表6 在5、20、200 ng/g(ng/mL)三个添加水平下乙酰甲喹及其6种代谢物在鸡可食性组织和血浆中的变异系数 %
2.2 样品检测结果 乙酰甲喹在鸡组织和血浆中消除迅速,仅在皮脂和血浆中检测到少量,其代谢物广泛分布,代谢物的的主要残留消除参数见表7。总体而言,代谢物在肌肉和肝脏中残留量较多,肝脏中M4的曲线下面积(AUC)最大,达70524.62 h·ng/g。 数据表明M6和M7在皮脂中的残留时间最长,平均滞留时间(MRT)分别为16.3595 h和41.3446 h。给药后120 h,已基本检测不到代谢物。
3 讨论
试验所建立的乙酰甲喹及其6种代谢物在鸡可食性组织和血浆中的残留检测方法简单、灵敏度高、准确度和精密度好,符合残留检测要求。已发表的研究表明[4-6],乙酰甲喹在鸡、绵羊和猪血浆中的消除半衰期(t1/2)较短,消除迅速,与本试验结果相符。Zeng等在研究乙酰甲喹及其5种代谢物(M1,M2,M4, M5和 M6)在猪体内的残留时发现,肝脏中残留量最高的代谢物为M1,与本文结果(肝脏中残留最多的为M4)存在差异,主要原因可能是由于种属差异。在同属喹噁啉类药物的喹赛多和喹烯酮的残留研究中表明[7-9],肝脏是残留时间最长的组织,本研究数据显示皮脂是乙酰甲喹代谢物滞留时间最长的组织,推测乙酰甲喹的残留消除有其特异性。
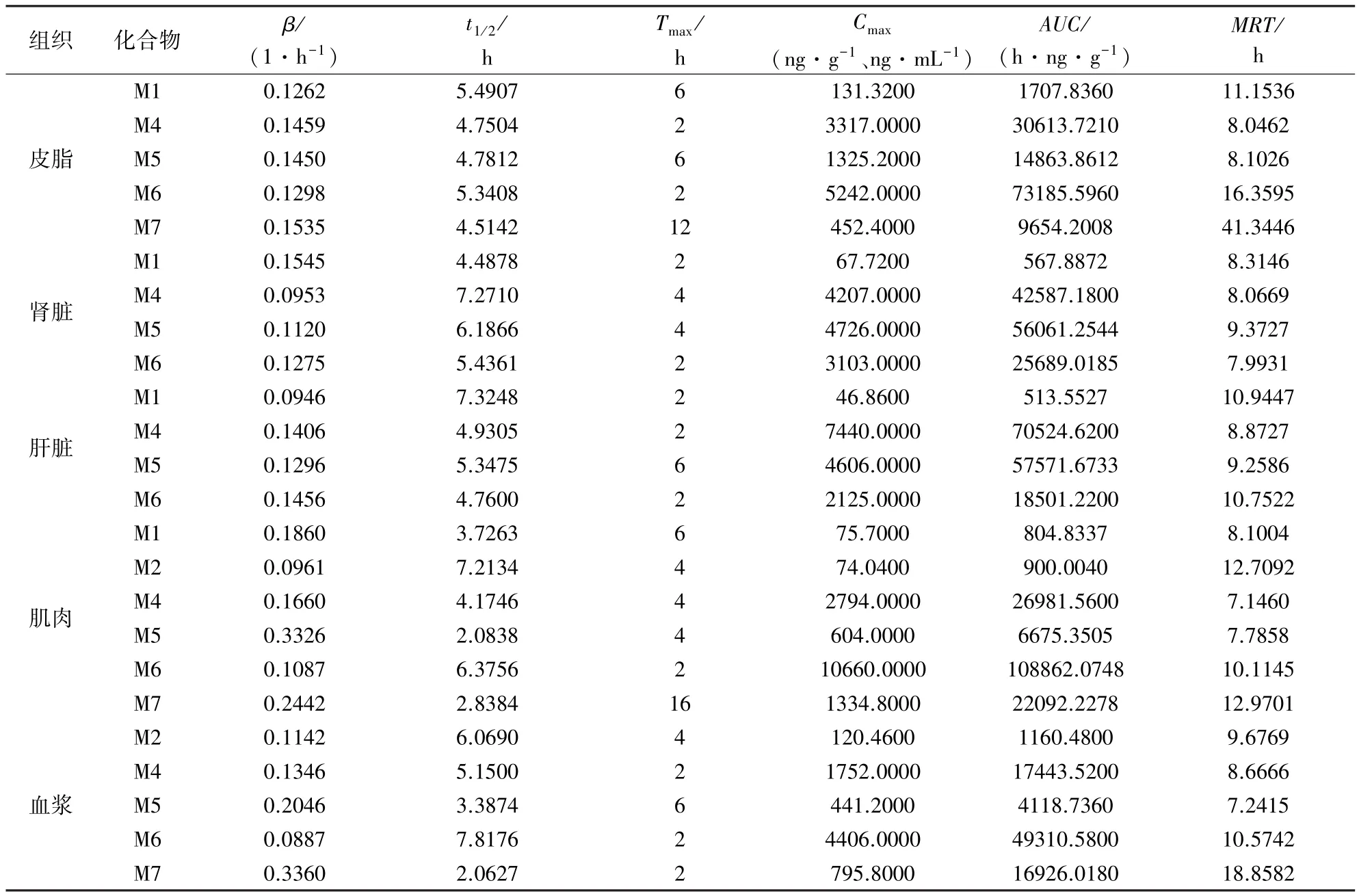
表7 乙酰甲喹及其6种代谢物在鸡可食性组织和血浆中的主要残留消除参数
乙酰甲喹的代谢物较原药在鸡体内残留时间长和残留量高,残留消除过程也较为复杂,表明代谢物在残留研究中的重要价值,然而目前的相关研究主要集中在乙酰甲喹原药,代谢物的研究有待深入。
[1]苏志强.浅谈肉鸡乙酰甲喹中毒[J].今日畜牧兽医,2007,(6):42-42.
[2]郭 萍,杨 强,章厉劼,等.乙酰甲喹标准修订商榷[Z].中国天津:2008:530-531.
[3]刘迎春,高怀涛.乙酰甲喹的合理应用[J].养禽与禽病防治,2009,(3):42~43.
[4]Zeng Dongping, Shen Xiangguang, He Limin, et al.Liquid chromatography tandem mass spectrometry for the simultaneous determination of mequindox and its metabolites in porcine tissues[J].Journal of separation science, 2012,35(10/11):1327-1335.
[5]Liu Yimin, Liu Yingchun, Ding Huanzhong, et al.Pharmacokinetics of Mequindox and Its Metabolites in Swine[J].Agricultural Sciences in China, 2011,(12):1968-1976.
[6]Ding Huanzhong, Liu Yingchun, Zeng Zhenling, et al.Pharmacokinetics of mequindox and one of its major metabolites in chickens after intravenous, intramuscular and oral administration[J].Res Vet Sci, 2012,93(1):374-377.
[7]黄玲利.喹赛多在肉鸡的有效性与安全性研究[D].武汉:华中农业大学,2006.
[8]邱银生.喹赛多在猪体内的药动学和残留研究[D].武汉:华中农业大学,2003.
[9]Yong Yan, Liu Yahong, He Limin,et al.Simultaneous determination of quinocetone and its major metabolites in chicken tissues by high-performance liquid chromatographytandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci, 2013,919/920:30-37.
