兽用鸡脾转移因子的多肽组成研究
2014-11-23黄迪海盛晓丹董玉兰綦学慧张从敬徐秀荣张再辉秦卓明
黄迪海,刘 霞,盛晓丹,董玉兰,綦学慧,张从敬,徐秀荣,张再辉,秦卓明,3∗
(1.山东省健牧生物药业有限公司,济南250100;2.济南市动物生物药品工程技术研究中心,济南250100;3.山东省农业科学院家禽研究所,济南250023;4.中国农业大学,北京100094)
兽用鸡脾转移因子(Transfer Factor,TF)是具有免疫活性的T淋巴细胞在抗原或丝裂原的刺激下释放的一类可透析的小分子多肽,具有增强淋巴细胞转化,提高机体免疫功能的作用。TF可将供体的细胞免疫功能特异地转给受体,而且能转移包括真菌、细菌、病毒、寄生虫、组织相容性抗原和肿瘤抗原等多种抗原的细胞免疫,是一种新型免疫制剂[1]。
自20世纪50年代首次发现TF至今,国内外研究人员对其进行了广泛深入的研究和应用,发现TF具有分子质量小、无毒、无抗原性、不引起过敏反应、不产生特异性抗体,且可超越种属界限应用等优点,具有治疗免疫缺陷[2]、恶性肿瘤[3]、感染性疾病[4]等作用。1979年以后,国内外逐渐将TF应用于兽医免疫和临床治疗。2011年,我国批准兽用转移因子口服溶液上市。TF在防治动物传染病[5]、增强机体免疫[6]、提高疫苗效果[7]等方面效果确切,但其多肽组成不明确,在调控肠道粘膜屏障中的作用机理不清楚,严重制约TF的应用。本研究旨在探索鸡脾转移因子的多肽组成,为进一步研究其有效成分和作用机理提供技术支持。
1 材料与方法
1.1 材料 兽用鸡脾转移因子,由山东省健牧生物药业有限公司生产,多肽含量≥1mg/mL,样品生产批号为:20121101、20121102、20121103;绵羊静脉血;新鲜猪胸腺;乙腈、超纯水,色谱纯;TrisHCL、NaCl、KH2PO4等试剂均为分析纯。
1.2 仪器 高速组织捣碎机,质谱仪(LTQVelos),分光光度仪(P-2000),医用低速离心机,恒温水浴锅,显微镜(XSS-2A)。
1.3 方法
1.3.1 多肽含量测定 按照福林酚Lowry法[8]测定兽用鸡脾转移因子样品溶液的多肽含量。
1.3.2 分子量测定 采用MALDI-TOF-MS法,检测条件为固体激光源波长355 nm,离子类型为正离子,检测方式为反射方式(飞行管长2.7 m,加速电压20 kV,反射电压23 kV)和线性方式(飞行管长1.22 m,加速电压kV),基质为CHCA和SA。试验样品溶液ziptip脱盐后MALDI-TOF-MS分析,根据分子量图谱确定样品分子量。
1.3.3 多肽组成分析
1.3.3.1 样品处理 样品用10 kD超滤管离心超滤,通过10 kD超滤管的小肽不用酶解,直接用质谱分析,选择no enzyme。未通过10 kD超滤管的样品,将超滤管反转后离心,取样品约 30 μg,加入 30 μL STD buffer,沸水浴 5 min,冷却至室温;加入 200 μL UA buffer(8 mol/L Urea,150 mmol/L TrisHCl pH8.5)混匀,转入30 kD超滤离心管,离心;加入200μL UA buffer离心,弃滤液。 加入100 μL IAA(50 mmol/L IAA in UA),振荡1 min,避光室温 30 min,离心;加入100 uL UA buffer,离心,重复 2 次;加入 100 μL 25 mol/LNH4HCO3,离心,重复 2 次;加入 40 μL Trypsin buffer (2 μg Trypsin in 40 μL25 mol/L NH4HCO3),振荡1 min ,37 ℃ 16~18 h。 换新收集管,离心,收集滤液,进行质谱分析,选择Trypsin。
1.3.3.2 毛细管高效液相色谱方法 A液为0.1%甲酸的水溶液,B液为0.1%甲酸的乙腈水溶液(乙腈为84%)。色谱柱以95%的A液平衡后,样品由自动进样器上样到Trap柱。0~105 min,B液线性梯度从4% 到50%;105~114 min,B液线性梯度从50%到100%;114~120 min,B液维持在100%。
1.3.3.3 质谱数据采集 多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描后采集20个碎片图谱(MS2 scan)。
1.3.3.4 数据分析 原始文件用BIOWORKS软件搜索相应的数据库。查询IPI数据库CHICK(v3.81)分类系统,得到鉴定的蛋白质结果。
1.3.4 活力测定 按照国家卫生部新药转正标准西药第四十七册中脱E受体法[8],制备脱E受体胸腺T细胞悬液,使最终浓度为每1 mL含3×106~5×106个细胞;制备绵羊红血球悬液,使最终浓度为脱E受体胸腺T细胞悬液浓度的8~10倍;取供试品,用 Hank’s液配制成每1 mL中含1 mg的供试品溶液;取小试管6支,其中3支各加Hank’s液0.1 mL作为对照管,另3支各加供试品溶液0.1 mL作测定管,每管中各加脱E受体胸腺T细胞悬液0.2 mL,37℃保温1 h,加绵羊红血球悬液 0.2 mL,混匀,500 r/min 离心 3 min,4 ℃冰箱过夜;次日取出,弃上清液,每管中各加固定液1滴,轻轻摇匀,静置10 min,加染色液2滴并摇匀,静置15 min后开始计数。显微镜视野中淡蓝色的较大的细胞为淋巴细胞,共数计数板16个大方格上所有淋巴细胞的个数(不少于200个),统计其中的E玫瑰花结形成的细胞数(结合3个以上绵羊红细胞的淋巴细胞),计算结花百分率,取平均值,即为供试品管或对照管的平均数。样品活力=供试品测定管E玫瑰花结百分率-对照管E玫瑰花结百分率。
2 结果与分析
2.1 多肽含量 用紫外-可见分光光度法,在650 nm波长处测定不同浓度牛血清白蛋白标准品溶液的吸光度,获得标准曲线(见图1),标准方程为:y = 0.0125x+0.0038(R2= 0.9986) 。 样品10×6 倍稀释液吸光度检测值分别为0.330、0.332、0.331,带入标准方程,计算,多肽浓度分别为 26.10 μg/mL、26.26 μg/mL、26.18 μg/mL,平均值为 26.18 μg/mL,样品原液多肽含量平均值为1570.8 μg/mL,符合兽用转移因子口服溶液国家标准多肽含量≥1 mg/mL的规定。

图1 标准曲线图
2.2 分子量 反射模式检测多肽分子量范围为800~8000 Da,获得多种小肽,小肽分子量为800.2175~7475.9980 Da,主要集中于800~4000 Da(图2);线性模式检测分子量范围为4000~20000 Da,获得分子量为6017.6611 Da和8279.9307 Da的两个多肽(图3)。
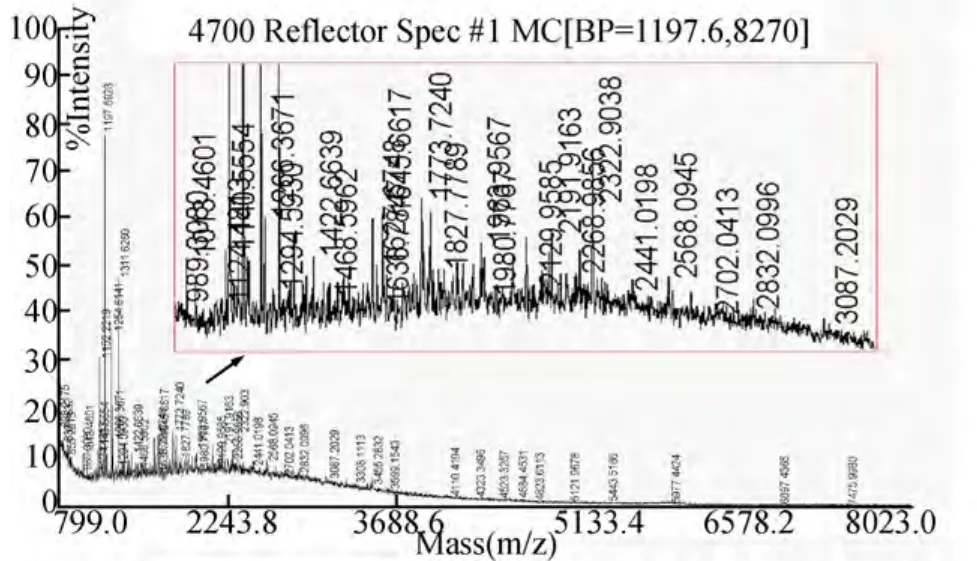
图2 G1_800_8000_反射模式的分子量图谱
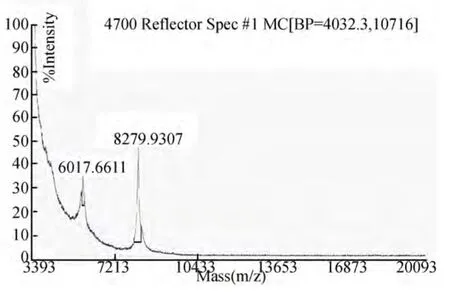
图3 G1_4000_20000_线性模式的分子量图谱
2.3 多肽组成 检测获得多肽共计581种,包括:非酶切方式获得的多肽共512种,主要有T细胞凋亡抑制相关蛋白(TIAL1)、胸腺肽 β4(TMSB4X)、杀菌/通透性增加蛋白(BPIL3)、酶、肌动蛋白、血红蛋白等,具有代表性的多肽(表1);酶切方式获得的多肽共 69种,主要有抑制因子活化蛋白(RAP1Ab)、抗菌肽(Cathelicidin-2)、细胞色素C(Cytochrome c)等,代表性蛋白见表2。
2.4 活力测定 采用脱E受体法测得,对照管16方格所有淋巴细胞268个,E玫瑰花结细胞31个,结花百分率为11.57%,样品管16方格所有淋巴细胞289个,E玫瑰花结细胞65个,结花百分率为22.49%,样品活力为10.92%(图4)。
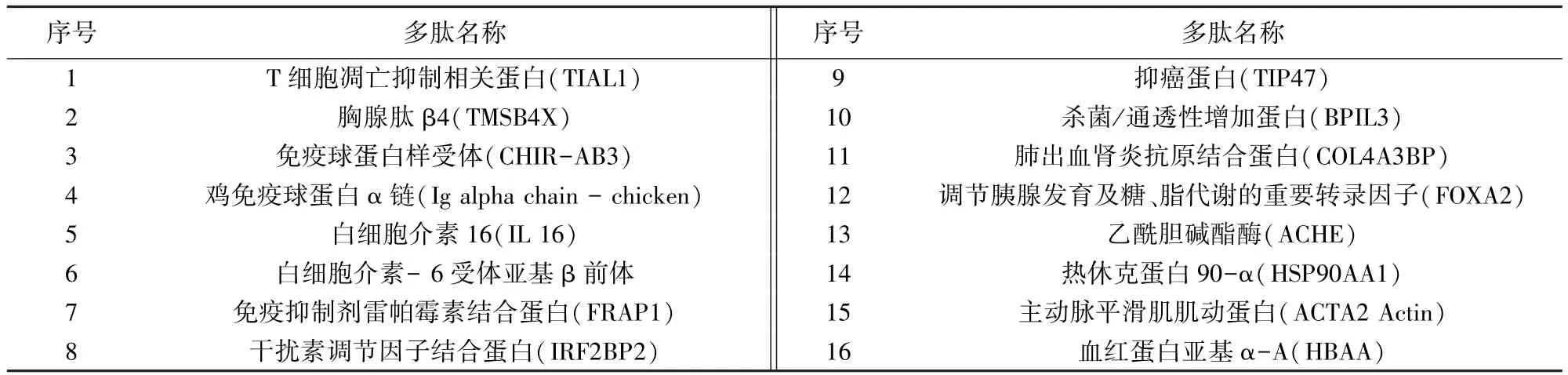
表1 非酶切方式获得的具有代表性的多肽

表2 酶切方式获得的具有代表性的多肽
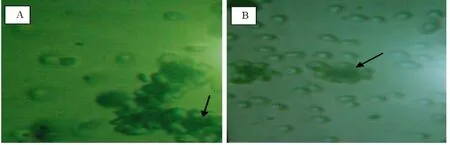
图4 显微镜下E玫瑰花结(A为对照品,B为样品)
3 讨论
3.1 转移因子的多肽组成 转移因子作为一种免疫调节剂广泛应用于人医和兽医领域。国家标准[编号:WS1-(X-451)-2003Z]中规定了其主要成分是多肽和核苷酸。国内众多研究人员对转移因子的氨基酸组成、多肽含量、多肽与核苷酸比例、活性成分混合物等进行了研究。何理平[9]报道,转移因子多肽与小分子RNA的比例为2∶1。范振青等[10]对猪脾转移因子水解后检测,证实其含16种氨基酸,其中以天冬氨酸,谷氨酸和甘氨酸含量较高。刘刚等[11]对转移因子进行氨基酸分析,测得组成多肽的氨基酸占总氨基酸的1/3,游离氨基酸占2/3。凌红丽[12]采用凝胶色谱层析法分离转移因子得到三个洗脱峰并进行活性测定,表明转移因子主要包含三大组分。本试验在验证鸡脾转移因子多肽含量的基础上,利用LC-MS法检测其多肽组成,揭示了鸡脾转移因子含有T细胞凋亡抑制相关蛋白(TIAL1)等581种多肽,并通过查询数据库,获得了对应的蛋白序列,初步阐明了鸡脾转移因子的多肽组成,为国内首次报道。
3.2 转移因子分子量及其分布 转移因子的分子量一般在3000~15000 Da。本试验利用质谱法分析测定鸡脾转移因子分子量分布范围为800 Da~8280 Da,主要为分布于4000 Da以下。虽然利用上述方法测定的分子量都在10000 Da以下,但是在多肽组成测定试验中,仍然分析到了69种分子量大于10000 Da的多肽,具体原因有待进一步研究。
3.3 转移因子功能与组分的关系 转移因子具有增强细胞免疫[13-14]和体液免疫[15],增强非特异性免疫[16]、抗免疫抑制[17]等作用,但具体是何种成分发挥作用暂无报道。本试验在检测确定鸡脾转移因子生物活性的基础上,对其所含多肽进行分析,证实了转移因子含有与细胞结构和运动相关的肌动蛋白,含有与免疫相关的T细胞凋亡抑制相关蛋白、胸腺肽、抑制因子活化蛋白等,含有与生长发育相关的转录因子蛋白,含有与抗应激相关的热休克蛋白,含有与疫病相关的杀菌/通透性增加蛋白、抑癌蛋白、抗菌肽等。上述蛋白均具有一定的生物学活性,可能与转移因子的功能密切相关。下一步需要通过基因合成和体外表达等方式获得相关多肽蛋白,进一步研究其生物活性,进而验证鸡脾转移因子的有效成分和作用机理。
[1]李 鑫.转移因子的研究进展[J].畜禽业, 2010,6: 38-40.
[2]夏 宁,刘海菊,沈 伟,等.卤米松乳膏联合转移因子治疗白癜风疗效观察[J].现代生物医学进展,2013,5:121-123.
[3]范林妮,尹志勇,王文勇.肿瘤特异性转移因子在消化系统肿瘤治疗中的应用[J].细胞与分子免疫学杂志,2011,11:110-111.
[4]郑君英.转移因子治疗小儿反复呼吸道感染疗效分析[J].中华医院感染学杂志,2013(04):156-157.
[5]Klesius PH, Kristensen F Bovine transfer factor: Effect on bovine and rabbit coccidiosis[J].Clinical Immunology, 1977,7(2):240-252.
[6]凌红丽,陆承平,孙海新,等.鸡脾转移因子对肉鸡免疫应答及防病效果的研究[J].中国兽医科学, 2006,07: 46-50.
[7]李犹平,房春林,陈元坤,等.转移因子对猪瘟和猪蓝耳病疫苗免疫增强效果试验[J].兽医导刊,2010,2:47-48.
[8]卫生部.转移因子口服溶液质量标准[S].新药转正标准西药第四十七册,2008:X58-60.
[9]何理平.转移因子在动物医学上的研究进展[J].湖北畜牧兽医,2003,6:44-49.
[10]范振青,李崇荣.口服转移因子阻断小鼠免疫抑制的作用[J].上海免疫学杂志,1994,14(4): 201-202.
[11]刘 刚,刘大涛,刘 征,等.转移因子的性质研究[J].吉林大学自然科学学报, 2000,7(3): 104-106.
[12]凌红丽.鸡脾转移因子的研制、检验规程及其应用[D].南京农业大学,2006:16-25.
[13]Berrón-Pérez R, Chávez-Sánchez R, Estrada-García I, et al.Indications, usage, and dosage of the transfer factor[ J].Rev Alerg Mex, 2007 , 54(4): 134-139.
[14]赵满达,何孟莲,徐 斌.不同动物来源转移因子对肉鸭T细胞转化增殖影响的比较研究[J].中国预防兽医学报,2009,8:84-87.
[15]乔宏兴,张晓根,任 敏.鸡脾转移因子的制备及对雏鸡免疫应答的作用研究[J].甘肃农业大学学报, 2012,1: 19-22; 27.
[16]李士学,侍俊超,周 微,等.特异性和非特异性猪脾转移因子的制备及其免疫活性比较[J].中国生物制品学杂志,2011,10: 75-77.
[17]陈智敏.转移因子对猪病毒性免疫抑制的缓解作用[J].福建畜牧兽医,2012,5: 22-24.
