猪SIgA分泌片的分离纯化及其多克隆抗体的制备
2014-11-23崔焕忠马思慧吴天成兰海楠
张 辉,崔焕忠,杨 欢,马思慧,吴天成,兰海楠,郑 鑫
(吉林农业大学动物科技学院,长春130118)
分泌型 IgA(Secretory immunoglobulin A,SIgA)作为粘膜免疫的主要效应因子,在启动免疫学生物活性,清除病原,保护机体抗感染等方面发挥重要作用[1]。SIgA含量高低与机体的粘膜免疫状况以及癌症等疾病密切相关[2-3],检测SIgA含量不仅可以监测机体粘膜免疫状态,还可有助于疾病诊断。分泌片(secretory component,SC)是构成SIgA分子的组成部分[4],可以通过检测SC来测定SIgA的含量。SC在初乳中以游离和结合两种存在形式存在[5],本研究以初乳为材料,分离纯化游离SC,并制备了抗SC的多克隆抗体,为检测SIgA免疫学检测方法的建立奠定基础。
1 材料与方法
1.1 试验材料 Sephadex G-200凝胶(上海化学试剂厂);DEAE纤维素(DE52)及透析袋(Whatman公司);Anti SC McAb(美国 Sigma公司);蛋白定量试剂盒(北京康为世纪生物科技有限公司);低分子量蛋白质标准(宝生物大连有限公司);猪初乳采自长春市某猪场;雄性健康新西兰大耳白兔(长春市生物制品所)。
1.2 试验方法
1.2.1 初乳中SIgA及分泌片的初步提取 参照胡正强等方法[6],取 100 mL 猪初乳,4 ℃ 5000 r/min 离心30 min,吸取脂肪层与沉淀之间的液体约80 mL,加入叠氮钠至终浓度为0.1%,用1 mol/L HCl调pH至4.0,4500 r/min 离心30 min,弃去沉淀,收集上清液,用 2 mol/L Tris 调 pH 至7.3,4500 r/min 离心30 min,将上清液过0.45 μm滤器,获得初乳提取物。
1.2.2 SephadexG-200分子筛凝胶层析法分离初乳提取物 称取适量的SephadexG-200,用生理盐水充分膨胀,煮沸,按常规方法装柱,用生理盐水平衡至上样。将初乳提取物用生理盐水透析过夜后,加于柱上,利用自动分步收集器收集洗脱液,每管5 mL,用分光光度计测定洗脱液OD280nm值,根据OD280nm值绘制曲线,分别收集不同洗脱峰,第一峰液体主要为IgG和SIgA的混合物,第二峰液体含有SC[7]。
1.2.3 DEAE 52离子交换层析分离第一峰洗脱液将收集的第一峰洗脱液混合在一起,用50%PEG6000浓缩后,用 0.01 mol/L的 PB 液(pH7.4)4℃平衡过夜,中间更换透析液数次,蛋白定量试剂盒测定蛋白浓度。将DEAE 52以碱-酸-碱处理活化后,按照常规方法装柱,用0.01 mol/L的PB液(pH7.4)平衡柱子,至流出液体的pH值与流入液体的pH值相等时,开始上样,待样品进入交换剂中,用少量缓冲液冲洗柱壁,然后用0.01 mol/L的PB液(pH7.4)进行洗脱,利用自动分步收集器收集洗脱液,每管5 mL,洗脱蛋白峰为IgG,至无蛋白洗脱下来时,改用0.1 mol/L的PB液(pH6.8)进行洗脱,收集洗脱液,即为纯化的 SIgA[8]。
1.2.4 硫酸铵盐析法分离纯化第二峰洗脱液中的SC将收集的第二峰洗脱液合并到一起,缓慢加入饱和硫酸铵溶液至终浓度为33%,室温下静置1 h,3000 r/min离心 20 min,弃去沉淀(为 IgG),将上清液装入透析袋,用蒸馏水4℃透析,期间更换蒸馏水数次[9-10]。再用PEG6000浓缩,测定其蛋白浓度。
1.2.5 SDS-PAGE分析纯化蛋白的分子量及纯度配制12%的分离胶,将样品与等量的2倍上样缓冲液混匀,煮沸5 min,加样。积层胶电压为80 V,当电泳至浓缩胶和分离胶界面,再升压至120 V,当溴酚蓝距凝胶边缘1 cm处停止电泳,用考马斯亮蓝G250进行染色,观察纯化的SIgA及SC的分子量,利用凝胶薄层扫描分析蛋白纯度。
1.2.6 琼脂双向免疫扩散鉴定纯化蛋白 称取一定量的琼脂粉,以1%的比例加入生理盐水,充分融化后倒入平皿中,冷却后打孔,取10 μL Anti SC McAb加入中央孔,外周分别加入分离纯化的SIgA和SC液体[11],放入湿盒中,置于37℃培养箱中,24 h后观察结果。
1.2.7 抗SC多克隆抗体的制备 取1 mg纯化的SC,与等体积的弗氏完全佐剂充分乳化后,背部脊柱两侧、皮下分5点接种兔子,共接种3只;二免,两周后取1.5 mg纯化的SC与等体积弗氏不完全佐剂乳化,以相同的免疫方式接种兔子;三免,间隔两周后取2 mg纯化的SC蛋白与等体积弗氏不完全佐剂乳化后,以同样免疫方式接种兔子;加强免疫,三免二周后耳静脉注射不加佐剂纯化的SC蛋白进行加强免疫。加强免疫7 d后,耳静脉采血1 mL,37 ℃静置1 h,4 ℃静置2 h 后,3500 r/min 离心10 min,吸取血清,以分离纯化的SIgA为检测抗原,采用琼脂双向免疫扩散检测血清抗体效价,达到要求后,心脏采血,收集血清,分装后于-20℃冷冻保存。
2 结果
2.1 初乳提取物进行SephadexG-200凝胶层析将初乳提取物过SephadexG-200筛凝胶层析,根据洗脱液OD280nm值绘制曲线,第一峰(收集洗脱液第11~36管)为SIgA(含IgG)和第二峰(收集洗脱液第39~44管)为 SC(图1)。
2.2 第一峰液体过DEAE 52离子交换层析柱将第一峰液体浓缩后,测定其蛋白浓度为0.82 mg/mL,取20 mL蛋白液过DEAE 52离子交换层析柱。用0.01 mol/L的 PB液(pH7.4)洗脱后,再用0.1 mol/L的PB液(pH6.8)洗脱。根据洗脱液OD280nm值绘制曲线(图2),第一峰(收集洗脱液第1~40管)为 IgG,第二峰(收集洗脱液第41~65管)为 SIgA。
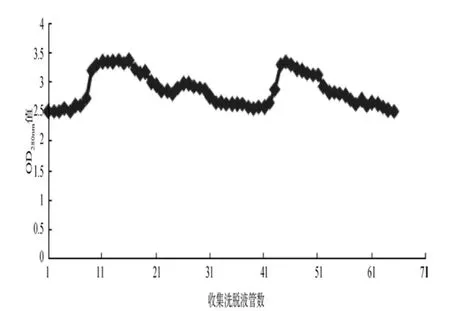
图2 第一峰液体过DEAE 52柱曲线
2.3 SDS-PAGE分析纯化蛋白的分子量及纯度 分离纯化蛋白进行SDS-PAGE,结果表明纯化的SIgA呈现SC、重链和轻链三条带,SC的大小约为70 ku,重链位于66.4和44.3 ku之间约为50 ku,轻链位于29.0 ku和20.1 ku之间约为25 ku。分离的SC的分子量约为70 ku(图3),与报道的大小相近。凝胶薄层扫描分析SIgA和分泌片纯度分别为90%和89%。

图3 提取SIgA和SC的SDS-PAGE结果
2.4 纯化蛋白的鉴定 利用琼脂双向免疫扩散鉴定分离纯化蛋白,结果表明纯化的SIgA和SC分别与Anti SC McAb发生了特异性反应(图4)。

图4 纯化蛋白的鉴定结果
2.5 抗SC多克隆抗体的制备 以纯化的SC为免疫抗原,以纯化的SIgA为检测抗原,制备抗SC多抗隆抗体,琼脂双向免疫扩散测定血清抗体的效价为1 ∶32。
3 讨论
猪初乳来源相对广泛,富含大量的SIgA和SC,且含杂蛋白较少[12],有利于蛋白的分离纯化。本实验选取猪初乳作为SC的提取材料。在猪初乳粗提过程中参照了胡正强等分离纯化方法,首先去除乳中的酪蛋白及脂肪等杂质[13-14],然后根据分离蛋白分子量不同,进行分子筛凝胶层析,将免疫球蛋白与SC分离开,最后根据免疫球蛋白的等电点不同,采用离子交换层析进行分离[15],提取的SIgA纯度较高,为90%,表明该种方法用于纯化SIgA的效果较好,本研究获得的SIgA可用于多抗制备的检测抗原。
通过凝胶层析分离的SC洗脱液中含有少量的IgG,采用33%硫酸铵盐析后,可以将IgG去除,获得SC的纯度为89%,高纯度免疫抗原的获得对于制备特异性多抗非常重要。陈斌利用制备了抗SC单克隆抗体[16],单抗制备成本较高,操作繁琐,而多抗制备相对省事省力。
SIgA与血清IgA在免疫学功能上有着显著区别[17],如何建立有效的方法将SIgA和IgA鉴别开,是准确检测SIgA的关键。血清IgA与SIgA的结构差别在于血清 IgA没有 SC结构[18],由于 SC是SIgA的特异成分,因而可以应用抗SC特异性抗体检测SIgA。本研究以分离纯化的SC为免疫抗原,制备了效价较高的抗SC的多克隆抗体,以期建立特异的检测粘膜组织中SIgA免疫组织化学方法,为下一步开展粘膜免疫激活剂对粘膜组织中SIgA分泌的影响奠定物质基础。
[1]付金龙,刘 沛.SC结构、功能及其临床研究进展[J].世界华人消化杂志,2009,(3):293-298.
[2]孙 立,马健飞,冯江敏,等.尿液SIgA含量测定在非感染性肾脏疾病中的意义[J].中国医科大学学报,2002,(2):146-148.
[3]张宝中.分泌型免疫球蛋白A的研究进展[J].生物技术通讯,2009,20(2):263-265.
[4]曾常茜.分泌型IgA在黏膜抗感染中的作用[J].北华大学学报(自然科学版),2005,6(1):33-35.
[5]唐庆娟,戚 欣,耿美玉.多聚免疫球蛋白受体(pIgR)在粘膜免疫中的重要功能[J].中国生物化学与分子生物学报,2007, 23(9): 724-729.
[6]胡正强,黎 光,江咏梅,等.SIgA分泌片分离、纯化研究[J].微生物学免疫学进展,2002,30,(2):35-38.
[7]吴胜昔,姜 平,李玉峰.抗猪SIgA单克隆抗体的研制[J].中国兽医学报,2005,25(4):390-393.
[8]刘晓飞,高学军,姚永豪,等.牛初乳SIgA分离纯化及其检测方法的研究进展[J].东北农业大学学报, 2008, 39(10): 131-135.
[9]杨 倩,毛卫华.鸡和猪分泌型免疫球蛋白A结构蛋白的比较[J].畜牧与兽医, 2003, 35(10): 5-7.
[10]梁靖坤,王继芳,曹荣峰.奶牛初乳SIgA的提纯与电泳分析[J].中国农学通报, 2009, 25(15): 6-8.
[11]韩建保,王开功,于洪洋.鸡SIgA的提取鉴定及其抗体制备[J].贵州畜牧兽医, 2008, 32(3):5-7.
[12]周盛华,赵红宇,朱洪艳,等.牛初乳中SIgA的分离纯化[J].中国乳品工业, 2011, 39(6):12-13.
[13]周华波,房慧伶,李红蕾,等.鸡SIgA的纯化及兔抗鸡SIgA抗体的制备[J].广西农业生物科学, 2006, 10(12): 24-26.
[14]姚永豪,高学军,刘晓飞,等.牛初乳sIgA的分离纯化[J].乳业科学与技术,2007,25(7):43-44.
[15]冯志新,王海燕,刘茂军,等.猪初乳中SIgA纯化及其单抗制备[J].江苏农业学报, 2011, 27(5): 1026-1030.
[16]陈 斌.SIgA分泌片的原核表达及抗分泌片单克隆抗体的制备[D].江西农业大学,2011.
[17]崔 巍,孙翠明,刘 沛.谷氨酰胺对肠粘膜上皮细胞合成多聚免疫球蛋白受体的影响[J].陕西医学杂志,2011,40(11): 1452-1454.
[18]刘茂柯.猪SIgA直接ELISA检测方法的建立及对猪肺炎支原体灭活疫苗免疫效果的评估[D].四川:四川农业大学,2010.
