煎饼发酵面糊中乳酸菌的鉴定及保护剂配方的优化
2014-11-20唐明礼王勃刘贺何余堂惠丽娟马涛
唐明礼,王勃,刘贺,何余堂,惠丽娟,马涛
(渤海大学化学化工与食品安全学院,渤海大学粮油科学与技术研究所,辽宁锦州,121013)
煎饼的传统生产主要利用面糊及环境中的乳酸菌和酵母菌自然发酵进行摊制,但生产过程易受微生物二次污染、食品质量安全堪忧等问题将被发酵剂取代。乳酸菌广泛应用于发酵剂、益生菌、青贮饲料防腐剂等[1]。在煎饼的生产中乳酸菌有助于形成乳酸、乙醇、二氧化碳、芳香族化合物等化合物,有助于产品的风味、香气和口感,还能提高营养价值,对改善产品品质与安全具有重要作用[2-4]。
真空冷冻干燥在低温条件下利用升华作用去除水分,降低了化学反应速率和减少了对生物结构的破坏[5]。但冻干过程可导致冰晶、高渗环境的形成、细胞膜通透性的改变、敏感蛋白的变性与失活等,从而导致微生物的死亡,通过添加多糖、羟基化合物、蛋白质、聚合物等保护剂能够减低结晶率、提高最大冻结浓缩液和干物质的玻璃化转变温度[6-9],保证了冻干菌的存活率。
本文使用VITEC-2 compact微生物鉴定系统对煎饼发酵面糊中分离的乳酸菌进行鉴定,并制成直投式活菌发酵剂。为满足产品质量的要求,保证戊糖片球菌较高的存活率,本研究重点在于应用响应面分析方法对海藻糖、蔗糖、脱脂乳、L-谷氨酸钠4种保护剂优化戊糖片球菌在真空冷冻干燥过程的生物活性。
1 材料与方法
1.1 材料
菌种:乳酸菌,实验室分离保藏。
试剂:海藻糖 (分析纯),国药集团化学试剂有限公司;甘油 (食品级),连云港友进食品添加剂技术开发有限公司;脱脂乳(食品级),黑龙江完达山乳业股份有限公司;乳糖 (分析纯),天津市化学试剂工厂;葡萄糖(分析纯),天津市天利化学试剂有限公司;蔗糖(食品级),龙舟南华糖业有限公司;L-谷氨酸钠(分析纯),北京市朝阳区中联化工试剂厂;MnSO4(分析纯),天津市致远化学试剂有限公司;GP鉴定卡片,法国梅里埃。
MRS培养基,北京奥博星生物技术有限责任公司;MRS肉汤,北京奥博星生物技术有限责任公司。
1.2 仪器与设备
VITEC-2 compact全自动微生物鉴定仪,法国梅里埃;FreeZone台式真空冷冻干燥机,上海珂淮仪器有限公司;Biofuge Stratos高速冷冻离心机,美国THERMO;GMSX-280手提式压力蒸汽灭菌器,北京市永光明医疗仪器有限公司;HS-1300无菌操作台,苏州安泰;DHP-9082电热恒温培养箱,上海一恒科学仪器有限公司;HH-6数显恒温水浴锅,金坛市鑫鑫试验仪器厂;AR224CN电子天平,奥豪斯仪器(上海)有限公司制造;MDF-382E(CN)超低温冰箱,日本三洋。
1.3 实验方法
1.3.1 VITEC-2 compact微生物鉴定仪对乳酸菌的鉴定
乳酸菌在-4℃的条件进行保藏,测试前将MRS固体培养基上的单菌落悬浮于0.45%的灭菌生理盐水中,并用浊度仪确定浊度为0.5~0.63,将GP卡片插入此菌悬浮液中进行鉴定。GP卡片首先进入填充仓进行填充,使菌悬液进入卡片试剂中,填充完成将卡片放入切片分装仓,仪器进行自动切片、封装,将卡打入孵育仓,此后仪器每15 min自动读卡检测1次,检测完毕后将自动打印报告单。
1.3.2 工艺流程
斜面菌株→活化→摇瓶扩大培养→离心浓缩→制备菌悬液→活菌计数→加入保护剂→预冻→真空冷冻干燥→产品→活菌计数
1.3.3 单一保护剂的制备与选择
将表1中的保护剂按照相应的浓度进行配制,在121℃,15 min的条件下灭菌备用。以生理盐水为对照,测定冻干前后活菌数,计算存活率。

表1 保护剂的种类与用量Table 1 The type and amount of protective agent
1.3.4 菌体的培养与收集
将斜面上的菌株接至含有MRS肉汤的三角瓶中,36℃静置培养12 h,将10 mL菌液加入到100 mL MRS肉汤中进行扩培,使培养液的菌数达到108/mL。将培养液以8 000 r/min、4℃的条件下离心10 min,弃去上清液,以一定量的无菌生理盐水清洗菌泥。
1.3.5 真空冷冻干燥
在无菌的条件下,菌液与保护剂的比例为1∶1条件混合,保护剂与乳酸菌悬液平衡时间为30 min,-70℃预冻2 h,之后进行真空冷冻干燥。冷冻干燥参数为:22Pa、-50℃。
1.3.6 冻干前后活菌数的计算
将乳酸菌离心后的菌悬浮和冻干后的菌粉梯度稀释,平板计数法计数,选择菌落数30~300 CFU/mL的为有效稀释倍数,记录菌落数。
1.3.7 存活率的计算
实验结果以存活率表示,分析真空冷冻干燥对乳酸菌的影响[10-11]。

式中,N:冷冻干燥后乳酸菌的数量;N0:冷冻干燥前乳酸菌的数量。
1.3.8 响应面分析
在单因素实验结果的基础之上,采用Box-Behnken实验设计方案,以海藻糖、谷氨酸钠、蔗糖、脱脂乳为考察变量,分别以A、B、C表示,以存活率Y为响应值,以+1、0、-1分别代表自变量的高、中、低水平,按方程对自变量进行编码。其中,xi为自变量的编码值,Xi为自变量的真实值,X0为实验中心点处自变量的真实值,X为自变量的变化步长[12-15]。因子编码及各自变量水平见表2。

表2 实验因素水平及编码Table 2 Code and level of factors chosen for the trials
2 结果与分析
2.1 VITEC-2 compact微生物鉴定仪对煎饼发酵面糊中乳酸菌的鉴定
使用浊度仪将乳酸菌的菌悬液浊度调为0.55,经过5h的分析鉴定,鉴定结果为戊糖片球菌,可能性百分比为97%,具有良好的鉴定效果。
2.2 单一保护剂对戊糖片球菌存活率的影响
单一保护剂对戊糖片球菌存活率的影响见表3,蔗糖、海藻糖、脱脂乳、谷氨酸钠对戊糖片球菌具有较好的保护效果,海藻糖对菌体的保护效果最好,对菌体的最大存活率可达65%。糖类对菌体的保护作用是冻干过程可取代水分子与磷脂双分子层的极性基团形成氢键,防止了磷脂双分子层的相变,保护了细胞膜的完整性[16]。脱脂乳对菌体的保护作用是脱脂乳中含有乳糖,乳中的胶体物质也提高了玻璃化转变温度,对微生物起到保护作用[17]。甘油通过与结合水发生水化作用,增加溶液的黏度,可防止冰晶的形成,故提高了戊糖片球菌在冷冻干燥过程中的存活率[18]。故选用谷氨酸钠、蔗糖、海藻糖和脱脂乳4种保护剂进行复配实验,以得到较好的存活率。

表3 单一保护剂对戊糖片球菌存活率的影响Table 3 The effect of a single protective agent on survival rate of Pediococcus pentosaceus
2.3 模型的建立及显著性检验
表4列出戊糖片球菌冻干存活率的实测值及预测值,利用Design Expert软件进行实验设计并优化出来的17组实验以及结果见表4。
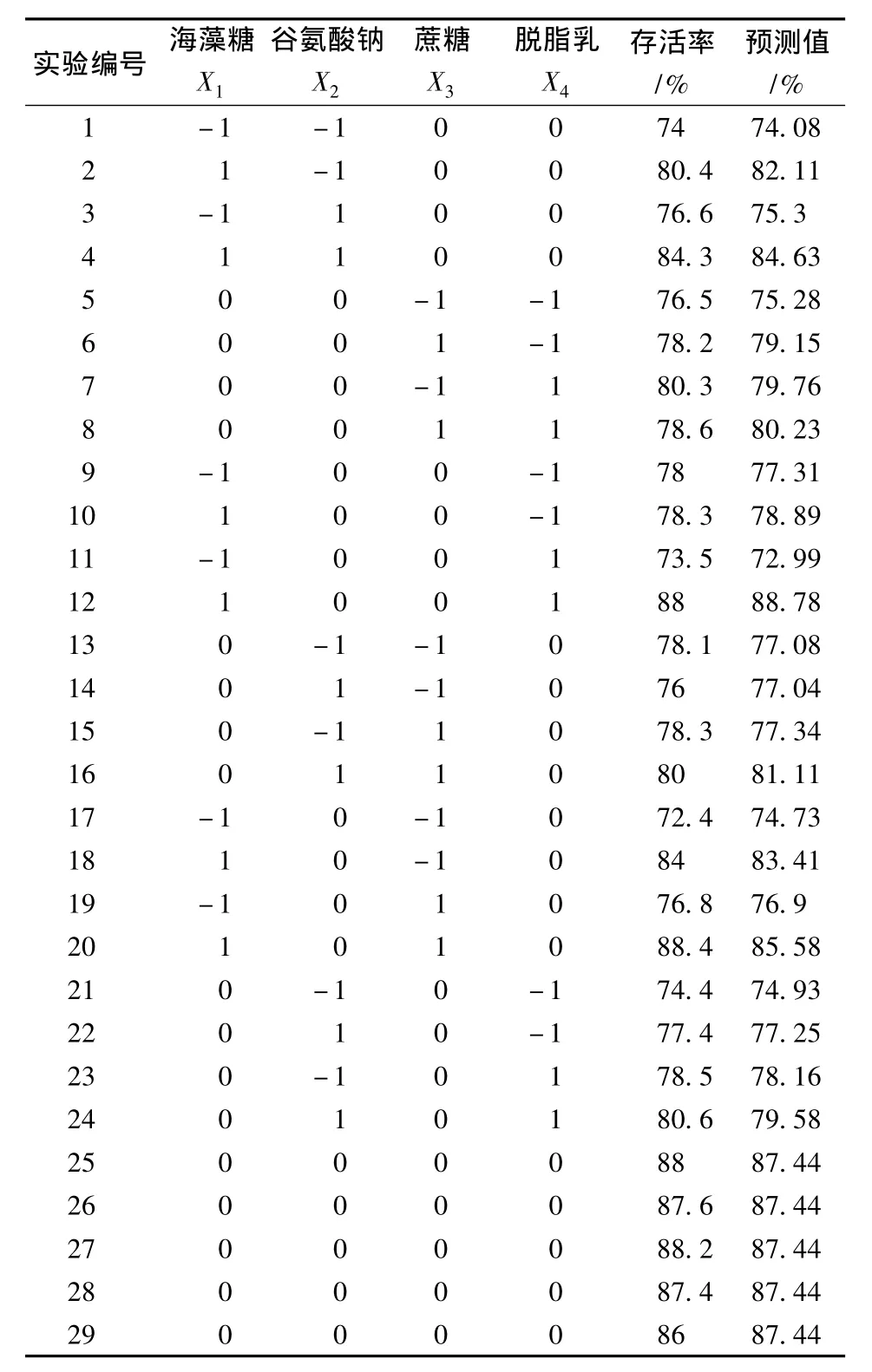
表4 实验设计及其结果Table 4 Experimental designs and results
利用Design Expert(8.0.6)软件对表4数据进行多元回归方程拟合,得到海藻糖(X1)、谷氨酸钠(X2)、蔗糖(X3)、脱脂乳(X4)的二次回归方程为:Y=87.44+4.34X1+0.93X2+1.08X3+1.39X4+0.33X1X2+0.000X1X3+3.55X1X4+0.95X2X3--4.75X42。并对该模型进行模型系数显著性检验及方差分析,见表5和表6。
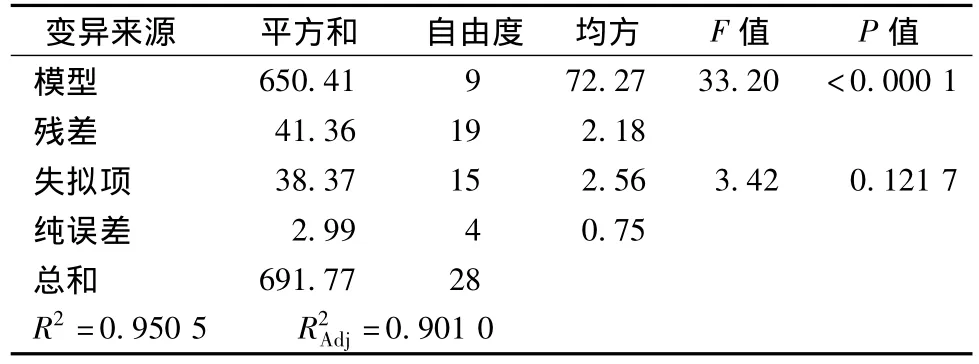
表5 真空冷冻干燥对戊糖片球菌存活率回归模型的方差分析结果Table 5 Analysis of variance for regression equation of Pediococcus pentosaceus survival rate of vacuum freeze-drying
由表5方程回归模型方差分析(ANOVA)可得,F=33.20 > F0.01(9,4)=14.66,P < 0.000 1,表明模型方程极显著。失拟项p=3.42>0.05,不显著。模型的校正决定系数(Adj R2)为0.901 0,说明该模型能解释90.1%响应值的变化,该方程与实际拟合的较好,能有效反应戊糖片球菌存活率与海藻糖、谷氨酸钠、蔗糖、脱脂乳之间的关系,因此所得的方程能预测响应值随各参数的变化规律。
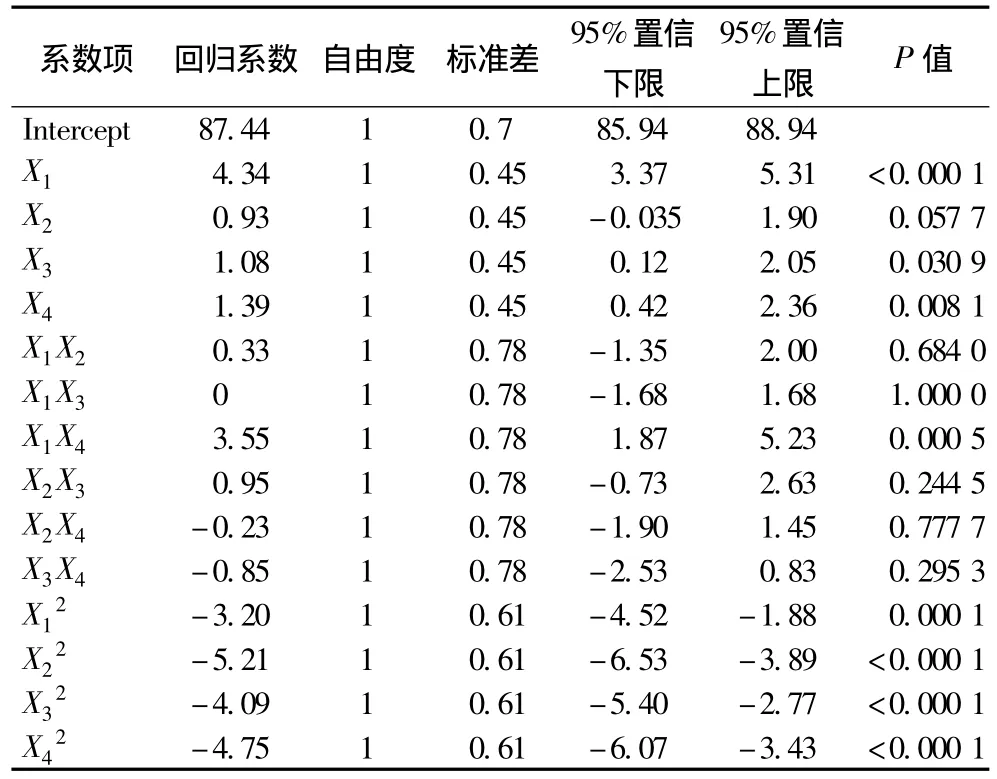
表6 回归方程系数显著性检验Table 6 Test of significance for regression coefficient of Pediococcus pentosaceus survival rate of vacuum freeze-drying
从表6的回归方程系数显著性检验可知,一次项中X1和X4(P<0.01)的偏回归系数极显著,X2(P>0.05)的偏回归系数不显著,X3(P<0.05)的偏回归系数显著,说明海藻糖和脱脂乳对戊糖片球菌的存活率极显著影响,蔗糖对戊糖片球菌的存活极显著影响,谷氨酸钠对存活率影响不显著。交互项X1X4(P<0.05)的交互作用对戊糖片球菌的存活率影响显著,交互项 X1X2、X1X3、X2X3、X2X3、X2X4和 X3X4的 P值大于0.05,说明它们对存活率的影响不显著,二次项的回归系数均极显著,对存活率影响极显著。综合上述分析得知,各因素对响应值的影响程度为X1(海藻糖)>X4(脱脂乳)>X3(蔗糖)>X2(谷氨酸钠)。
2.4 保护剂对酿酒酵母菌存活率的响应面分析
图1~图4为Design-Expert软件对回归方程构建响应面分析图。图1为固定蔗糖14%、脱脂乳12.5%情况下,不同含量的海藻糖和谷氨酸钠对戊糖片球菌的影响,在海藻糖1%~1.4%,谷氨酸钠4%~5.14%时,固定谷氨酸钠,戊糖片球菌的存活率随海藻糖的增加而增加。图2为固定谷氨酸钠5%和脱脂乳12.5%情况下,不同含量的海藻糖和蔗糖对戊糖片球菌的影响,在海藻糖含量1%~1.4%,蔗糖含量12%~14.24%的等高线可看出,固定海藻糖的用量,戊糖片球菌的存活率与蔗糖含量成正比。图3和图4分别是蔗糖、谷氨酸钠和谷氨酸钠、脱脂乳对戊糖片球菌的存活率的影响。

图1 海藻糖、谷氨酸钠及其相互作用对戊糖片球菌存活率的响应面和等高线图Fig.1 Response surface plot and its contour plot showing the effects of trehalose,sodium glutamate and their mutual interactions on pediococcus pentosaceus survival rate
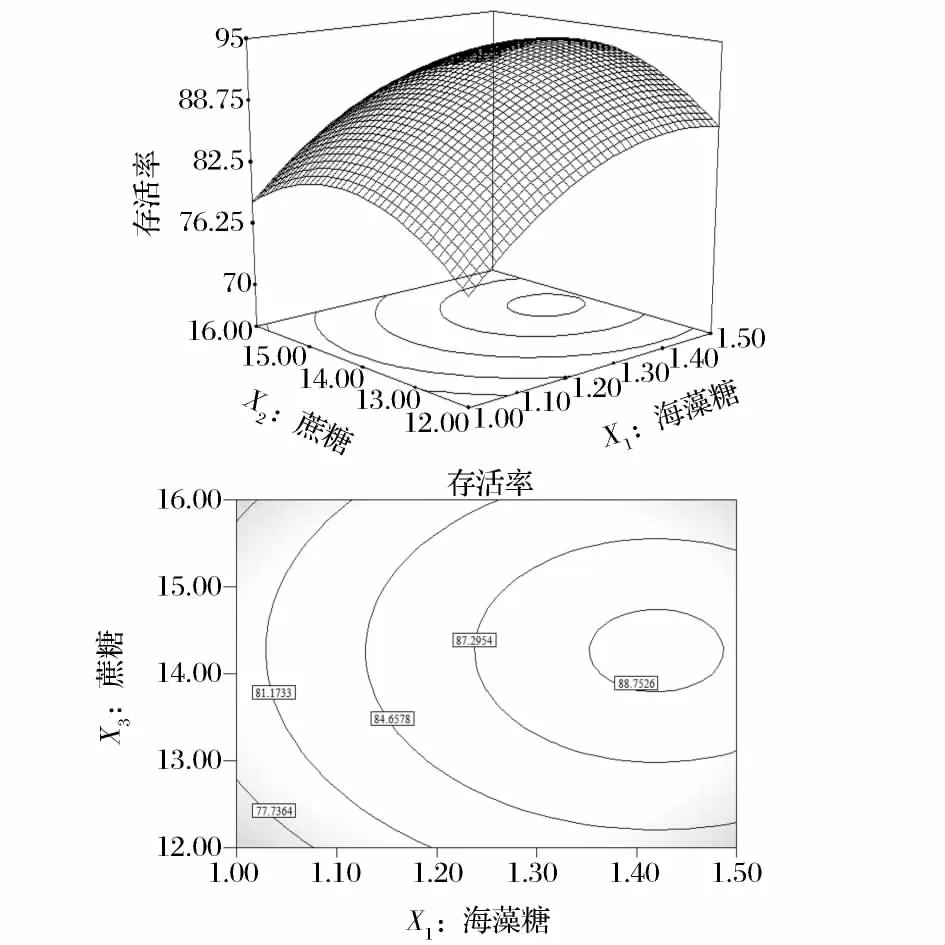
图2 海藻糖、蔗糖及其相互作用对戊糖片球菌存活率的响应面和等高线图Fig.2 Response surface plot and its contour plot showing the effects of trehalose,sucrose and their mutual interactions on Pediococcus pentosaceus survival rate
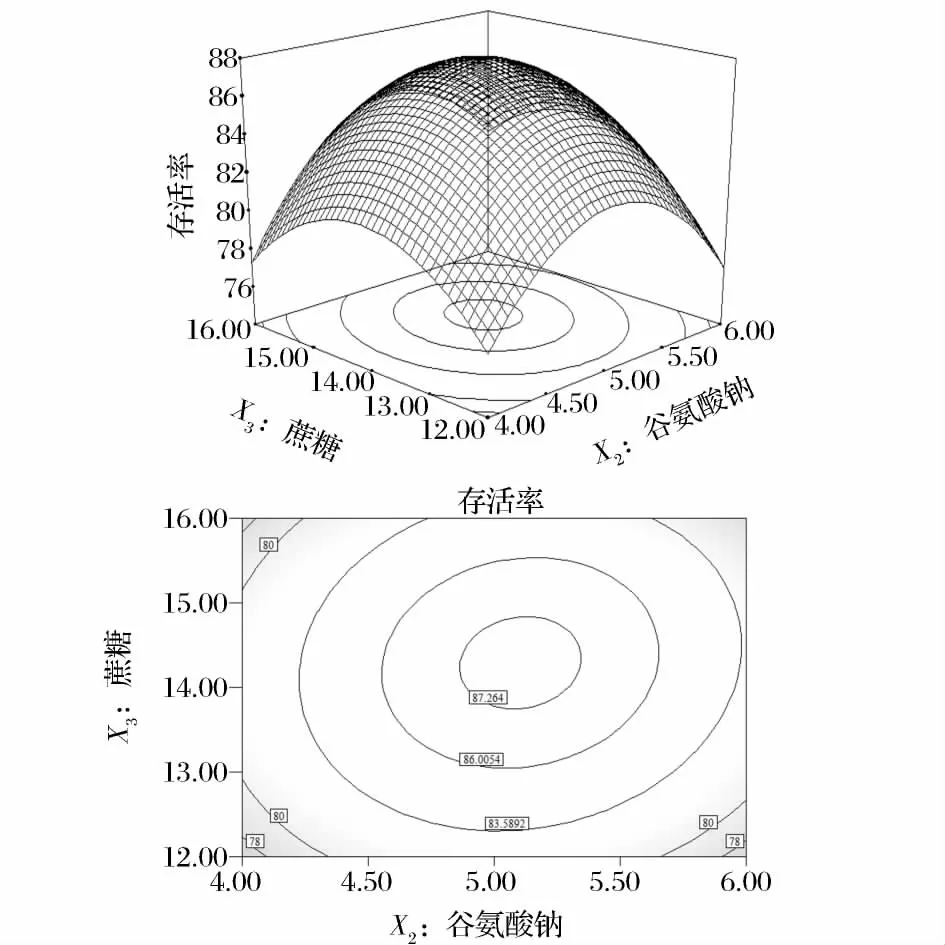
图3 蔗糖、谷氨酸钠及其相互作用对戊糖片球菌存活率的响应面和等高线图Fig.3 Response surface plot and its contour plot showing the effects of sucrose,sodium glutamate and their mutual interactions on Pediococcus pentosaceus survival rate

图4 谷氨酸钠、脱脂乳及其相互作用对戊糖片球菌存活率的响应面和等高线图Fig.4 Response surface plot and its contour plot showing the effects of sodium glutamate,skim milk and their mutual interactions on Pediococcus pentosaceus survival rate
2.4 戊糖片球菌保护剂最佳配方的确定
在选取的各范围内,根据回归模型通过Design Expert软件分析优化得出,戊糖片球菌保护剂的最佳配方为海藻糖 1.38%,谷氨酸钠 4.80%,蔗糖13.80%,脱脂乳13.50%。在此优化条件下戊糖片球菌的存活率可达88.8%。为证实实验结果,用实验中得到的最佳配方重复实验3次并取平均值,戊糖片球菌存活率可达88%,与预测值基本一致,说明该方程与实际情况拟合得较好,充分验证了模型的正确性,说明响应面法适用于戊糖片球菌保护剂成分的回归分析和参数优化。
3 结论
(1)VITEC-2 compact全自动微生物鉴定仪对煎饼发酵面糊中乳酸菌的鉴定结果为戊糖片球菌。
(2)通过单因素实验,从葡萄糖、蔗糖、海藻糖、谷氨酸钠、脱脂乳、乳糖和MnSO4等保护剂中,筛选效果较好的海藻糖、谷氨酸钠、蔗糖、脱脂乳4种保护剂应用响应面方法对复合保护剂进行优化,确定保护剂的最佳配方为:海藻糖1.38%,谷氨酸钠4.80%,蔗糖13.80%,脱脂乳13.50%,在此优化条件下,戊糖片球菌的存活率可达88%。
[1]Schoug Å,Olsson J,Carlfors J,et al.Freeze-drying of Lactobacillus coryniformis Si3-effects of sucrose concentration,cell density,and freezing rate on cell survival and thermophysical properties[J].Cryobiology,2006,53(1):119 -127.
[2]Ibanoglu S,Ainsworth P,Wilson G,et al.The effect of fermentation conditions on the nutrients and acceptability of tarhana[J].Food Chemistry,1995,53(2):143 -147.
[3]Paludan-Müller C,Madsen M,Sophanodora P,et al.Fermentation and microflora of plaa-som,a Thai fermented fish product prepared with different salt concentrations[J].International Journal of Food Microbiology,2002,73(1):61-70.
[4]Visessanguan W,Benjakul S,Smitinont T,et al.Changes in microbiological, biochemicaland physico-chemical properties of Nham inoculated with different inoculum levels of Lactobacillus curvatus[J].LWT-Food Science and Technology,2006,39(7):814 -826.
[5]Gatlin L A,Nail S L.Freeze-drying:a practical overview[J].Bioproc.-Techn,1994,18:317 -367.
[6]Jagannath A,Raju P S,Bawa A S.Comparative evaluation of bacterial cellulose nata as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J].LWT-Food Science and Technology,2010,43(8):1 197-1 203.
[7]Strasser S,Neureiter M,Geppl M,et al.Influence of lyophilization,fluidized bed drying,addition of protectants,and storage on the viability of lactic acid bacteria[J].Journal of Applied Microbiology,2009,107(1):167 -177.
[8]Schoug Å,Olsson J,Carlfors J,et al.Freeze-drying of Lactobacillus coryniformis Si3 -effects of sucrose concentration,cell density,and freezing rate on cell survival and thermophysical properties[J].Cryobiology,2006,53(1):119 -127.
[9]Streeter J G.Effect of trehalose on survival of Bradyrhizobium japonicum during desiccation[J].Journal of Applied Microbiology,2003,95(3):484 -491.
[10]曾小群,潘道东,包红燕,等.干酪乳杆菌冻干保护剂研究[J].中国食品学报,2013,13(1):44-50.
[11]YANG C,ZHU X,FAN D,et al.Optimizing the chemical compositions of protective agents for freeze-drying bifidobacterium longum BIOMA 5920[J].Chinese Journal of Chemical Engineering,2012,20(5):930-936.
[12]Aouadhi C,Simonin H,Prévost H,et al.Inactivation of Bacillus sporothermodurans LTIS27 spores by high hydrostatic pressure and moderate heat studied by response surface methodology[J].LWT-Food Science and Technology,2012,50(2013):50 -56.
[13]高璃珑,王允祥,江汉湖.超高压杀菌条件的响应曲面法优化研究[J].中国农业科学,2004,37(10):1 544-1 549.
[14]吴华勇,黄赣辉,顾振宇,等.响应曲面法优化竹叶总黄酮的提取工艺研究[J].食品科学,2008,29(11):196-200.
[15]曾庆梅,潘见,谢慧明,等.超高压灭活枯草芽孢杆菌(AS 1.140)的参数优化[J].农业工程学报,2005,21(4):158-162.
[16]Crowe J H,Hoekstra F A,Crowe L M.Anhydrobiosis[J].Annual Review of Physiology,1992,54(1):579-599.
[17]Jagannath A,Raju P S,Bawa A S.Comparative evaluation of bacterial cellulose as a cryoprotectant and carrier support during the freeze drying process of probiotic lactic acid bacteria[J].LWT-Food Science and Technology,2010,43(8):1 197-1 203.
[18]PU Li-li,LIU Ning,ZHANG Ying-hua ,et al.The research development of cryoprotector of lactic acid bacteria and its protective mechanism [J].Guangzhou Food Science and Technology,2005(1):147 -149.
