BRAF基因突变检测在甲状腺乳头状病变中的临床意义
2014-11-20张士虎
张 翼 李 惠 陈 劼 张士虎
1.江苏省中医院急诊外科,江苏南京 210029;2.江苏省中医院病理科,江苏南京 210029
甲状腺癌是最常见的内分泌肿瘤,主要包括乳头状癌、滤泡状癌、髓样癌和未分化癌,其中甲状腺乳头状癌最常见,约占85%~90%,以女性多发[1]。由于多种因素,导致甲状腺肿瘤的发病率呈现逐年上升趋势。良性甲状腺病变中常出现乳头状病变,当乳头出现不典型增生时易误诊为癌,从而扩大手术范围,给病人造成不必要的伤害,因此对其性质鉴别具有重要临床意义。而肉眼及显微镜下的观察诊断具有一定的主观性,这就需要一个客观的临床检测指标帮助辨别良恶性。目前多项研究[2,3]指出甲状腺乳头状癌和BRAF V600E突变密切相关,此突变在甲状腺其他良恶性肿瘤中突变率非常低,具有一定特异性,而BRAF V600E在甲状腺不典型乳头状腺瘤中的突变情况尚无人报道。为探讨BRAF基因在甲状腺乳头状病变中的突变情况及临床意义,该研究选取2009年11月—2013年3月以来到该院就诊的56例甲状腺乳头状病变的患者,采用直接测序法分析了甲状腺乳头状癌和甲状腺不典型乳头状腺瘤的BRAF基因突变情况,探讨其在鉴别诊断中的价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2009年11月—2013年3月江苏省中医院病理科54例甲状腺乳头状病变石蜡标本,男16例,女38例;平均年龄4419~70岁。其中甲状腺乳头状癌24例(包括微乳头癌6例),甲状腺不典型乳头状腺瘤30例。所有组织标本均经病理证实,诊断参考2004年WHO诊断标准[4]。甲状腺乳头状癌患者行单侧及峡部全切加颈部淋巴结清扫,甲状腺微小乳头状癌患者行单侧及峡部全切加中央区淋巴结清扫,不典型腺瘤行甲状腺次全切除术,所有患者目前均存活。
1.2 研究方法
1.2.1 基因组DNA提取 切取5张10 um厚石蜡白片,脱蜡消化后提取DNA。具体方法见试剂盒说明书(Omega FFPE DNA Kit,USA)。以凝胶电泳系统检测DNA模板的质量。
1.2.2 PCR扩增 使用ABI-2700型测序级扩增仪,扩增目的基因片段。 反应体系:10×PCR Buffer 2μL,HotStar Taq DNA Polymerase 0.25μL(Q IAGEN,USA),5×Q-Solution 4μL,dNTP 2μL,Primer各 1μL,模板 DNA 1μL,去离子水 8.75μL。 95 ℃ 10 min;94℃50 s,57℃ 1 min,72℃1 min,共循环35次,最后于72℃延伸10 min。PCR产物纯化具体方法见试剂盒说明书(AXYPrep PCR Cleanup Kit,USA)。
1.2.3 测序 测序方法[5]:在3100-Avant遗传分析仪进行测序;Data collection软件自动进行数据处理和分析。对于测序中发现有突变的病例,都进行反向测序验证。将测序结果用DNA sequencing analysis5.1软件分析原始测序数据,获取测序电泳图和序列。将样品序列用AB I SeqScape软件与genebank标准序列进行比对,观察样本基因序列的改变。
1.3 统计方法
数据处理使用SPSS 13.0软件。计数资料采用χ2检验、Fisher’s确切概率法进行显著性检验。
2 结果
经直接测序法测定,54例样本成功检测了BRAF第15外显子突变情况,突变位点全部位于V600E位点,未发现其他类型突变。24例甲状腺乳头状癌,16例发现BRAF基因15外显子第600位密码子A/T杂合(V600E),突变率为 66.7%(16/24)。 而 30例甲状腺不典型腺瘤样本中未发现V600E位点病理性突变(0/30),两者差异有统计学意义(P<0.01)。见表1。研究结果还显示,BRAF V600E突变与性别、年龄、肿瘤大小无关,差异无统计学意义(P>0.05),与组织学类型相关。见表2。

表1 54例甲状腺乳头状病变样本中BRAF基因突变率
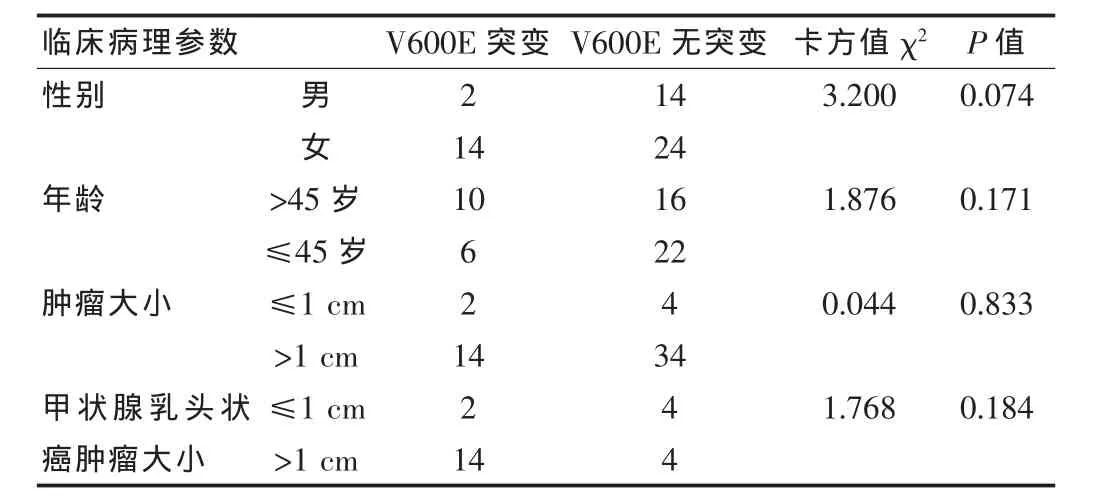
表2 BRAF基因突变与甲状腺乳头状病变患者临床病理特征的关系
3 讨论
甲状腺乳头状癌组织光镜下多表现为乳头状,细胞核毛玻璃样,可观察到核沟,核内包涵体,间质中含有砂粒体,此为重要的特征。而当乳头由于冰冻处理或者其他原因造成不典型时与腺瘤难以鉴别。免疫组化可以用于鉴别诊断,但是免疫组化操作过程中易出现假阴性或者假阳性,人工判读结果也有一定的主观性,易造成误诊。两者治疗和预后差别很大,需要一个客观的检测指标。
BRAF基因为RAF家族成员,位于7号染色体,是编码B型有丝分裂原激活的蛋白激酶依赖性激酶的激酶。研究显示,BRAF基因第15位外显子上的T1799A点突变(V600E)导致BRAF中的缬氨酸(V)被谷氨酸(E)替代,进而持续激活BRAF激酶,造成MAPK通路持续活化,细胞不断分裂、增殖,进而形成肿瘤[6]。在转基因小鼠中通过BRAF突变的表达,可诱导出乳头状癌,表明了BRAF基因在乳头状癌起始中的重要作用[7]。Fukushima等[8]检测了100例甲状腺癌的BRAF基因突变情况,发现BRAF基因的突变仅存在甲状腺乳头状癌中,而且仅发现了V600E突变,阳性率为53%(40/76).多项研究[9-11]显示甲状腺乳头状癌中BRAF基因突变率为29%~87%,而滤泡型腺癌和所有良性病变如单纯性甲状腺肿则无此突变。Zhang[11]等发现在甲状腺细针穿刺标本中71.4%发生BRAF V600E突变,所有BRAF(V600E)阳性的标本甲状腺切除术后都被证实为甲状腺乳头状癌。最近的研究还显示,BRAF(V600E)突变的发生率有地区差异。例如,BRAF V600E突变率在韩国(52%~87%)比其他国家(36%~65%)高[3]。造成这种差异的原因尚不清楚,可能是由于地理因素。一些研究报道了在高碘摄入区BRAF V600E突变率更高,这可能表明碘过量摄入是乳头状癌BRAFV600E突变的一个危险因素[12]。
甲状腺乳头状癌的预后较好,十年生存率超过90%。但是35%的患者在长期随访中有复发[13]。甲状腺乳头状癌的预后与多种因素相关,包括年龄、多灶性、肿瘤最大径、甲状腺外浸润性的生长方式及缺乏肿瘤相关性纤维包膜等。研究显示BRAF V600E突变在经典型甲状腺乳头状癌中确与侵犯表型相关,BRAF V600E影响肿瘤的生长方式,促进浸润转移发生,进而影响甲状腺乳头状癌患者临床预后[14]。这对于甲状腺乳头状癌患者的诊断和治疗具有重要意义。Yong[15]等研究显示73.7%的甲状腺乳头状癌中发现BRAF V600E突变。淋巴结转移,TNM分期,多灶性与BRAF V600E突变并无显著相关。然而,肿瘤大小,甲状腺外侵犯,组织学类型以及并发桥本氏甲状腺炎与BRAF V600E突变有关联。在一项回顾性多中心研究中[16],BRAF V600E突变的存在增加了甲状腺乳头状癌的死亡率。尽管这种联系并不是独立存在的,但支持了BRAF V600E突变对甲状腺乳头状癌预后和治疗影响的进一步研究。
综上所述,BRAF V600E突变在鉴别甲状腺乳头状癌和甲状腺不典型乳头状腺瘤中具有重要意义,对患者的治疗和预后有指导意义,直接测序法结果准确,价格低廉,适合临床推广使用。
[1]Davies L,Welch HG.Increasing incidence of thyroid cancer in the U-nited States[J].JAMA,2006,295(18):2164–2167.
[2]Caronia LM,Phay JE,Shah MH,et al.Role of BRAF in thyroid oncogenesis[J].Clin Cancer Res,2011,17(24):7511-7517.
[3]Kim KH,Kang DW,Kim SH,et al.Mutations of the BRAF gene in papillary thyroid carcinoma in a Korean population[J].Yonsei Med J,2004,45(5):818–821.
[4]DeLellis RA,LLoyd R,Heitz PU.WHO classification of tumors,pathology and genetics-tumors of endocrine organs[J].IARC Press,Lyon,2004.
[5]徐玮,李惠,孙怡,等.软组织肉瘤中C-KIT,PDGFRα基因突变的检测结果分析[J].海南医学,2013,23(24):3439-3442.
[6]Cantwell ER,O'Leary JJ,Sheils OM,et al.BRAFV600E:implications for carcinogenesis and molecular therapy[J].Mol Cancer Ther,2011,10(3):385-394.
[7]Sapio M R,Posca D,Troncone G,et a1.Detection of BRAF mutation in thyroid papillary carcinoma by mutant allele-specific PCR amplification(MASA)[J].EurJ Endocrinol,2006,154(2):341-348.
[8]Fukushima T,Takenoshita S.Roles of RAS and BRAF mutations in thyroid carcinogenesis[J].Fukushima J Med Sci,2005,51(2):67-75.
[9]Hwang J,Shin JH,Han BK,et al.Papillary thyroid carcinoma with BRAFV600E mutation:sonographic prediction[J].AJR Am J Roentgenol,2010,194(5):W425–430.
[10]Nikiforov YE,Nikiforova MN.Molecular genetics and diagnosis of thyroid cancer[J].Nat Rev Endocrinol,2011,7(10):569-580.
[11]Zhang B,Liu S,Zhang Z,et a1.Analysis of BRAF(V600E)mutation and DNA methylation improves the diagnostics of thyroid fine needle aspiration biopsies[J].Diagn Pathol,2014(9):45.
[12]Guan H,Ji M,Bao R,et a1.Association of high iodine intake with the T1799A BRAF mutation in papillary thyroid cancer[J].J Clin Endocrinol Metab,2009,94(5):1612–1617.
[13]Parkin DM,Bray F,Ferlay J,et a1.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[14]Eloy C,Santos J,Soares P,et a1.The preeminence of growth pattern and invasiveness and the limited influence of BRAF and RAS mutations in the occurrence of papillary thyroid carcinoma lymph node metastases[J].Virchows Archiv,2011,459(3):265-276.
[15]Yong SK,Jeong SK,Ja SB,et a1.Clinical implication of the BRAFV600E mutation in papillary thyroid carcinoma[J].World J Surg Oncol,2013(11):99.
[16]Xing M,Alzahrani AS,Carson KA,et a1.Association between BRAF V600E mutation and mortality in patients with papillary thyroid cancer[J].JAMA,2013,309(14):1493-1501.
