Hsa-miR-125b在人胃癌耐药细胞株中的表达及其靶基因的功能分析
2014-11-17程燕陈琳曹忻哈斯其美格谢小冬
程燕,陈琳,曹忻,哈斯其美格,谢小冬
1.兰州大学基础医学院遗传学研究所,兰州730000;2.西北民族大学实验中心,兰州730030;3.兰州大学第一医院感染科,兰州730000
化学治疗是临床治疗胃癌及多种恶性肿瘤的重要手段。5-氟尿嘧啶(5-fluorouracil,5-Fu)作为临床上应用最广泛的嘧啶类抗代谢药物,对胃癌及其他消化道癌具有良好的疗效。但在临床治疗过程中发现,长期应用氟尿嘧啶会使肿瘤细胞对药物由最初的敏感到敏感性下降,直到不敏感而产生获得性耐药[1]。肿瘤的耐药机制比较复杂,最近的研究报道证实microRNA(miRNA)与肿瘤细胞的药物敏感性存在一定相关性。
miRNA是一类约22个核苷酸大小的单链非编码 RNA,它们通过剪切靶基因的转录产物或者抑制转录产物的翻译从而起到转录后负性调控靶基因表达的作用[2]。研究发现miRNA除了在个体发育、肿瘤的发生发展、细胞增殖、分化与凋亡以及疾病发生等方面起重要作用外,还与多种肿瘤多药耐药的发生显著相关[3]。调控肿瘤化疗相关基因的miRNA如果发生了突变、异常表达和异常加工,均会影响到肿瘤细胞的药物敏感度[4,5]。本研究应用基因芯片筛选获得在胃癌氟尿嘧啶耐药细胞株中异常表达的 hsamiR-125b,通过对hsa-miR-125b的靶基因预测、基因注释、功能分析以及信号转导通路富集等一系列生物信息学分析,为进一步研究hsa-miR-125b在胃癌氟尿嘧啶获得性耐药过程中的作用机制提供理论基础。
1 材料和方法
1.1 耐药细胞的诱导培养以及miRNA的检测
人低分化胃腺癌细胞株BGC823应用氟尿嘧啶进行诱导耐药,药物浓度由 10 mg/L培养液终浓度开始递增,通过多次诱导培养,氟尿嘧啶培养液药物终浓度达 50 mg/L,通过 MTT检测两种细胞的IC50,耐药指数大于18.75,获得耐药细胞株BGC823/Fu。分别提取细胞的总RNA,紫外分光光度仪测定A260/280,确定RNA纯度合格后,送上海伯豪生物技术有限公司进行miRNA表达谱芯片检测。本研究采用 Agilent human miRNA V18.0芯片检测两种细胞的 miRNA表达谱,该芯片覆盖 1 908个人类相关miRNA。芯片结果应用Agilent Microarray Scanner进行扫描,采用Feature Extraction software 10.7读取数据,最后应用Gene Spring Software 11.0进行归一化处理。
将BGC823作为对照组,以BGC823/Fu细胞中miRNA表达差异>2.0或<0.5作为筛选条件,进行芯片结果筛选,确定 hsa-miR-125b-5p(引物 hsa-mir-125b-5p:HmiRQP0096; U6:HmiRQ9001; FulenGen)为本次研究对象,并进一步应用实时荧光定量 PCR验证芯片结果。荧光定量PCR扩增条件为:95℃预变性10 min; 95℃变性10 s,55℃复性20 s,72℃延伸10 s,共进行 40 个循环。以 2-DDCt表示 miRNA 的表达水平,∆Ct=Ct样本 miRNA-Ct参照 U6,每个样本重复 3 次实验。
1.2 hsa-miR-125b的基本生物学信息
通 过 miRbase[6](http://www.mirbase.org)查 找hsa-miR-125b序列,应用 NCBI Mapviewer、UCSC Genome Browser等在线工具,获取hsa-miR-125b染色体定位、物种保守性等基本信息。
1.3 hsa-miR-125b靶基因的预测
应用 TargetScan6.2(http://www.targetscan.org/)、PicTar(http://www.pictar.org/)及miRanda(http://www.microrna.org/)三大靶基因预测软件[7,8]对 hsa-miR-125b进行靶基因预测,取三者预测数据的交集再结合miTarbase[9](http://mirtarbase.mbc.nctu.edu.tw/)中已经证实的靶基因形成靶基因集合用于后续分析。
1.4 靶基因的Gene Ontology(GO)分析
应用 DAVID 数据库(http://abcc.ncifcrf.gov/)对hsa-miR-125b的靶基因集合进行 GO注释描述,应用 BiNGO 对靶基因的生物学过程(Biological process,BP)和分子功能(Molecular function,MF)进行 GO注释层次分类及富集分析以及显著性分析,以P<0.001为显著性阈值,分别得到具有统计意义的高频率注释。
1.5 靶基因的信号转导通路分析
利用KEGG 数据库(http://www.genome.jp/kegg/)中Pathway子数据库对hsa-miR-125b的靶基因进行信号转导通路富集分析,通过Fisher Exact Test计算P值,以P<0.01代表靶基因集合相对于背景具有统计学意义的信号转导及疾病通路。
2 结果与分析
2.1 miRNA 表达谱芯片结果
芯片结果显示:与 BGC823相比,BGC823/Fu有29个miRNA表达差异大于2倍或小于0.5倍,其中上调表达的miRNA有17个,主要包括hsa-miR-192-5p、hsa-miR-194-5p、hsa-miR-210-3p、hsa-let-7c、hsa-miR-331-3p等; 下调表达的miRNA有12个,主要包括 hsa-miR-125b-5p、hsa-miR-125a-5p、hsa-miR-221-3p、hsa-miR-130a-3p、hsa-miR-100-5p等。
选取芯片结果中差异最为显著的10个miRNA,应用 RT-qPCR进行芯片结果验证,证实有 7个miRNA与芯片结果一致,其中 hsa-miR-125b-5p的芯片结果显示 Foldchange下调了 24.7倍,而 RT-qPCR结果显示也下调 3.5倍,差异具有显著性(P<0.05),故本文选择hsa-miR-125b-5p作为对象进行重点分析,其他 miRNA因差异没有 hsa-miR-125b-5p显著,故作为次要结果另行分析,不在本文中讨论。Hsa-miR-125b-5p的RT-qPCR验证结果见图1。

图1 hsa-miR-125b-5p在胃癌细胞株中的表达
2.2 hsa-miR-125b的基因定位及保守性分析
由 miRbase数据库获得的序列信息可知 hsamiR-125b定位于人染色体11q24.1,包括人在内的9个物种(人、大鼠、小鼠、短尾负鼠、中国仓鼠、鸡、猕猴、马、真涡虫)间的序列“ucccugagacccuaacuuguga”具有高度的保守性,提示其在生物体内可能具有重要的生物学功能。各物种中miR-125b的成熟体序列号、名称、前体的染色体定位以及保守序列详细信息见表1。
2.3 hsa-miR-125b靶基因预测
应用TargetScan6.2、PicTar及MiRanda分别预测了hsa-miR-125b靶基因数量,分别为814、562、2 592个,对3种预测方法的结果数据取交集共获得62个靶基因。另外,miTarbase数据库中记录的经其他研究应用双荧光素酶报告基因实验和/或Northern blotting方法证实的hsa-miR-125b靶基因共有34个,其中有 17个靶基因与上述预测集合中的数据结果一致,占预测靶基因总数的 27%,说明预测结果具一定可靠性。合计预测靶基因与已验证靶基因,共计获得 79个靶基因的数据集合用于后续的基因注释和通路富集分析。部分预测的靶基因见表2。
2.4 靶基因功能富集分析
应用 DAVID 数据库和 GO数据库对靶基因功能进行富集分析,结果显示:从分子功能看,hsamiR-125b的靶基因主要调节转录、转录酶和转录因子的激活,以及调节蛋白质 N末端、C末端、蛋白质二聚体等蛋白质的结合; 此外,还可调节肽酶、肽类转移酶的活性以及调节微管、锰离子、铜离子的结合等(P<0.001),见表3。

表1 不同物种miR-125b的序列同源性分析

表2 部分预测的hsa-miR-125b的靶基因
从生物学过程看,hsa-miR-125b的靶基因主要参与蛋白质氨基酸的磷酸化与去磷酸化、RNA聚合酶II启动子转录的正负性调控以及DNA 依赖的转录调节; 参与发育过程、细胞周期、细胞生长增殖的负性调控和细胞凋亡的正负性调控; 此外,还参与了Wnt信号通路、细胞因子刺激反应性、药物反应性和 DNA损伤反应性等生物学过程(P<0.001),见表4。
2.5 信号转导通路富集分析
信号转导通路富集分析结果显示:hsa-miR-125b靶基因集合的信号转导通路显著富集于MAPK信号通路、Wnt信号通路、p53信号通路; 另外还涉及到细胞周期过程、细胞凋亡过程、细胞粘附以及前列腺、胰腺、膀胱、肺等多种组织的肿瘤通路中(P<0.01),见表5。
3 讨 论
近年来,越来越多的研究表明miRNA表达水平的改变能影响其对靶基因的转录后调控,从而改变靶蛋白的表达水平,最终影响肿瘤细胞的药物敏感性[10]。本研究发现hsa-miR-125b在胃癌氟尿嘧啶耐药细胞株中表达水平显著下调,提示 hsa-miR-125b与胃癌细胞的氟尿嘧啶耐药性之间有一定的相关性。
miR-125家族成员有 hsa-miR-125a、hsa-miR-125b-1和hsa-miR-125b-2。miR-125a定位于染色体19q13,miR-125b定位于染色体 11q24.1(hsa-miR-125b-1) 和 21q21(hsa-miR-125b-2),分别由这两个位点的5′端剪切形成同一成熟体。miR-125b在多个物种中呈序列高度保守性[11]且并具有双重的生物学功能,既可以作为抑癌基因,抑制肿瘤的发生; 也可以作为促癌基因,在肿瘤组织中高表达。
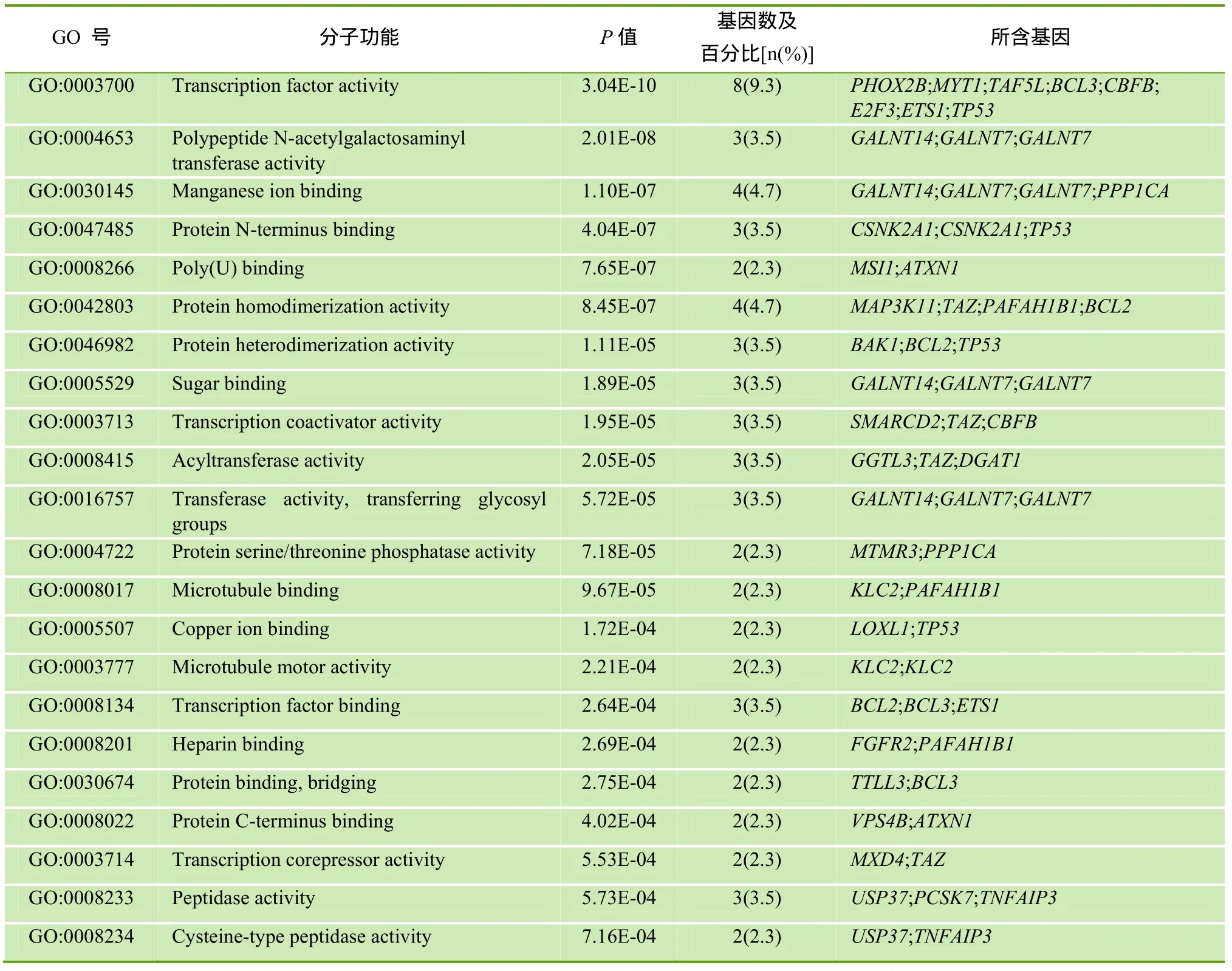
表3 hsa-miR-125b预测靶基因的GO分子功能分类
已报道的研究发现[12,13],hsa-miR-125b与多种肿瘤的化疗敏感性有关,但miR-125b的表达差异与组织或细胞对药物的敏感性并不一致。miR-125b表达下调可以引起肿瘤耐药的发生。例如:miR-125b-1在乳腺癌 SKBR-3细胞中表达下调,当转染外源性的miR-125b-1使其在乳腺癌细胞中高度表达后,它所负性调节的靶基因Her2表达下调,进而抑制了细胞的分裂、增殖和转化,并通过调控细胞周期相关分子的表达使细胞阻滞于 G2M 期,从而增强了细胞对紫杉醇的药物敏感性[14]; 智慧等[15]研究发现胃癌耐药细胞株SGC7901/VCR中miR-125b表达下调,抑制靶基因BCL2、MCL1的作用减弱,促进了细胞对长春新碱的耐药性。这些研究表明在细胞耐药过程中,miR-125b主要起到了抑癌基因的作用,当miR-125b表达下调时,它的抑癌作用和促细胞凋亡作用减弱,从而引起耐药的发生。然而,另外一些研究发现 miR-125b表达上调又可以引起肿瘤耐药的发生。Kong等[16]研究发现卵巢癌细胞株中miR-125b表达上调,通过进一步靶向调节BAK1从而抑制化疗药物顺铂的细胞毒性和细胞凋亡,继而增加细胞对药物的耐药性,说明miR-125b主要起到了原癌基因的作用,当miR-125b表达上调时,它的促癌作用进一步加强进而引发耐药。
从上述结果看,虽然miR-125b在细胞中的表达变化情况并不一致,但都显示出miR-125b主要是通过抑制肿瘤细胞的凋亡,促进肿瘤细胞的增殖来影响肿瘤化疗敏感性,这可能与miR-125b具有的双重生物学作用有关。此外,Shi等[17]研究发现miR-125b的正常表达有助于使细胞分裂正常停止在G1/S转变点,而人U251胶质瘤干细胞中miR-125b的低表达
使细胞增殖绕过了G1/S检查点而大量增殖进而发生化疗耐药,说明miR-125b还可以通过作用细胞周期环节来影响肿瘤化疗耐药性。它所调控的靶基因在细胞周期、细胞增殖和细胞凋亡等过程中具有重要的生物学功能。

表4 hsa-miR-125b预测靶基因的GO生物学过程分类
目前,已有大量的实验证据表明信号转导通路与多种肿瘤的耐药性密切相关。本文通过对 hsamiR-125b的靶基因进行功能富集分析和信号转导通路富集分析,发现 hsa-miR-125b的靶基因主要富集于MAPK信号通路、Wnt信号通路、p53信号通路、细胞周期、细胞凋亡等信号通路,并参与细胞周期、细胞增殖、细胞凋亡的正负性调控以及细胞因子刺激反应性、药物反应性、DNA损伤反应性等生物学过程中。在MAPK信号转导通路中,细胞外信号调节激酶(ERK1/2)、JNK氨基末端激酶(JNK/SAPK)和P38丝裂原活化蛋白激酶(P38MAPK)都参与了细胞增殖、细胞凋亡和细胞分化过程,miR-125b通过调控这些通路中靶基因的表达,进而影响到细胞的增殖和凋亡,改变了肿瘤对化疗药物的敏感性[18~21]。Wnt信号通路是调控细胞生长、发育和分化的关键通路之一,其中经典的 Wnt/β-catenin通路主要参与调控细胞的增殖、分化、极化、凋亡与抗凋亡过程。周秀怀[22]研究发现抑制Wnt/β-catenin信号通路能够增加食管癌顺铂化疗敏感性; 此外,还有报道发现Wnt信号通路与肝癌细胞对5-FU的耐药性、与胰腺癌对吉西他滨耐药性、与乳腺癌的多药耐药性、与结肠癌干细胞的耐药性密切相关[23~26]; p53作为抑癌基因与细胞周期调控和细胞凋亡有关,p53突变或表达异常可导致化疗耐受,它通过精细的调控机制引起一系列基因包括其它肿瘤抑制基因表达的改变,从而诱导细胞周期阻滞、激活 DNA修复和凋亡机制。p53通路下游靶基因的活化及p53与其他分子/基因间的相互作用都会影响肿瘤的耐药性[27~30]。除了上述信号转导通路的作用,化疗药物的抗肿瘤效应还会通过直接引起细胞周期停滞、细胞凋亡等过程来实现。有研究报道miRNA通过与细胞凋亡抑制因子的靶向调控、与细胞周期调控因子的负性调节来影响药物作用的发挥,最终导致耐药的产生[31~34]。
基于本文生物信息学分析和已有的研究结果,BGC823/Fu细胞株中 hsa-miR-125b表达显著下调,有可能通过上调MAPK信号通路、Wnt信号通路、p53信号通路,以及细胞周期、细胞凋亡等信号通路和生物学过程中的靶基因,进而增加了胃癌的细胞增值能力和抗凋亡的能力,降低了肿瘤细胞对化疗药物的敏感性,最终改变了胃癌对氟尿嘧啶的药物反应性。这一结果为研究hsa-miR-125b在肿瘤耐药过程中的调控机制和作用机理,提供了可靠的研究线索和可行的研究策略,也为miRNA作为靶点恢复肿瘤对药物的敏感性提供了研究基础[35]。
[1]Lippert TH,Ruoff HJ,Volm M.Intrinsic and acquired drug resistance in malignant tumors.The main reason for therapeutic failure.Arzneimittelforschung,2008,58(6):261–264.
[2]O’Donnell KA,Wentzel EA,Zeller KI,Dang CV,Mendell JT.C-Myc-regulated microRNAs modulate E2F1 expression.Nature,2005,435(7043):839–843.
[3]Blower PE,Chung JH,Verducci JS,Lin S,Park JK,Dai Z,Liu CG,Schmittgen TD,Reinhold WC,Croce CM,Weinstein JN,Sadee W.MiRNAs modulate the chemosensitivity of tumor cells.Mol Cancer Ther,2008,7(1):1–9.
[4]Zheng T,Wang J,Chen X,Liu L.Role of microRNA in anticancer drug resistance.Int J Cancer,2010,126(1):2–10.
[5]Iorio MV,Croce CM.MicroRNAs in cancer:small molecules with a huge impact.J Clin Oncol,2009,27(34):5848–5856.
[6]Kozomara A,Griffiths-Jones S.miRBase:integrating microRNA annotation and deep-sequencing data.Nucleic Acids Res,2011,39:152–157.
[7]Lewis B P,Burge C B,Bartel V.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are MicroRNA targets.Cell,2005,120(1):15–20.
[8]Betel D,Wilson M,Gabow A,Marks DS,Sander C.The microRNA.org resource:targets and expression.Nucleic Acids Res,2008,36:149–153.
[9]Hsu SD,Lin FM,Wu WY,Liang C,Huang WC,Chan WL,Tsai WT,Chen GZ,Lee CJ,Chiu CM,Chien CH,Wu MC,Huang CY,Tsou AP,Huang HD.miRTarBase:a database curates experimentally validated microRNA-target interactions.Nucleic Acids Research,2011,39:163–169.
[10]Fojo T.Multiple paths to a drug resistance phenotype:mutations,translocations,deletions and amplification of coding genes or promoterregions,epigenetic changes and microRNAs.Drug Resist Updat,2007,10(1–2):59–67.
[11]Sun YM,Lin KY,Chen YQ.Diverse functions of miR-125 family in differentcell contexts.J Hematol Oncol,2013,6:6.
[12]Xia HF,He TZ,Liu CM,Cui Y,Song PP,Jin XH,Ma X.MiR-125b expression affects the proliferation and apoptosis of human glioma cells by targeting Bmf.Cell Physiol Biochem,2009,23(4–6):347–358.
[13]Mizuno Y,Yagi K,Tokuzawa Y,Kanesaki-Yatsuka Y,Suda T,Katagiri T,Fukuda T,Maruyama M,Okuda A,Amemiya T,Kondoh Y,Tashiro H,Okazaki Y.miR-125b inhibits osteoblastic differentiation by down-regulation of cell proliferation.Biochem Biophys Res Commun,2008,368(2):267–272.
[14]胡斌,吴爱国,李学孝,纪术峰,王梦川,吴凯,邵国利.miR-125b-1 增强乳腺癌 SKBR-3 细胞对紫杉醇的药物敏感性.热带医学杂志,2012,12(7):789–792.
[15]智慧,朱伟,王同杉,王建,束永前,刘平.miR-125b靶向抑制 BCL2、MCL1表达对胃癌 SGC7901/VCR细胞多药耐药性的影响.南京医科大学学报,2011,6:777–781.
[16]Kong F,Sun C,Wang Z,Han L,Weng D,Lu Y,Chen G.miR-125b confers resistance of ovarian cancer cells to cisplatin by targeting pro-apoptotic Bcl-2 antagonist killer 1(BAK1)expression.J Huazhong Univ Sci Technolog Med Sci,2011,31(4):543–549.
[17]Shi L,Zhang J,Pan T,Zhou J,Gong W,Liu N,Fu Z,You Y.MiR-125b is critical for the suppression of human U251 glioma stem cell proliferation.Brain Res,2010,1312:120–126.
[18]Duman BB,Sahin B,Acikalin A,Ergin M,Zorludemir S.PTEN,Akt,MAPK,p53 and p95 expression to predict trastuzumab resistance in HER2 positive breast cancer.J BUON,2013,18(1):44–50.
[19]Pritchard AL,Hayward NK.Molecular pathways:mitogen-activated protein kinase pathway mutations and drug resistance.Clin Cancer Res,2013,19(9):2301– 2309.
[20]Paunovic V,Harnett MM.Mitogen-activated protein kinases as therapeutic targets for rheumatoid arthritis.Drugs,2013,73(2):101–115.
[21]邢风娟,王岩,孟令杰.肿瘤多药耐药机制及其相关信号通路的研究进展.中国实验诊断学,2013,17(2):379–382.
[22]周秀怀.抑制Wnt /β-catenin 信号通路增加食管癌顺铂化疗敏感性的研究.细胞与分子免疫学杂志,2011,27(12):1354–1355.
[23]Yang Y,Mallampati S,Sun B,Zhang J,Kim SB,Lee JS,Gong Y,Cai Z,Sun X.Wnt pathway contributes to the protection by bone marrow stromal cells of acute lymphoblastic leukemia cells and is a potential therapeutic target.Cancer Lett,2013,333(1):9–17.
[24]Deng Y,Su Q,Mo J,Fu X,Zhang Y,Lin EH.Celecoxib downregulates CD133 expression through inhibition of the Wnt signaling pathway in colon cancer cells.Cancer Invest,2013,31(2):97–102.
[25]Harati R,Benech H,Villégier AS,Mabondzo A.P-glycoprotein,breast cancer resistance protein,Organic Anion Transporter 3,and Transporting Peptide 1a4 during blood-brain barrier maturation:involvement of Wnt/β-catenin and endothelin-1 signaling.Mol Pharm,2013,10(5):1566–1580.
[26]Xu N,Shen C,Luo Y,Xia L,Xue F,Xia Q,Zhang J.Upregulated miR-130a increases drug resistance by regulating RUNX3 and Wnt signaling in cisplatin-treated HCC cell.Biochem Biophys Res Commun,2012,425(2):468–472.
[27]Höpker K,Reinhardt HC.p53-regulating pathways as targets for personalized cancer therapy.Dtsch Med Wochenschr,2013,138(3):82–86.
[28]Gottschalk B,Klein A.Restoration of wild-type p53 in drug-resistant mouse breast cancer cells leads to differential gene expression,but is not sufficient to overcome the malignant phenotype.Mol Cell Biochem,2013,379(1–2):213–227.
[29]Atsumi Y,Inase A,Osawa T,Sugihara E,Sakasai R,Fujimori H,Teraoka H,Saya H,Kanno M,Tashiro F,Nakagama H,Masutani M,Yoshioka K.The Arf/p53 protein module,which induces apoptosis,down-regulates histone H2AX to allow normal cells to survive in the presence of anti-cancer drugs.J Biol Chem,2013,288(19):13269–13277.
[30]Kapoor NR,Ahuja R,Shukla SK,Kumar V.The HBx protein of hepatitis B virus confers resistance against nucleolar stress and anti-cancer drug-induced p53 expression.FEBS Lett,2013,587(9):1287–1292.
[31]Schoof CR,Botelho EL,Izzotti A,Vasques Ldos R.MicroRNAs in cancer treatment and prognosis.Am J Cancer Res,2012,2(4):414–433.
[32]Zhang J,Wang Y,Zhen P,Luo X,Zhang C,Zhou L,Lu Y,Yang Y,Zhang W,Wan J.Genome-wide analysis of miRNA signature differentially expressed in doxorubicin-resistant and parental human hepatocellular carcinoma cell lines.PLoS ONE,2013,8(1):e54111.
[33]Haenisch S,Cascorbi I.miRNAs as mediators of drug resistance.Epigenomics,2012,4(4):369–381.
[34]Maftouh M,Avan A,Galvani E,Peters GJ,Giovannetti E.Molecular mechanisms underlying the role of microRNAs in resistance to epidermal growth factor receptor-targeted agents and novel therapeutic strategies for treatment of non-smallcell lung cancer.Crit Rev Oncog,2013,18(4):317–326.
[35]Allen KE,Weiss GJ.Resistance may not be futile:microRNA biomarkers for chemoresistance and potential therapeutics.Mol Cancer Ther,2010,9(12):3126–3136.
