BMP-7对大鼠脑缺血再灌注损伤后Caspase-9表达的影响
2014-11-17裴海涛曹东明李红云郭壮丽
裴海涛, 曹东明, 李红云, 郭壮丽
骨形态发生蛋白-7(bone morphogenetic protein-7,BMP-7)是β转化生长因子(TGF-β)超家族中的一员,广泛应用于开放性骨折及脊柱融合术中[1]。近年研究发现,大鼠脑缺血后,BMP-7能够通过血脑屏障达缺血侧脑组织,并且促进大鼠神经功能恢复[2]。体外细胞培养证实,BMP-7能抑制低钾引起的神经细胞凋亡,具有抗凋亡作用[3]。动物实验研究表明,BMP-7可抑制大鼠大脑中动脉缺血再灌注后的细胞凋亡,但是其作用机制仍十分不清楚[4]。细胞凋亡是脑缺血再灌注损伤的重要机制,主要由特异性半胱氨酸蛋白酶(Caspase)介导,其中Caspase-9是细胞凋亡线粒体通路的重要启动酶[5]。本实验通过观察BMP-7对大鼠脑缺血再灌注损伤后Caspase-9表达的影响,探讨其对脑缺血再灌注损伤的保护机制。
1 材料与方法
1.1 材料 成年清洁级雄性Wistar大鼠50只,体质量230~250 g,[青岛市实验动物和动物实验中心提供,许可证号:SCXK(鲁)20090007。兔抗鼠Caspase-9一抗(Abcam,美国);BMP-7(北京博奥森);免疫组化试剂盒(北京博奥森);SYBR Green Real-time PCR试剂盒和逆转录试剂盒(TAKARA,日本);BCA蛋白定量试剂盒(江苏碧云天);Trizol(Invitrogen,美国);Caspase-9引物由上海生工合成。
1.2 方法
1.2.1 模型制备 实验前将动物置于实验室适应环境1 w,自由进食、饮水,室温(23±2)℃,自然光照,术前禁食12 h。参考Longa等[6]方法,应用线栓法经左侧颈外-颈内动脉插线建立缺血2 h再灌注24 h模型。术中和术后用恒温电热毯保持动物肛温36℃~37℃。以大鼠术后麻醉清醒后出现左侧Honer征、提尾右侧上肢屈曲、爬行时向右侧转圈者为模型成功的标志,假手术组插线10 mm后即刻退出,其余操作同手术组。
1.2.2 动物分组和给药方法 将实验动物随机分为4组:假手术组、模型组、BMP-7低剂量组(0.1 mg/kg)、BMP-7 高剂量组(0.2 mg/kg),每组10只。治疗组在缺血2 h后经尾静脉给予不同剂量BMP-7(250μl),假手术组和模型组同步给予等体积的生理盐水。
1.2.3 神经功能评分 大鼠缺血再灌注后,按照Longa等[2]5分法,进行神经功能评分。0分:无明显神经功能缺失;1分:对侧前爪不能完全伸直;2分:行走时向对侧旋转;3分:行走时向对侧倾倒;4分:不能自发行走,意识丧失。
1.2.4 HE染色 缺血2 h再灌注24 h后,每组各取5只大鼠,用10%水合氯醛麻醉后打开腹腔后,依次用生理盐水、4%多聚甲醛灌注后,断头取脑,置于4%多聚甲醛固定。脑组织常规梯度乙醇脱水、二甲苯透明、石蜡包埋,自视交叉后连续冠状位切片,片厚5μm。切片常规脱蜡水化,蒸馏水冲洗后,行HE染色,光学显微镜下观察脑组织病理变化。
1.2.5 免疫组织化学染色 取上述石蜡切片,常规脱蜡水化,蒸馏水冲洗后,按照说明书进行Caspase-9免疫组织化学染色,光镜下观察胞质有棕色颗粒者为阳性细胞。部分切片不加一抗,用0.01 mmol/L PBS代替,作为阴性对照。每张切片在皮质区随机取5个不重叠的高倍镜视野(400×),计数各视野阳性细胞数,取其均数。
1.2.6 实时定量RT-PCR检测 缺血2 h再灌注24 h后,每组各取5只大鼠,快速断头取脑分离皮质后置于-80℃冰箱中保存。取缺血侧皮质100 mg,用Trizol试剂盒说明进行总RNA的提取测定其纯度及浓度。将总RNA用逆转录试剂盒进行逆转录得到 cDNA。取1μl cDNA为模板,采用SYBR Green Real-time PCR试剂盒,在Bio-Rad iCycler iQ实时定量PCR仪上检测各组Caspase-9 mRNA含量。反应体系为20μl,反应条件如下:先95℃ 60 s,再95℃ 10 s,60℃ 30 s,循环反应40次。采用2-△△Ct法比较Caspase-9在各组中的表达差异。△△Ct=目的基因的CT平均值-内参基因的CT平均值。引物应用Primer Premier软件设计,引物序列为:Caspase-9上游引物5’-TCA CGG CTT TGA TGG AGA TG-3’,下游引物5’-AGA GAGGAT GAC CAC CAC GAA-3’;内参 GAPDH上游引物5’-GACAACTTTGGTATCGTGGAAGG-3’;下游引物 5’-CCA GTA GAG GCA GGG ATG ATG T-3’。
1.2.7 Western blot检测 取-80℃保存的缺血侧皮质100 mg,按1:4比例加入400μl预冷细胞裂解液中,充分研磨,4℃ 12000 r/min离心20 min,取上清液,采用BCA法进行蛋白定量,并将蛋白样品标准化。取30μg蛋白样品,用10%SDSPAGE电泳分离蛋白质,分离的蛋白质转移到硝酸纤维素膜上,用10%脱脂牛奶封闭1 h后加入兔抗鼠Caspase-9单克隆抗体(1:1000),4℃孵育过夜。取出上述膜,TBST洗3次,每次15 min。在膜上加入生物素标记二抗后室温孵育1.5 h,TBST洗膜3次后用ECL化学发光法显色,曝光后保存图片,以β-actin为内参,应用Quantity One分析软件对蛋白条带进行灰度扫描。
1.2.8 统计学处理 采用 SPSS 17.0统计软件分析,数据以χ±s表示,多组数据采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 神经功能行为评分 假手术组无神经功能缺损症状,其余各组大鼠出现不同程度的神经功能缺损。BMP-7中、高剂量组神经功能评分(1.6±0.5;1.4 ±0.5)与模型组(2.8 ±0.5)相比显著降低(t=3.79,t=4.43,P <0.01)。
2.2 大鼠梗死侧皮质病理学变化 假手术组大鼠皮质组织结构完整,胞浆、胞核结构清晰,神经细胞、胶质细胞和毛细血管形态及分布正常(见图1A)。模型组皮质神经细胞数量减少,胞浆、胞核界限不清,核固缩和核溶解,细胞明显肿胀坏死(见图1B)。与模型组相比,BMP-7治疗组神经细胞数量增多,细胞形态相对规则,核固缩和核溶解减轻,水肿减轻(见图1C),且以BMP-7高剂量组改善最为明显(见图1D)。
2.3 大鼠梗死侧皮质活性Caspase-9表达 疫组织化学染色显示,假手术组大鼠皮质可观察到少量 Caspase-9 阳性细胞(1.4 ±1.1),模型组 Caspase-9阳性细胞数(28.8±5.2)较假手术组显著增多(t=11.58,P <0.01)。与模型组相比,BMP-7 低、高剂量组Caspase-9阳性细胞数(18.8±3.3;13.2±3.7)显著减少(t=3.19,t=5.49;P < 0.05,P <0.01)(见图2、图3)。
2.4 大鼠梗死侧皮质Caspase-9 mRNA的表达
实时定量RT-PCR扩增曲线显示,各组大鼠缺血侧皮质Caspase-9扩增良好。与模型组相比,BMP-7中、高剂量组 Caspase-9 mRNA 表达(2.33±0.29;1.85 ±0.32)显著减少(t=2.56,t=4.52;P <0.05,P <0.01)(见图4)。
2.5 大鼠梗死侧皮质活性Caspase-9蛋白的表达 Western blot检测显示,假手术组活性Caspase-9呈很低量表达,与模型组相比,BMP-7低、高剂量组活性Caspase-9蛋白表达平均灰度值显著降低(t=3.11,t=5.62;P <0.05,P <0.01)(见图5)。

图1 再灌注后大鼠脑组织病理改变(×200)
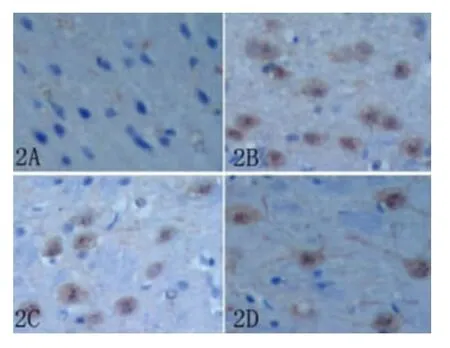
图2 各组大鼠缺血侧皮质Caspase-9阳性细胞(×400)
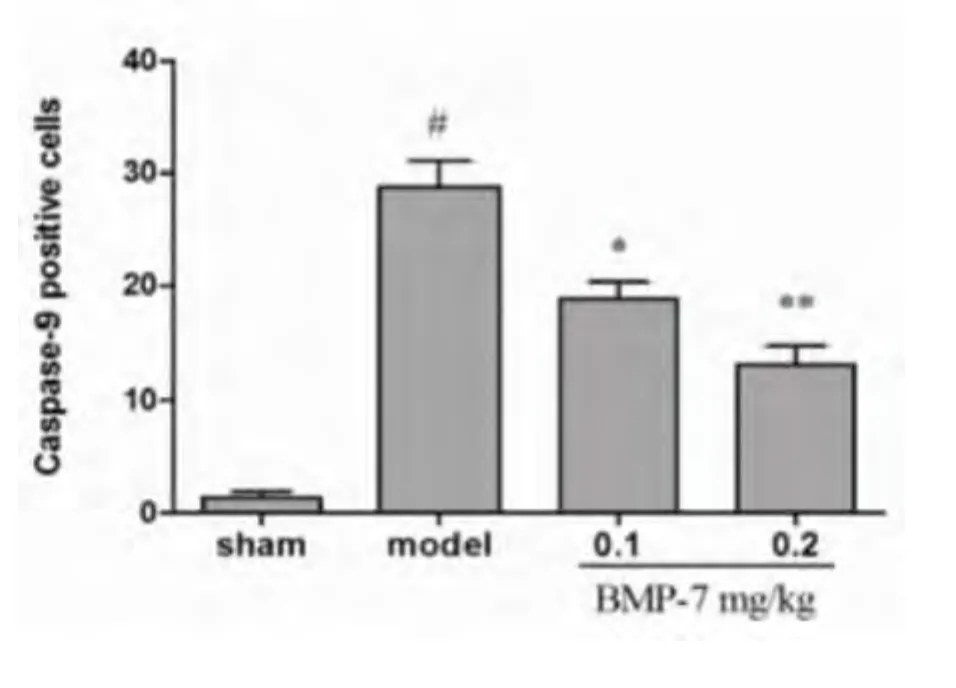
图3 各组大鼠缺血侧皮质Caspase-9阳性细胞计数
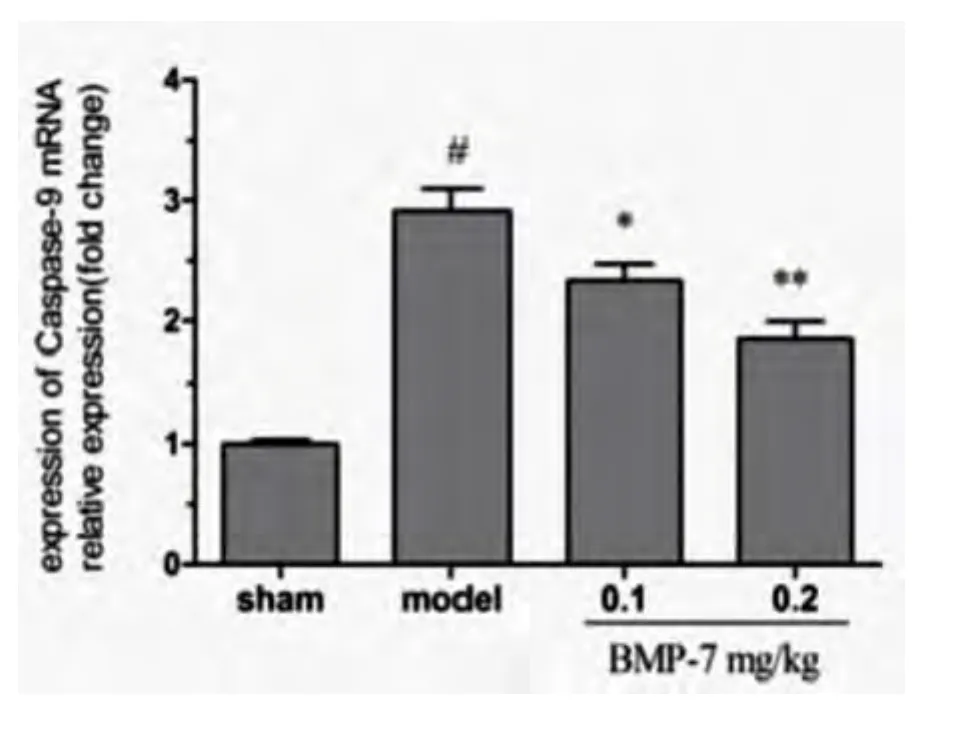
图4 BMP-7对大鼠缺血侧皮质Caspase-9 mRNA表达的影响
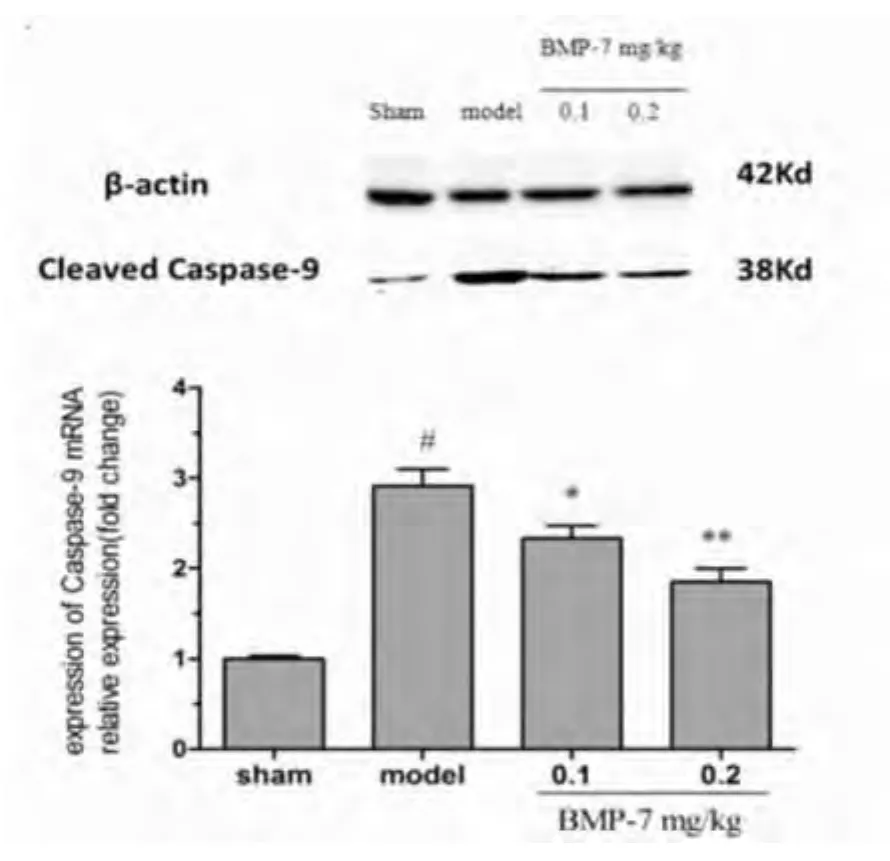
图5 BMP-7对大鼠缺血侧皮质Caspase-9蛋白表达的影响
3 讨论
Liu等[7]研究发现,大鼠脑缺血再灌注损伤后,BMP-7可增加缺血后脑组织葡萄糖的利用率和血流量。Chou等[8]观察到,BMP-7可促进梗死对侧脑室下区神经祖细胞的增殖,并促使其转移到梗死侧大脑皮质周围。本实验研究表明,脑缺血再灌注损伤后经尾静脉注射BMP-7可促进大鼠神经功能的恢复,病理组织学显示BMP-7可明显减轻大鼠脑缺血再灌后的脑损伤,维持在脑缺血状态下神经细胞的正常形态和功能,延缓其凋亡和坏死,尤其以BMP-7高剂量组的效果最为明显,说明BMP-7对脑缺血再灌注损伤有明显的神经保护作用。脑缺血再灌注后触发的一系列复杂的级联反应,包括氨基酸毒性、自由基生成、蛋白酶激活、炎症反应等,其最终阶段均涉及到Caspase介导的细胞凋亡[9~11]。脑缺血后神经细胞凋亡主要包括Caspase参与的线粒体凋亡途径和死亡受体凋亡途径,其中Caspase-9是线粒体凋亡途径的启动酶,当凋亡信号传至线粒体时,线粒体释放细胞色素C(CytC),CytC与Procaspase-9及凋亡活化因子-1(Apaf-1)结合形成凋亡体,进而使Procaspase-9发生裂解成为活性 Caspase-9,活性Caspase-9又能进一步促进下游的Caspase的激活,引发DNA的断裂和多种蛋白成分的破坏,最终导致细胞凋亡[12]。朱炬等[13]发现大鼠局灶性脑缺血再灌注损伤后Caspase-9 mRNA的表达增强。Mouw等[14]研究表明,大鼠脑缺血再灌注损伤后,脑组织活性 Caspase-9的表达明显增加,而特异性的Caspase-9抑制剂可下调活性Caspase-9的表达,抑制神经细胞凋亡,减小大鼠脑梗死体积。因此,通过拮抗Caspase-9的表达抑制细胞凋亡可对脑缺血再灌注损伤起保护作用。
本实验显示,大鼠缺血2 h再灌注24 h后,大鼠皮质区Caspase-9蛋白及Caspase-9 mRNA表达增强。BMP-7明显抑制了缺血再灌注诱导的皮质区Caspase-9蛋白及Caspase-9 mRNA的表达,并且以高剂量的BMP-7效果更加明显,提示BMP-7能够降低Caspase-9的表达与活化从而减少脑缺血损伤后神经元的凋亡。本课题组前期实验表明,BMP-7可下调脑组织中Caspase-3的表达,从而抑制脑缺血损伤导致的细胞凋亡[15]。因此,我们认为 BMP-7通过下调Caspase-9和Caspase-3表达,抑制线粒体凋亡途径,来减少神经元凋亡,进而对脑缺血再灌注损伤起保护作用。但有关 BMP-7对 Caspase-9和Caspase-3上游的信号通路的影响尚缺乏相关的研究,因此我们将进一步研究Caspase-9和Caspase-3上游的信号通路,阐明BMP-7抑制神经细胞凋亡的完整信号分子传导途径。
[1]White AP,Vaccaro AR,Hall JA,et al.Clinical applications of BMP-7/OP-1 in fractures,nonunions and spinal fusion [J].Int Orthop,2007,31(6):735-741.
[2]Chang CF,Lin SZ,Chiang YH,et al.Intravenous administration of bone morphogenetic protein-7 after ischemia improves motor function in stroke rats[J].Stroke,2003,34(2):558-564.
[3]Yabe T,Samuels I,Schwartz JP.Bone morphogenetic proteins BMP-6 and BMP-7 have differential effects on survival and neurite outgrowth of cerebellar granule cell neurons[J].J Neurosci Res,2002,68(2):161-168.
[4]汝丽娟,裴海涛,郭云良.BMP-7对大鼠脑缺血/再灌注损伤后nestin和GFAP表达的影响[J].中国药理学通报,2011,27(12):1718-1723.
[5]韩江全,林东融,张兴毅,等.高血糖对大鼠局灶性脑缺血再灌注后神经细胞凋亡及caspase-9、caspase-3表达的影响[J].中国神经免疫学和神经病学杂志,2012,19(5):371-374.
[6]Longs EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[7]Liu YT,Belayev L,Zhao WZ,et al.The effect of bone morphogenetic protein-7(BMP-7)on functional recovery,local cerebral glucose utilization and blood flow after transient focal cerebral ischemia in rats[J].Brain Res,2001,905(1-2):81-90.
[8]Chou J,Harvey BK,Chang CF,et al.Neuroregenerative effects of BMP7 after stroke in rats[J].Neurol Sci,2006,240(1-2):21-29.
[9]Manzanero S,Santro T,Arumuqam TV.Neuronal oxidative stress in acute iachemic stroke:sources and contribution to cell injury[J].Neurochem Int,2013,62(5):712-718.
[10]Bonova P,Burda J,Danielisova V,et al.Delayed post-conditioning reduces post-ischemic glutamatelevel and improvesprotein synthesis in brain[J].Neurochem Int,2013,62(9):854-860.
[11]Broughton BR,Reutens DC,Sobey CG.Apoptotic mechanisms after cerebral ischemia[J].Stroke,2009,40(5):331-339.
[12]Niizuma K,Yoshioka H,Chen H,et al.Mitochondrial and apoptotic neuronal death signaling pathways in cerebral ischemia[J].Bio Biophys Acta,2010,1802(1):92-99.
[13]朱 炬,王纪佐.大鼠局灶性脑缺血后再灌注期caspase-9 mRNA及Apaf-1 mRNA表达的动态变化[J].中国神经科杂志,2003,11(1):23-26.
[14]Mouw G,Zechel JL,Zhou Y,et al.Caspase-9 inhibition after focal cerebral ischemia improves outcome following reversible focal ischemia[J].Metab Brain Dis,2002,17(3):143-151.
[15]李红云,汝丽娟,裴海涛.骨形态发生蛋白-7对大鼠脑缺血再灌注后Caspase-3表达的影响[J].解剖学报,2012,43(3):335-339.
