新型FKBPs配体HD5-6对SAMP8小鼠的抗老化研究
2014-11-17张延明肖军海王大江方伯言
张延明, 肖军海, 赵 云, 韩 丹, 王大江, 杨 静, 方伯言
阿尔茨海默病(Alzheimer’s disease,AD)是一种渐进性、致死性神经退行性疾病,其发病机制尚不完全清楚,因此对AD发病机制的探索和对其防治药物的研究开发成为医学研究热点之一。近些年临床主要应用神经营养因子类药物治疗神经退行性疾病,但多因为透过血脑屏障的能力较差,临床使用限制较多,因此人们逐渐把研究方向转向小分子类化合物。20世纪90年代初,人们在研究小分子免疫抑制剂FK506的实验中意外发现其可以加快神经的再生速率,并陆续在动物体内和体外细胞实验中证实其具有促神经再生的作用[1],同时人们发现与FK506结合的 FK506 结合蛋白[2](FK506 binding proteins,FKBPs)在脑组织中的浓度远大于其在免疫组织中的浓度,并在神经受损和疾病状态下表达上调[3,4]。因此以 FK506和 FKBPs为基础研究治疗神经退行性疾病的小分子神经保护类药物成为一个热门方向。
噻嗪酰胺衍生物(HD5-6)是由军事医学科学院毒物药物研究所根据FKBPs以及其特异性配体FK506复合晶体结构研发的一种新结构小分子FKBPs配体。药物研发的动物实验证明其具有明显的抗脑缺血的作用,在帕金森动物实验中也具有较好的神经保护作用。本实验通过检测HD5-6干预后快速老化小鼠P系(senescence accelerated-prone mouse,SAMP)中的SAMP8亚系的行为学和病理学改变以及对其海马神经元基因表达谱的影响,探讨HD5-6对SAMP8小鼠的抗老化作用,为药物的进一步研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 10月龄 SAMP8雄性小鼠20只,体重26~30 g,10月龄SAMR1雄性小鼠10只,体重30~35 g,由天津中医药大学第一附属医院老年动物中心提供(动物合格证号:SCXK(津)-2008-0001)。饲养于军事医学科学院SPF级动物房。
1.1.2 药品和试剂 HD5-6由中国人民解放军军事医学科学院毒物药物研究所提供,专利公开号CN 102675244A;TUNEL试剂盒购自美国progema公司,货号G3250;mirVanaTM RNA Isolation Kit购自美国 Biosystem公司,p/n AM1556;RNeasy®Mini Kit购自德国QIAGEN公司,Design ID:028005。
1.1.3 主要仪器 Morris水迷宫系统,北京鼎大软件技术有限公司;奥林巴斯BX61倒置荧光显微镜,日本。基因芯片检测使用Agilent SurePrint G3 Mouse Gene Expression Microarray(8*60K),委托上海欧易生物医学医学科技有限公司进行。
1.2 方法
1.2.1 动物分组及给药 小鼠适应性饲养1 w后,将SAMP8随机分为痴呆组(n=10)、HD5-6组(n=10);SAMR1(n=10)作为正常对照组。HD5-6组按10mg/kg体重腹腔注射HD5-6(用8%DMSO助溶配成溶液)溶液,痴呆组及正常对照组腹腔注射相应体积8%DMSO生理盐水溶液,所有小鼠每天上午给药1次,给药总时间为35 d。
1.2.2 Morris水迷宫实验 给药4 w后,于29 d开始将3组小鼠进行5 d定位航行实验。定位航行实验结束24 h后,拆除平台,选择NW象限作为入水象限,记录小鼠在60 s内穿过原平台位置的次数,对小鼠在原平台象限的游泳时间进行统计分析。
1.2.3 HE染色与TUNEL荧光染色 给药结束后,每组随机挑选7只小鼠用4%水合氯醛麻醉,快速开胸,经左心室插管,80 ml冰冷生理盐水冲洗及100 ml 4%多聚甲醛PBS液灌注固定,取出完整大脑组织,透明、浸蜡、石蜡包埋,每只鼠连续5μm切片。每只鼠选取相同海马层次切片常规脱蜡后,进行HE染色,并在高倍镜下观察其海马结构。每只鼠选取相同海马层次切片常规脱蜡后,按照TUNEL试剂盒说明书进行染色。在荧光显微镜下,每张阳性切片选取20个高倍荧光视野,计数凋亡细胞并计算凋亡百分率,即凋亡指数(apoptotic index,AI),计算公式如下:AI=(阳性细胞数/总细胞数)×100%。
1.2.4 基因芯片检测与分析 每组随机选取3只小鼠,断头处死后,迅速在冰盒表面分离左侧海马,提取纯化总 RNA,使用 Agilent SurePrint G3 Mouse Gene Expression Microarray(8*60K)芯片进行检测。经反转录并标记的cRNA和芯片杂交,洗脱后利用Agilent Scanner G2505C扫描,分辨率为5 μmol/L。对于表达上调或者下调倍数变化值>2.0且P值<0.05的mRNA进行归类分析。
1.3 统计学方法
实验数据均以χ±s表示,并用 SPSS20.0软件对各组数据进行正态检验及方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差不齐采用Dunnett检验。检验水准定为P<0.05为差异有统计学意义。
2 结果
2.1 Morris水迷宫实验
2.1.1 定位航行实验 实验中测得3组小鼠5 d的平均潜伏期见表1、表2、图1。
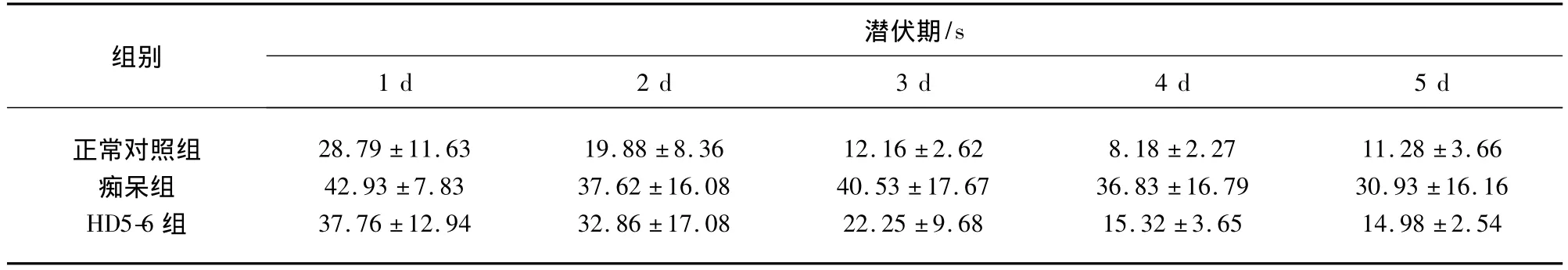
表1 3组小鼠5 d的平均潜伏期(χ ± s,n=10)
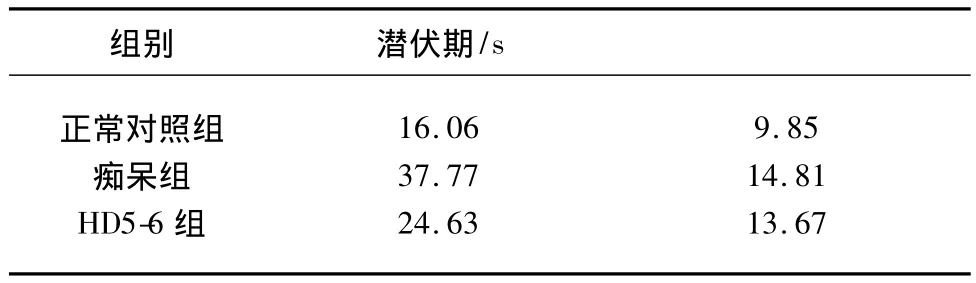
表2 3组小鼠5 d潜伏期均值总体比较(χ±s)
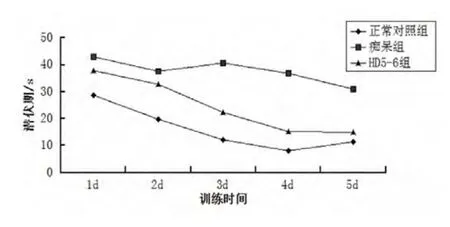
图1 各组平均逃避潜伏期5 d前后的变化
表1和图1提示,在5 d的训练实验中,随着小鼠训练次数的增加,3组小鼠的潜伏期均表现为逐渐缩短的趋势。痴呆组5 d的潜伏期始终明显长于正常对照组(P <0.05)。HD5-6组3、4、5 d的潜伏期较痴呆组明显缩短,差异有统计学意义(P<0.05);HD5-6组3、4 d的潜伏期较正常对照组差异明显(P<0.05),但5 d的潜伏期较正常对照组无统计学差异(P >0.05)。
表2提示,在定位航行实验中,从3组小鼠5 d训练的总体情况比较,痴呆组较正常对照组潜伏期明显延长(P<0.01),HD5-6组潜伏期较痴呆组明显缩短(P<0.01),但与正常对照组比较,潜伏期仍较长,具有显著的统计学差异(P<0.01)。
2.1.2 空间探索实验 实验6 d,拆除平台,观察小鼠的空间探索能力(见表3),与正常对照组比较,痴呆组跨平台次数与原平台象限时间比都有统计学差异(P<0.05);HD5-6组与痴呆组相比,跨平台次数与原平台象限时间比均有统计学差异(P<0.05),但与正常对照组相比,无统计学差异(P>0.05)。
2.2 免疫组织化学
2.2.1 HE染色 由图2可发现,正常对照组小鼠海马区的神经元数量较多,排列整齐,界限清楚,细胞体积较大,较丰满,细胞核较清晰;痴呆组海马区神经元数量明显减少,细胞排列紊乱,界限不清,大量的神经元细胞核固缩,深染、坏死,与正常对照组比较有显著差异;与痴呆组小鼠相比,HD5-6组海马区神经元数量相对较多,排列也相对规则,细胞间界限相对比较清晰,神经元细胞核坏死和固缩现象也相对减少,差异十分显著,但与正常对照组相比,差异并不显著。
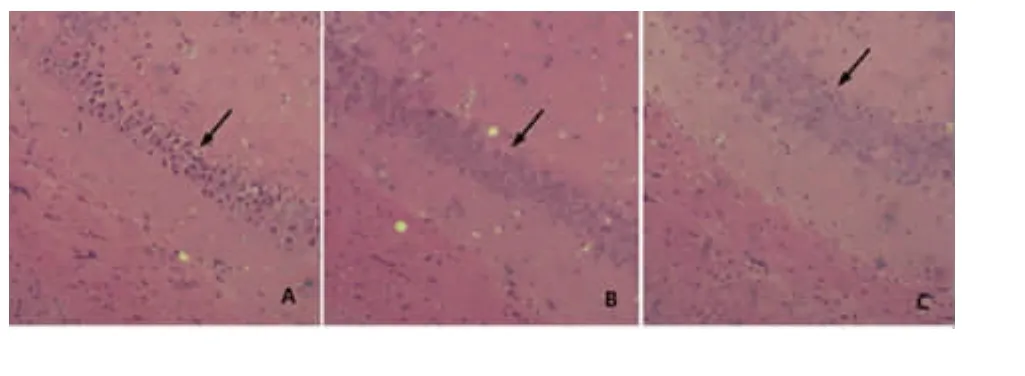
图2 小鼠海马区神经元HE染色(×100,箭头标注区为神经元)
2.2.2 TUNEL荧光染色 正常对照组小鼠海马区神经元 AI为(28.02 ±11.25)%;痴呆组小鼠海马区神经元AI为(51.73±4.48)%,与正常对照组相比,差异具有统计学意义(P<0.05);HD5-6组小鼠海马区神经元AI为(20.47±2.25)%,与痴呆组相比,具有显著的统计学差异(P<0.01),但与正常对照组相比,无统计学差异(见图3、表4)。

图3 小鼠海马区TUNEL荧光染色(×100,箭头标注为凋亡神经元)
2.3 HD5-6对SAMP8海马神经元基因表达谱的影响
与痴呆组基因表达谱相比,HD5-6干预的SAMP8小鼠海马神经元的表达差异在2倍以上的基因有118条,表达上调的为9条,表达下调的为109条。其中有功能的mRNA中,表达上调的有4条,表达下调的有 21条,见表 5及表 6。其中 Nxph2、Herc6、S100a8、Pde7b、Tnni1、Wnt8b 等涉及了神经营养、信号传导以及细胞凋亡途径的mRNA均发生了差异表达,但差异基因表达的可靠性尚需进一步的验证。

表3 3组小鼠空间探索实验原平台象限时间比与跨平台次数比较(χ±s)

表4 3组小鼠海马神经元凋亡指数(χ±s)
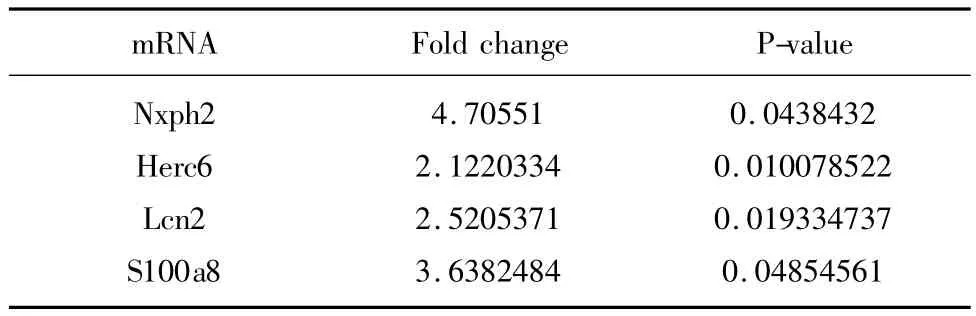
表5 HD5-6组中上调的差异表达基因
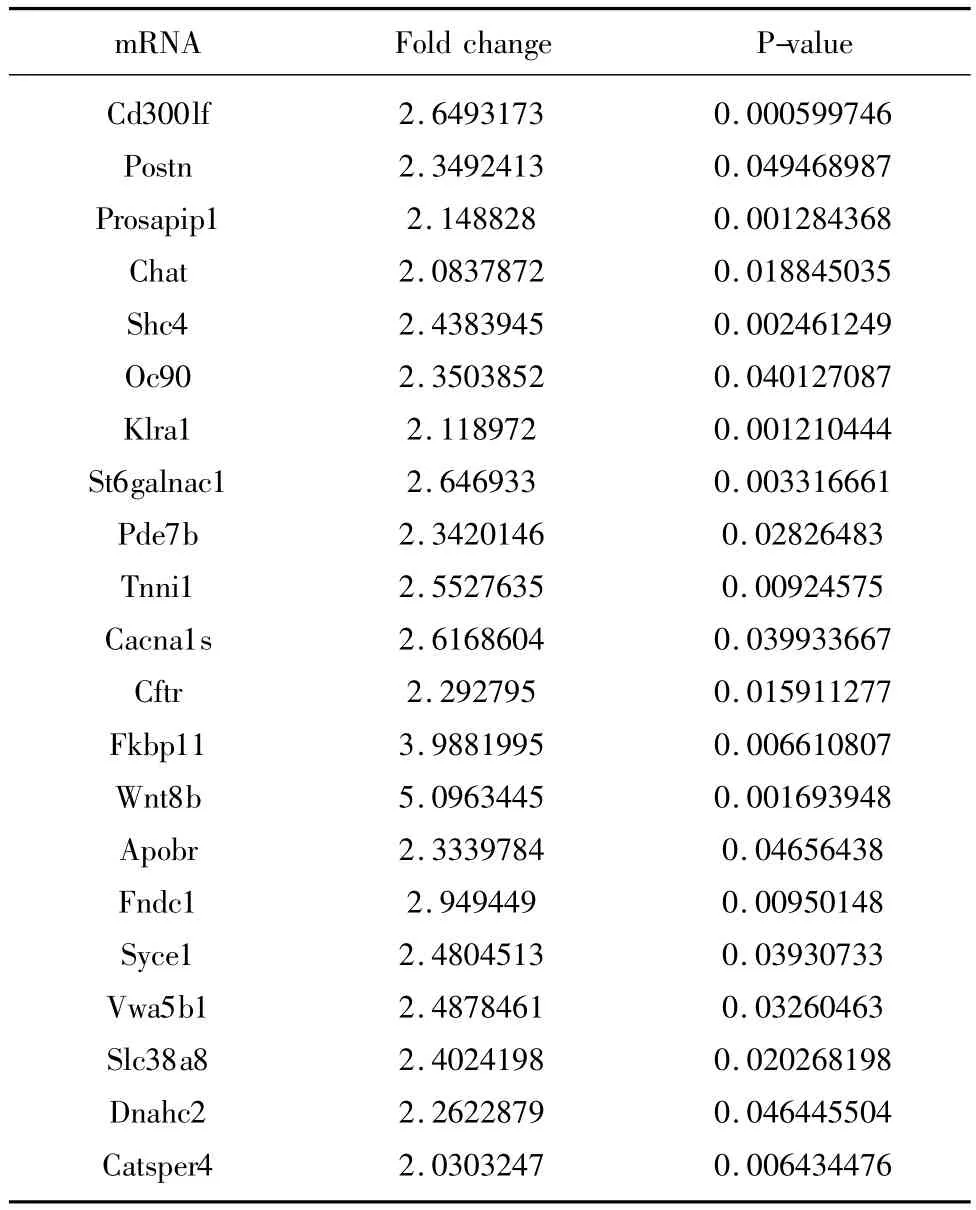
表6 HD5-6组中下调的差异表达基因
3 讨论
目前AD的发病机制尚不十分清楚,其防治药物的治疗效果由于血脑屏障的存在而受到诸多的限制,由于发现小分子FKBPs配体FK506有神经保护和促神经生长作用,使FKBPs成为神经退行性疾病药物研究的重要靶标。本课题使用的HD5-6就是根据FKBPs以及其特异性配体FK506复合晶体结构研发的一种新结构小分子FKBPs配体。但到目前为止,FKBPs配体神经保护和促神经生长作用的机制尚不十分清楚。
快速老化小鼠(senescence accelerated mouse,SAM)是日本京都大学竹田俊男教授在美国AKR/J系小白鼠基础上长期培育得到的一种近交系衰老模型鼠,包括 SAMP(senescence accelerated-prone mouse)和SAMR(senescence accelerated-resistant mouse)两种品系[5]。其中SAMP8在渡过4~6月龄后生长期后迅速出现学习记忆缺陷以及平均寿命较短和淀粉样变性增加的快速衰老特征,其典型的痴呆症状和脑部病理变化,是目前研究AD较好的自然衰老动物模型。因此本课题选用SAMP8来研究HD5-6抗老化作用。
Morris水迷宫实验是由英国心理学家Morris研究并设计,主要用于研究动物空间探索和辨别的学习记忆能力,以动物找到暗台的潜伏期作为评定学习记忆能力的指标[6]。本实验结果显示,10月龄SAMP8雄鼠的学习记忆能力明显低于同月龄SAMR1雄鼠,表现为:5 d的逃避潜伏期显著延长,跨平台次数、原平台象限时间减少,分析判断能力明显低于正常对照组。给予HD5-6治疗后的SAMP8逃避潜伏期明显缩短,而探索实验的结果显示SAMR1和HD5-6治疗后SAMP8的记忆保持能力比痴呆组强,提示 HD5-6可以改善快速老化小鼠SAMP8的学习记忆能力,但FKBPs配体改善小鼠学习记忆能力具体机制尚不十分清楚。FK506是一种大环内酯类强效免疫抑制剂[7],它进入细胞后与FKBP结合,可以阻断钙调神经磷酸酶(Calcineurin,CaN)的活性[8]。CaN具有激活突触前膜长时程减弱(LTD)和抑制突触后膜长时程增强(LTP)的作用[9],可以有效的抑制海马神经元突触后活动,因此与海马依赖的记忆形成密切相关的海马神经元突触活动在CaN高表达时会被过度抑制,进而消弱了海马依赖的记忆形成。因此人们推断应用FKBPs配体时可能通过抑制CaN的过度表达改善海马依赖的记忆功能。
研究证实,FKBPs配体是目前已知的唯一的具有神经保护和促神经生长作用的有机小分子物质,具有促进PC12细胞和背根神经突起的生长,并且可以促进体内周围神经损伤后的功能修复和神经再生[10,11]。本实验HE染色显示与正常对照组相比,痴呆组海马神经元数量明显减少,细胞排列紊乱,并且可以发现大量的神经元细胞核固缩、深染、坏死;给予HD5-6干预的SAMP8小鼠海马区神经元数量显著增多,细胞核固缩坏死现象明显减少,提示HD5-6能够延缓甚至改善SAMP8小鼠海马神经元的病理改变。TUNEL结果显示,SAMR1与给予HD5-6治疗的SAMP8海马神经元凋亡指数明显低于痴呆组,提示HD5-6能够延缓SAMR8海马神经元凋亡速度。在经典的N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)介导的神经细胞死亡通路中,谷氨酸与NMDA受体结合后,引起Ca2+大量流入神经细胞内,并与肌钙蛋白结合,激活有活性的一氧化氮合成酶(nitricoxide synthase,NOS),促进NO的产生,损伤神经元,而非活性的NOS需要在CaN作用下脱磷酸化从而具备活性,因此人们推断FKBPs配体可能通过抑制NOS活性,减少NO损伤神经元[12]。本实验芯片结果显示,编码肌钙蛋白的Tnni1表达下调,从而降低了谷氨酸进入NMDA通路的能力,减少了NO的产生,这也提示了HD5-6可能通过上述机制起到保护神经元的作用。
FKBPs配体发挥神经保护作用的机制并不是唯一的。CaN是一种Ca2+钙调蛋白依赖的蛋白磷酸激酶,对T细胞的活化Ca2+介导的信号传导过程起限制酶作用,在促坐骨神经再生的实验中,FK506可以减少淋巴细胞在神经损伤早期的局部浸润,研究者推断其可能通过抑制CaN活性,从而抑制T细胞活化中IL-2基因的转录,阻断Ca2+依赖性T细胞的活化途径,抑制T淋巴细胞在损伤部位聚集、活化,减轻T淋巴细胞对损伤变性轴突的破坏[13,14],达到对损伤神经的保护作用。基因芯片结果显示,与痴呆组相比,HD5-6组海马神经元的表达差异在2倍以上的基因有118条,其中有功能的mRNA中,表达上调的有4条,表达下调的有21条。其中 Lcn2、S100a8、Oc90、Cabp5、Cacna1s等与 Ca2+转运有关的蛋白分别发生了不同程度的上调或者下调,提示HD5-6可能通过影响与钙离子有关的蛋白起到对CaN抑制作用,从而达到神经保护作用。另外研究发现,生长相关蛋白-43(GAP-43)作为神经元生长锥中的主要磷酸蛋白,同时也是Calcineurin的底物,FK506可以通过抑制Calcineurin活性,增加GAP-43活性[15,16],促进神经生长。同时本实验结果显示参与神经肽信号转导途径的Nxph2的表达上调也提示了FKBPs配体HD5-6可能存在其它的发挥神经保护作用的途径。综上所述,FKBPs配体HD5-6能够改善快速老化小鼠SAMP8的学习记忆能力和海马神经元病理改变,并且通过对基因表达谱产生的影响发挥明显的抗衰老作用,为下一步的药物研究提供了重要的理论依据。但HD5-6延缓SAMP8小鼠的衰老具体机制还需进一步的研究证实。
[1]Tanaka K,Ogawa N.Possibility of non-immunosuppressive immunophilin ligands as potential therapeutic agents for Parkinson’s disease[J].Current pharmaceutical design,2004,10(6):669-677.
[2]Qiu Y,Zhao W,Wang Y,et al.FK506 Binding Protein 12 Modulates μOpioid Receptor Phosphorylation and PKC-dependent Signaling by its Direct Interaction with the Receptor[J].Molecular Pharmacology,2013,113:87825.
[3]Tanaka CS,Harikishore A,Yoon H.Role of FK506 binding proteins in neurodegenerative disorders[J].Current medicinal chemistry,2011,18(35):5380-5397.
[4]Gold BG,Voda J,Yu X,et al.FK506 and a nonimmunosuppressant derivative reduce axonal and myelin damage in experimental autoimmune encephalomyelitis:Neuroimmunophilin ligand‐mediated neuroprotection in a model of multiple sclerosis[J].Journal of neuroscience research,2004,77(3):367-377.
[5]Takeda T.Senescence-accelerated mouse(SAM)with special references to neurodegeneration models,SAMP8 and SAMP10 mice[J].Neurochemical research,2009,34(4):639-659.
[6]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nature protocols,2006,1(2):848-858.
[7]Zhao L,Huang W,Liu H,et al.FK506-binding protein ligands:structure-based design,synthesis,and neurotrophic/neuroprotective properties of substituted 5,5-dimethyl-2-(4-thiazolidine)carboxylates[J].Journal of medicinal chemistry,2006,49(14):4059-4071.
[8]Chen X,Zhang Y.Molecular Cloning and Characterization of the Calcineurin Subunit A from Plutella xylostella[J].International journal of molecular sciences,2013,14(10):20692-20703.
[9]Abel T,Martin KC,Bartsch D,et al.Memory suppressor genes:inhibitory constraints on the storage of long-term memory[J].Science,1998,279(5349):338-341.
[10]Zhao L,Liu H,Wang L,et al.Modeling and synthesis of non-cyclic derivatives of GPI-1046 as potential FKBP ligands with neurotrophic properties[J].Bioorganic & Medicinal Chemistry Letters,2006,16(16):4385-4390.
[11]Olivieri L,Gardebien F.Molecular Dynamics Simulations of a Binding Intermediate between FKBP12 and a High-Affinity Ligand[J].Journal of Chemical Theory and Computation,2011,7(3):725-741.
[12]刘洪英,苏翠玲,聂爱华,等.新型非免疫活性的 FKBP12配基N308促神经生长和神经损伤保护作用的体外评价[J].中国药理学通报,2011,27(11):1500-1504.
[13]吕德成,袁先厚,张卫国,等.利用神经再生室观察 FK506促进神经再生的实验研究[J].中华医学杂志,2005,85(28):1978-1981.
[14]Chen B,Song Y,Liu Z.Promotion of nerve regeneration in peripheral nerve by short-course FK506 after end-to-side neurorrhaphy[J].Journal of Surgical Research,2009,152(2):303-310.
[15]Madsen JR,MacDonald P,Irwin N,et al.Tacrolimus(FK506)increases neuronal expression of GAP-43 and improves functional recovery after spinal cord injury in rats[J].Experimental Neurology,1998,154(2):673-683.
[16]赵丽琴,肖军海,黄 蔚,等.FKBPs与神经退行性疾病[J].药学学报,2002,37(9):743-748.
