微小RNA-7对人视网膜色素上皮细胞增生和迁移的影响△
2014-11-13李林徐剑容王咏针孙玉莹李斌
李林 徐剑容 王咏针 孙玉莹 李斌
人视网膜色素上皮(human retinal pigment epithelium,hRPE)细胞是人类视网膜内的重要细胞,在维持光感受器细胞正常的代谢和功能中起关键作用。但在一些病理条件下,hRPE细胞异常增生是导致人类眼部疾病的主要原因,如增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)、增生型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)、脉络膜新生血管、息肉样脉络膜血管病变、年龄相关性黄斑变性等。国内外许多研究已经证实多种生长因子,如血小板生长因子、碱性成纤维细胞生长因子、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、肝素结合生长因子、转化生长因子、肿瘤坏死因子、胰岛素样生长因子(insulin growth factor,IGF)等,均在 PDR、PVR 等眼部增生性疾病的形成中起重要作用[1],这些作用主要是通过刺激hRPE细胞增生、黏附和迁移来实现的。在这些反应过程中,细胞外信号调节激酶(extracellular signal-regulated kinases,ERK)1/2信号通路处于高度激活状态,阻断ERK1/2信号通路可以抑制hRPE细胞的增生和迁移。表皮生长因子(epidermal growth factor,EGF)与hRPE细胞上的 EGF受体(EGFR)结合就可以激活ERK1/2信号通路,引起细胞增生和迁移,参与眼病的发生。以往的针对其他种类的体细胞研究发现,微小 RNA-7(miRNA-7)对 ERK1/2的激活有抑制作用。所以,我们不禁联想miRNA-7对hRPE可能有相似作用从而抑制PVR的形成。本文在以往工作的基础上,拟通过研究 miRNA-7对体外培养的hRPE细胞 EGFR表达、ERK1/2信号通路、增生、迁移和凋亡的影响,深入研究 miRNA-7在PVR等疾病形成中所起到的作用,并尽可能考察其在临床治疗中的应用前景。
1 材料与方法
1.1 hRPE细胞的培养及鉴定 hRPE细胞取自健康成年角膜移植的供体眼,于死亡12 h内进行分离培养。在无菌状态下,弃除眼前段及玻璃体,自视盘处分离并去除视网膜神经层,形成眼杯。D-hank液冲洗眼杯2次。12.5 g·L-1胰蛋白酶(美国 Sigma公司)37℃下消化45 min。吸除消化液,加入含体积分数20%小牛血清(美国 Gibco公司)、青霉素(100 U·L-1)及链霉素(100 U·L-1)的改良 Eagle培养液(DMEM,美国Gibco公司)。经反复轻轻吹打及冲洗后,将冲洗液移入离心管中,1 000 r·min-1离心10 min,共2次。hRPE细胞以50×103个·mL-1的密度接种于含体积分数 20%小牛血清DMEM培养液的培养瓶中,在含体积分数5%CO2、湿度为90%的37℃细胞培养箱中培养。3~4 d更换1次培养液,直至细胞融合传代。
选第3~6代细胞用于实验,细胞爬片,采用链霉亲合素生物素化过氧化物酶复合物(SABC)法(武汉博士德公司试剂盒)进行细胞鉴定,一抗为鼠抗人细胞角蛋白单克隆抗体(pan-ck,Santa Cruz公司)。
1.2 miRNA-7合成及转染
1.2.1 合成 根据miRNA-7序列,由广州锐博生物科技有限公司合成miRNA-7和阴性microRNA前体(产品号分别为PM10047、AM17110)。
1.2.2 转染
1.2.2.1 转染效率 采用购自广州锐博的绿色荧光蛋白(GFP)荧光标记的miRNA-7前体,用无菌去离子水将 miRNA-7前体稀释为20 mmol·L-1。采用Lipofectamine 2000转染试剂(Invitrogen)。将常规条件下培养的hRPE细胞离心,去上清,用不含血清和双抗的DMEM培养液重悬,调整细胞密度为3 ×106个·mL-1,接种于 6 孔板,每孔 1.5 mL。转染过程如下:全程避光,将稀释过的miRNA-7前体溶液 2.5 μL、5 μL、10 μL 分别与 250 μL OPTIM-MEM 1混匀为 A液,将 5 μL脂质体与 250 μL OPTIMMEM 1混匀为B液,室温下静置5 min;将A液与B液混合,室温下静置20 min;将混合液轻轻加入孔中,混匀;常规条件培养24 h,PBS洗涤2次,荧光显微镜下观察,摄影。
1.2.2.2 转染及实验分组 将常规条件下培养的hRPE去上清,用不含血清和双抗的DMEM培养液重悬,调整细胞密度为3×106个·mL-1,接种于细胞培养板(蛋白和RNA检测采用6孔板,细胞增殖实验采用96孔板,其他实验采用24孔板),根据前期转染优化结果,每孔加入miRNA-7前体和转染试剂,使 miRNA-7前体的终浓度为 50 nmol·mL-1,脂质体的终浓度为 2.5 μg·mL-1。转染 48 h 后,进行下一步检测。实验分为4组:miRNA-145干预组即miRNA-7前体干预组、阴性 miRNA对照组、空脂质体组、空白对照组。
1.2.2.3 Real-Time PCR 检测成熟 miRNA-7 的表达 收集各组细胞,用Trizol RNA抽提试剂(美国Invitrogen公司)提取细胞总RNA,-20℃保存备用。逆转录反应按试剂盒(美国Fermentas公司)说明进行,miRNA 反转录引物(cat.4366596),miRNA-7PCR引物 (cat.4373145),内 参 U6 PCR 引 物 (cat.4373381)均由广州锐博生物科技有限公司合成。使用美国ABI公司 SYBR Green PCR Master Mix试剂盒,按照试剂说明书配制20 μL反应体系:cDNA 1 μL,2 × POWER SYBRGreen PCR Master Mix 10 μL,上下游引物各4 μL,无核酸水1 μL。加入八连管后,上ABI 7500型荧光定量PCR仪,进行PCR扩增和检测,反应条件如下:50℃ 2 min;95℃ 10 min;95℃ 30 s、60 ℃ 1 min、72 ℃ 15 s,40 个循环;在 60 ℃收集荧光信号;循环结束后65~95℃绘制溶解曲线。每个样本检测均重复3次,相对定量采用比较Ct法:U6 作为内参照,ΔCt=CtmiRNA-7-CtU6,ΔΔCt=ΔCt实验组-ΔCt对照组,根据公式可以计算出各实验组中miRNA-7基因表达情况,即实验组miRNA-7基因表达倍数(Fold)=2-ΔΔCt。
1.3 细胞增殖和迁移
1.3.1 CCK-8检测细胞增殖抑制 转染后48 h,每孔加入CCK-8溶液10 μL(中国碧云天生物科技研究所),常规条件下孵育 60 min,酶标仪(美国 Bio-Tek公司)检测450 nm波长处每孔的吸光度值(A值),按照公式计算细胞增殖抑制率(cells inhibitor,CI),即 CI=1-(处理组平均 A值/空白组平均 A值)×100%。
1.3.2 细胞迁移实验 用直径为8.5 mm的Boyden小室进行细胞迁移能力的检测。实验分组同1.2.2.2,常规培养24 h后,分别取4组细胞,用 DMEM/F12培养基洗涤后将密度调整为106个·mL-1,在趋化小室的下层加入含体积分数10%FBS的DMEM/F12培养基,然后盖上8 μm的微孔多聚碳酸酯滤膜。在趋化小室的上层分别加入已经制备好的800 μL细胞悬液,于常规条件下继续培养5 h。此后拆卸装置,用棉签擦去多聚碳酸酯滤膜上层的细胞,然后用甲醛固定,苏木精染色,在400倍光学显微镜下每张膜随机观察5个视野并计数,实验重复3次。每组迁移细胞数为15个视野的平均细胞数。
1.4 统计学方法 应用 SPSS 13.0统计软件,计量资料以表示,两组间miRNA-7转染率采用 t检验,计数资料之间比较采用 χ2检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 细胞培养和鉴定 消化下来的hRPE细胞呈圆形,大小相似,富含黑色素颗粒,细胞结构不清。接种入培养瓶中2-4 d后,细胞贴壁变扁平,呈多边形;细胞伸出伪足,呈集落样生长。14-28 d细胞铺满培养瓶瓶底,致密排列,呈六边形或多边形。随着传代的进行,细胞内的黑色素颗粒逐渐减少,到第4代后,细胞内的色素颗粒基本消失,细胞呈梭形或不规则形,向成纤维细胞形态转变。抗角蛋白染色后,细胞胞浆呈棕黄色,可见典型的角蛋白中间丝网架。
2.2 miRNA-7合成及转染
2.2.1 化学合成miRNA-7前体可以成功转染hRPE细胞 采用Lipofectamine 2000转染试剂,以GFP为荧光标记物,转染后24 h观察,转染成功细胞的胞膜和胞浆中可见绿色荧光。当miRNA-7前体的终浓度为 50 nmol·mL-1、脂质体的终浓度为 2.5 μg·mL-1时,转染效率最高,达到80%以上(图1)。
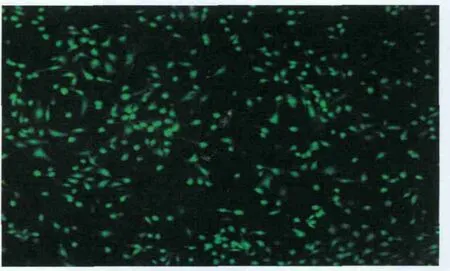
Figure 1 Chemical synthesis precursor microRNA-7 can be transfected into hRPE cells successfully,staining with green fluorescent(200) 化学合成的miRNA-7前体可以成功转染hRPE细胞,显示绿色荧光(×200)
2.2.2 miRNA-7前体转染hRPE细胞后成熟 miRNA-7的表达情况 miRNA-7前体干预组每高倍视野下成熟 miRNA-7数为(56.06±3.45)个,与空白对照组的(1.00±0.03)个、空脂质体组的(0.96±0.02)个和阴性 miRNA 对照组的(1.02±0.04)个相比,差异均具有统计学意义(均为P<0.05);空脂质体组、阴性对照组与空白对照组之间差异均无统计学意义(均为 P >0.05)。
2.3 miRNA-7对hRPE细胞增殖的影响 与空白对照组、空脂质体组及阴性 miRNA对照组比较,miRNA-7对hRPE细胞增殖有明显抑制作用。miRNA-7前体干预组细胞增殖抑制率(23.58%)明显高于阴性 miRNA对照组(2.35%)、空脂质体组(2.97%)与空白对照组(0%),差异均具有统计学意义(均为P<0.05),空脂质体组、阴性 miRNA对照组与空白对照组之间差异均无统计学意义(均为P >0.05)。
2.4 miRNA-7对hRPE细胞迁移的影响 miRNA-7可抑制 hRPE细胞的迁移。细胞诱导5 h后,在miRNA-7前体干预组中,迁移细胞数明显较少,每高倍视野为(16.0±3.8)个;而在阴性 miRNA对照组、空脂质体组和空白对照组中,迁移细胞数明显较多,每高倍视野分别为(32.2±7.8)个、(31.4±6.9)个和(33.9±8.4)个。经统计学处理,miRNA-7前体干预组迁移细胞数显著少于阴性miRNA对照组、空脂质体组和空白对照组,差异均有显著统计学意义(均为P<0.01);而阴性miRNA对照组、空脂质体组和空白对照组间差异均无统计学意义(均为P>0.05;图2-图 3)。
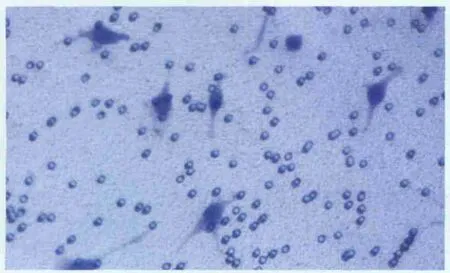
Figure 2 In blank control cell migration images,more visible migration cells could be seen(×200) 空白对照组细胞迁移图,可见迁移细胞较多(×200)
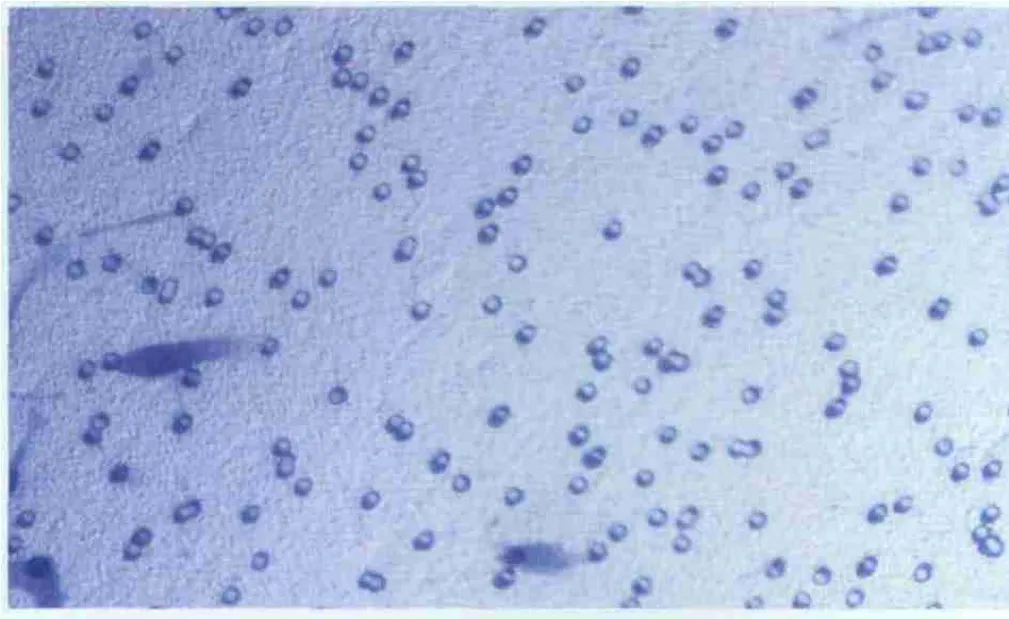
Figure 3 In migration images of microRNA-7 precursor cell intervention groups,less visible migration cells could be seen(× 200)miRNA-7前体干预组细胞迁移图,可见迁移细胞较少(×200)
3 讨论
hRPE细胞是人眼视网膜内的重要细胞,在维持光感受器细胞正常代谢和功能中起关键作用,其最特异的功能在于它对感光细胞外节的吞噬作用。吞噬作用是视色素降解和再生循环周期中的一个环节。hRPE的吞噬作用有赖于细胞内的溶酶体系统。hRPE细胞无再生能力,不出现有丝分裂。细胞死亡后由邻近的细胞向侧面运动,移行衍生死亡细胞遗留下来的空间。hRPE的各项生理功能是否正常,受到来自脉络膜与视网膜的共同影响。随着年龄增长,视网膜中黑色素逐渐减少,而脂褐质逐渐增多。这种脂褐质的增加开始只发生在hRPE的基底膜侧,随年龄增加逐渐扩展至全部细胞质,而使hRPE细胞的代谢受影响。PVR的增生膜主要由色素上皮细胞、胶质细胞、纤维细胞、成纤维细胞和巨噬细胞构成[2]。hRPE细胞在PVR等增生性疾病的发生和发展过程中起重要作用,它不仅是增生膜形成和收缩的主要细胞,而且可以产生趋化因子,吸引纤维胶质细胞和成纤维细胞参与增生膜的形成。
EGF属于ErbB受体家族,在人体内多种组织中都有表达,参与调节增生、分化和发育[3-5]。PVR患者的玻璃体、视网膜下液以及增生膜中都有多种生长因子的存在和表达。张惠蓉等[6]用放射免疫法测定了PVR患者玻璃体中EGF的浓度,发现有显著升高,与血清中EGF无关,且PVR增生膜中 EGFR高表达。hRPE细胞的增生与生长因子及其受体的相互作用有关,相关研究证实EGF与EGFR特异性结合可刺激hRPE细胞的增生、移行,在PVR形成过程中起重要作用[7]。
miRNA是最近发现的一类内源性、非编码、长19~25个碱基的茎环形核苷酸转录物[8],通过与靶基因的3’端非翻译区(3’-UTR)碱基完全或不完全配对结合,引起mRNA的降解或翻译抑制,在转录后调控细胞分化、增殖和凋亡。目前为止,有大约678种人类的miRNA序列被确认[9],后续会有越来越多的人类miRNA被发现。研究发现,miRNA在多种不同的生理过程中均起关键作用,包括发育调控、造血细胞分化、神经系统发育、细胞凋亡、细胞增生和器官发育等,与肿瘤、病毒感染、代谢性疾病的发病也有关。
人视网膜中有多种miRNA分子的表达。对视网膜的320种基因进行分析后发现其中存在有67种miRNA分子的可能作用靶点[10],miRNA-7就是其中的一种。miRNA-7由22个碱基组成,序列为5’-UUGUUUUAGUGAUCAAGAAGGU-3’。实验表明,EGFR mRNA的3’端非翻译区有3个miRNA-7的作用靶点,miRNA-7通过与之结合,抑制多种信号通路的激活,包括 ERK1/2,影响细胞的分化、增生和凋亡,从而参与病理生理过程。体外研究发现,miRNA-7通过与EGFR mRNA的非翻译区结合,抑制ERK1/2和Akt信号通路的激活,从而抑制肿瘤细胞的增生[11]。另外的研究发现,miRNA-7可以诱导细胞的凋亡[12]。在果蝇体内,在EGFR介导的转录抑制因子Yan降解的同时,miRNA-7高表达,并且通过与Yan的非翻译区结合抑制它的翻译,进一步降低Yan的水平,诱导光感受器细胞的分化[13]。
在本研究中我们采用Lipofectamine 2000转染试剂,以GFP为荧光标记物,转染24 h后观察,转染成功细胞的胞膜和胞浆中可见绿色荧光。当miRNA-7前体的终浓度为50 nmol·mL-1、脂质体的终浓度为2.5 μg·mL-1时,转染效率最高,达到 80% 以上;与空白对照组、空脂质体组及阴性 miRNA对照组比较,miRNA-7前体干预组中成熟 miRNA-7的表达较其他3组明显增加,差异均具有统计学意义(均为P<0.05),空脂质体组、阴性对照组与空白对照组之间差异均无统计学意义(均为 P>0.05)。另外,与空白对照组、空脂质体组及阴性 miRNA对照组比较,miRNA-7对 hRPE细胞增殖有明显抑制作用。miRNA-7组细胞增殖抑制率(23.58%)明显高于阴性 miRNA 对照组(2.35%)、空脂质体组(2.97%)与空白对照组(0%),差异均具有统计学意义(均为P<0.05),空脂质体组、阴性 miRNA对照组与空白对照组之间差异均无统计学意义(均为P>0.05)。miRNA-7抑制hRPE细胞的迁移,细胞诱导5 h后,在miRNA-7前体干预组中,迁移细胞数明显较少,每高倍视野为(16.0±3.8)个,与其他3组比较差异均有统计学意义(均为P<0.01);在阴性 miRNA对照组、空脂质体组和空白对照组中,迁移细胞数明显较多,每高倍视野分别为(32.2±7.8)个、(31.4±6.9)个和(33.9±8.4)个,3组间差异均无统计学意义(均为P>0.05)。以往的研究已经证明丝裂原激活的蛋白激酶(mitogen activated protein kinase,MAPK)家族是介导细胞反应的重要信号系统,普遍存在于多种生物中。MAPK信号转导途径是由高度保守的三级酶促级联传递信号,通过苏氨酸和酪氨酸双位点磷酸化激活 MAPK[14]。根据序列的同源性和功能,MAPK家族分为4类,即 ERK1/2、c-Jun N端激酶(JNK)/应激活化蛋白激酶(SAPK)、p38及ERK5/BMK1[15]。激活的MAPK通过磷酸化核转录因子、细胞骨架蛋白及酶类等,参与细胞增生、分化、转化及凋亡的调节,并与炎症、肿瘤及其他多种疾病的发生机制密切相关。ERK1/2信号通路(Ras→Raf→MEK1/2→ERK1/2)是经典的MAPK信号转导途径,能被生长因子、血清及佛波酯等外界刺激激活。研究资料表明[16],EGF可通过与细胞膜上的特异性酪氨酸激酶受体(EGFR)结合,激活ERK1/2信号通路,磷酸化与脯氨酸相邻的丝/苏氨酸,具有广泛的催化活性,介导多种生物学效应。本研究结果证实,miRNA-7可明显抑制 hRPE细胞的增殖和迁移,由于miRNA-7中不存在与 MMP-2和 MMP-9的 3’-UTR区基因互补序列,我们猜测这种抑制作用可能是由于miRNA-7对hRPE细胞的EGFR通路产生了良好的靶向沉默后效应,直接下调EGFR表达,从而阻断或部分阻断了ERK1/2信号通路,使得hRPE细胞的增殖和迁移受到明显抑制。
由于miRNA种类较多,与其他各种细胞因子作用广泛且交叉,加上其表达的组织特异性、时间差异性,我们对其真正的作用机制尚无深入了解,本实验只是初步证实miRNA-7可明显抑制hRPE细胞的增殖和迁移,为下一步的动物体内实验打下良好的理论基础。miRNA-7的研究尚处于起步阶段,其参与PVR等眼部增殖性疾病的发生、发展的其他机制有待于进一步研究。
1 张承芬,董方田,陈有信,赵明威.眼底病学[M].第2版.北京:人民卫生出版社,2010:284-286.
2 李林,李斌,杨安怀,赵婷秀,邢怡桥.人视网膜下膜中ICAM-1及MMP-2的免疫组织化学研究[J].眼科新进展,2005,25(5):519-521.
3 Yano S,Kondo K,Yamaguchi M,Richmond G,Hutchison M,Wakeling A,et al.Distribution and function of EGFR in human tissue and the effect of EGFR tyrosine kinase inhibition[J].Anticancer Res,2003,23(5):3639-3650.
4 李晓梅,刘建红,吕欣,李晓莺,刘向红.胃肠功能障碍早产儿胃液表皮生长因子水平变化及意义[J].中华实用儿科临床杂志,2012,27(6):424-426.
5 郑翠侠,韩兵,周翔,张荣新,万欢英,臧旺福.非小细胞肺癌中表皮生长因子受体基因突变的筛查[J].新乡医学院学报,2011,28(2):190-192.
6 张蕙蓉,曹景泰.视网膜增生性疾病玻璃体中表皮生长因子的放射受体定量测定[J].中华眼底病杂志,1996,12(2):91-93.
7 Lewis TS,Shapiro PS,Ahn NG.Signal transduction through MAP kinase cascades[J].Adv Cancer Res,1998,74(1):49-139.
8 Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
9 Griffiths-Jones S,Grocock RJ,van Dongen S,Bateman A,Enright A.miRBase:microRNA sequences,targets and gene nomenclature[J].Nucleic Acids Res,2006,34(1):140-144.
10 Arora A,McKay GJ,Simpson DA.Prediction and verification of miRNA expression in human and rat retinas[J].Invest Ophthalmol Vis Sci,2007,48(9):3962-3967.
11 Bravo-Egana V,Rosero S,Molano RD,Pileggi A,Ricordi C,Domínguez-Bendala J.et al.Quantitative differential expression analysis reveals miR-7 as major islet microRNA[J].Biochem Biophys Res Commun,2008,366(4):922-926.
12 Cheng AM,Byrom MW,Shelton J,Ford LP.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J].Nucleic Acids Res,2005,33(4):1290-1297.
13 Li X,Carthew RW.A microRNA mediates EGF receptor signaling and promotes photoreceptor differentiation in the Drosophila eye [J].Cell,2005,123(7):1267-1277.
14 Chang L,Karin M.Mammalian MAP kinase signalling cascades[J].Nature,2001,410(6824):37-40.
15 Rincon M .MAP-Kinase signaling pathways in T cells[J].Curr Opin Immunol,2001,13(3):339-345.
16 Kolch W.Meaningful relationships:the regulation of the Ras/Raf/MEK/ERK pathway by protein interactions[J].Biochemistry,2000,351(2):289-305.
