非转移性黑色素瘤糖蛋白B在增生性玻璃体视网膜病变及视网膜色素上皮细胞中的作用
2014-11-13司艳芳樊旭关娟周历赵娟
司艳芳 樊旭 关娟 周历 赵娟
增生性玻璃体视网膜病变(proliferative vitreoretinopathy,PVR)是裂孔源性视网膜脱离手术失败常见的原因[1]。在 PVR膜的细胞成分中最重要的细胞之一是视网膜色素上皮(retinal pigment epithelium,RPE)细胞。研究发现,RPE细胞的增生与PVR发病机制相关[2-5]。非转移性黑色素瘤糖蛋白 B(glycoprotein nonmetastatic melanoma protein b,GPNMB)是一种Ⅰ型跨膜糖蛋白[6],广泛表达于多种组织[7]。研究表明GPNMB与多种疾病的生理、病理过程相关[8]。但尚未有文献报道GPNMB对RPE细胞生物学功能的影响。因此,本研究采用免疫荧光、酶联免疫吸附试验、MTT等方法,检测GPNMB在不同病变程度PVR中的定量表达以及GPNMB对RPE细胞增殖、细胞周期的影响,拟在探讨GPNMB在PVR病变中的作用。
1 材料与方法
1.1 材料来源 收集解放军309医院在2012年1月至12月确诊的18例PVR患者的视网膜表面增生膜。患者年龄15~60岁。PVR病变程度分级标准参照1991年美国视网膜学会的分级方法,分为A、B、C 3级。
1.2 主要仪器及试剂 CO2细胞培养箱(Binder公司,德国),酶联免疫检测仪(Sheldon公司,美国),流式细胞仪(Olympus,日本),激光共聚焦显微镜(Bio-Rad公司,美国)。限制性内切酶 EcoRI、XhoI,T4连接酶,RNA 酶,胰蛋白酶(Takara,大连),LipofectamineTMRNAiMAX,载体 pMD19-T、pcDNA3.1(+)(Invitrogen,美国),抗 GPNMB抗体、抗生物素标记的Texas Red、FITC标记的膜联蛋白(Abcam,美国),M254 培养基、G418、MTT、碘化吡啶(GIBCO BRL,美国)。
1.3 引物及 siRNA GPNMB-P1:5’-AACCTTGAGTGCCTGCGTC-3’,GPNMB-P2:5’-ACTT-CCCCAAACCACAATATCTA-3’;GPNMB-P3:5’-CCGGAATTCATGGAATGTCTCTACTATTTCCTGGGAT-3’,含 EcoRI酶切位点;GPNMB-P4:5’-CCGCTCGAGTCATTAAGAAACTCCTTTAAATTCTTG-3’,含 XhoI酶切位点。靶向 GPNMB的 siRNA序列:GPNMB(sense:5’-GGGCAAUGAAAGACCUUCUTT-3’,antisense:5’-AGAAGGUCUUUCAUUGCCCTT-3’)。所有引物均由上海生工合成。
1.4 方法
1.4.1 免疫荧光 石蜡标本常规脱蜡,进行如下操作:滴加正常羊血清(1∶50稀释),室温温育 30 min;漂洗后与抗 GPNMB(1∶50稀释)一抗于4℃孵育过夜;漂洗后与生物素标记的二抗(1∶50稀释)在37℃温育30 min;最后滴加抗生物素标记的Texas Red(1∶1000稀释),于37℃放置30 min。磷酸盐缓冲溶液(phosphate buffer saline,PBS)漂洗后用甘油封片,于激光共聚焦显微镜下观察并进行定量分析。同时设有PBS替代一抗的空白对照。
1.4.2 酶联免疫吸附试验 于患者玻璃体切割术前抽取3 mL静脉血,离心取血清-20℃保存。采用酶联免疫吸附试剂盒检测血清中GPNMB的含量。以我院检验科健康成年查体者作对照,抽血离心取血清-20℃保存。
1.4.3 人RPE细胞的分离及培养 摘取尸眼球,将眼球放入含200 mg·L-1庆大霉素的 RPMI1640培养液中,自角膜缘后5 mm环形剪开眼球壁,弃眼球前段,在解剖显微镜下切除、吸净玻璃体,用 DHank液清洗眼杯2次,加入215 kU·L-1透明质酸酶和1.25 g·L-1胰蛋白酶混合液,置于37℃孵箱中消化3 min,弃酶混合液,仔细分离神经上皮层,于视盘周围将其剪除,继以2.5 g·L-1胰蛋白酶加入眼杯中,置于37℃孵箱中消化70 min,取出眼杯,用吸管轻轻吹打使细胞脱落,收集RPE细胞悬液;6000 r·min-1离心15 min,弃上清液,将细胞悬浮于培养液中,然后接种于培养瓶,于37℃、体积分数5%CO2培养箱中培养。
1.4.4 真核表达载体的构建 以实验室保存的GPNMB序列为模板,以 GPNMB-P1、GPNMB-P2引物扩增 GPNMB目的片段,与 pMD19-T载体在16℃条件下进行连接反应,并将连接产物转化于感受态大肠杆菌 DH5α,培养后进行筛选,挑选阳性菌落摇菌并提取质粒,电泳鉴定后获得重组质粒pMD19T-GPNMB。以重组质粒为模板,以 GPNMBP3、GPNMB-P4为引物,扩增 GPNMB编码区序列,扩增产物以EcoRI、XhoI双酶切,并用T4 DNA连接酶将其与经相同酶切的真核表达载体 pcDNA3.1(+)连接,筛选获得重组表达载体 pcDNA3.1(+)-GPNMB。
1.4.5 转染 按每孔50×103个 RPE细胞接种至24孔培养板中,待其长至50%融合时按脂质体L2000的操作说明进行转染。具体方法:加入100 μL无血清 M254培养基(内含 siRNA 6 pmol,Lipofectamine 1 μL),混匀后于体积分数5%CO2、37 ℃恒温培养箱中孵育,24 h后经G418筛选,获得稳定表达GPNMB的RPE细胞。
1.4.6 细胞增殖实验 将 RPE细胞接种于96孔培养板上,置于37℃、体积分数5%CO2孵箱中培养48 h。将实验分为对照组、GPNMB转染组及空载体转染组,2.5 g·L-1胰蛋白酶消化各组 RPE 细胞,吸去胰蛋白酶,加入正常培养液继续培养60 min。每孔加入 MTT 溶液(5 g·L-1)20 μL,继续孵育4 h,弃上清,每孔加入150 μL DMSO,振荡10 min后进行比色测定,酶联免疫检测仪在490 nm波长下读取OD值。
1.4.7 细胞周期实验 PBS洗涤RPE细胞1次,加FITC-Annexin-V(fluroscein isothiocyanate-Annexin-V),室温避光放置20 min,PBS洗涤2次,加500 μL甲醛,冰浴25 min,PBS洗涤2次,加入含有10 mg·L-1碘化吡啶和1 g·L-1RNA酶的 PBS缓冲液,室温避光孵育20 min,待流式细胞仪检测。空白对照组采用培养基假诱导[9]。
1.5 统计学分析 以SPSS 11.0统计分析软件进行统计,组间比较采用方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 GPNMB在PVR增生膜中的表达 运用计算机分析系统对PVR增生膜中GPNMB的荧光量作定量分析。结果如图1所示,A级 PVR的增生膜中GPNMB阳性荧光总量为5.07,而 B级膜中 GPNMB荧光总量为 11.21,C级膜中 GPNMB荧光总量为19.34。该结果表明了PVR病变程度越高,GPNMB的荧光强度越强,因此,我们推断GPNMB与PVR疾病有着密切的关系。

Figure 1 Expression of GPNMB in PRM of PVR(*P <0.05,**P<0.01)GPNMB在 PVR 增生膜中的表达(*P<0.05,**P<0.01)
2.2 GPNMB在PVR患者血清中的表达 为了进一步验证免疫荧光实验的结果,我们采用酶联免疫吸附试验法检测了PVR患者血清中的 GPNMB含量。结果如图2所示,与正常人血清中GPNMB的含量相比,PVR患者血清中GPNMB的含量有显著上升,该结果表明GPNMB可以作为PVR患者血清的生物标志物用于PVR疾病的诊断。
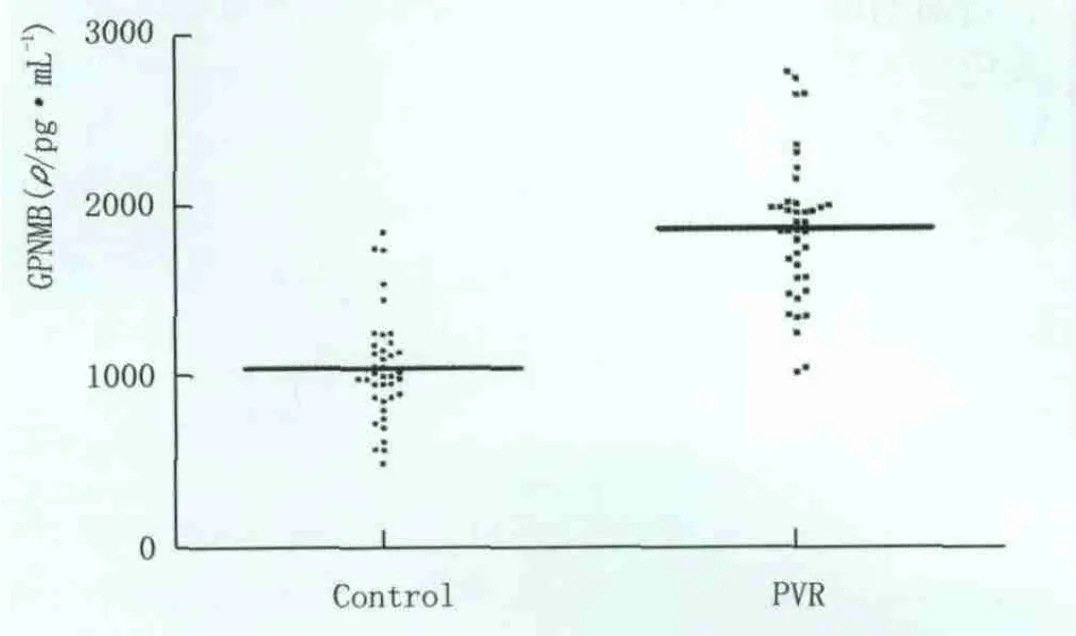
Figure 2 Expression of GPNMB in the serums of patients with PVR GPNMB在PVR患者血清中的表达水平
2.3 GPNMB对RPE细胞增殖的影响 RPE细胞是PVR病理过程的关键因素之一,因此我们研究了GPNMB对RPE细胞的作用,这对进一步研究PVR的发病机制有着重要意义。通过MTT法测定各组反应细胞数的OD值,结果如图3所示,与对照组相比,空载体转染组基本无变化,GPNMB转染组则可以显著促进RPE细胞的增殖,其OD值是对照组的3.7倍,差异有统计学意义(P<0.05);然后以 GPNMB过表达的人RPE细胞为研究对象,加入GPNMB-siRNA观察它对 RPE细胞增殖的影响,结果表明GPNMB-siRNA转染组可以显著抑制RPE细胞的增殖(P<0.05)。该结果说明了 GPNMB在 RPE细胞增殖过程中起着重要作用。
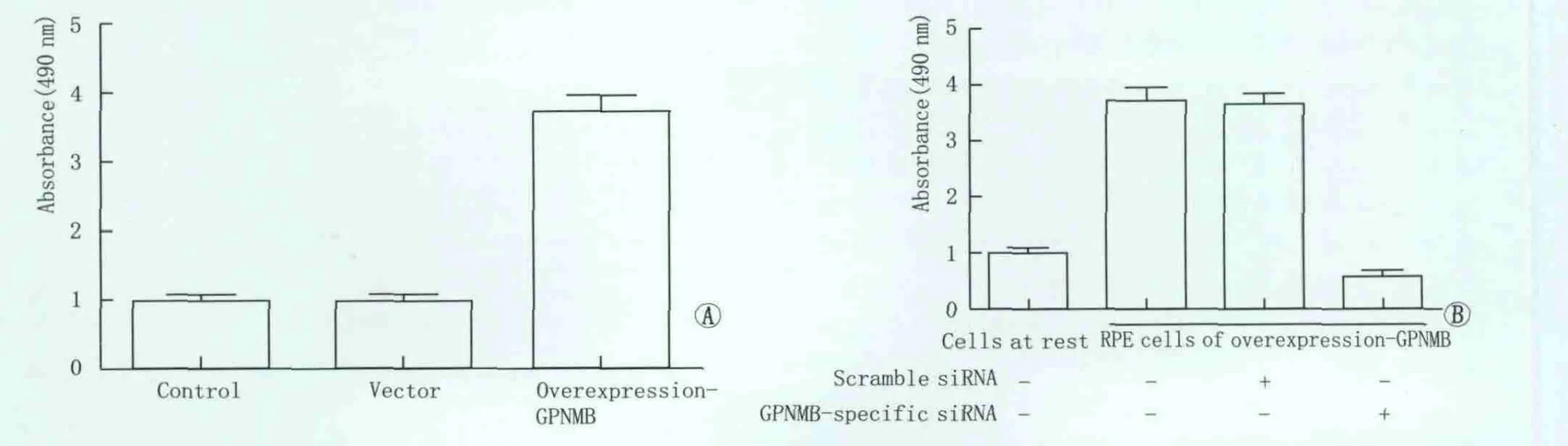
Figure 3 Effects of GPNMB on proliferation of RPE cells.A:Overexpression-GPNMB could significantly promote the proliferation of RPE cells;B:GPNMB-specific siRNA could obviously inhibit the proliferation of RPE cells treated with overexpression-GPNMB GPNMB对RPE细胞增殖的影响。A:GPNMB过表达可以显著促进RPE细胞的增殖;B:特异性的GPNMB-siRNA可以显著抑制GPNMB过表达处理的RPE细胞的增殖
2.4 GPNMB对RPE细胞周期的影响 细胞周期与细胞增殖有着密切的联系,因此我们推断GPNMB可能通过调控RPE细胞周期来促进其增殖。GPNMB处理无血清培养的RPE细胞24 h后,流式细胞仪检测GPNMB转染对细胞周期的影响。结果如图4所示,与对照组相比,GPNMB过表达及 siRNA对细胞周期均有显著影响,因此,GPNMB通过细胞周期调控途径促进RPE细胞的增殖。
3 讨论

Figure 4 Effects of GPNMB on RPE cells cycle.A:Image of RPE cells cycle;B:GPNMB-siRNA could decrease the percentage of S phase of RPE cells cycle;C:GPNMB-overexpression could increase the percentage of S phase of RPE cells cycle GPNMB对RPE细胞周期的影响。A:RPE细胞周期图;B:GPNMB-siRNA可降低RPE细胞周期S期细胞的百分比;C:GPNMB过表达可增加RPE细胞周期S期细胞的百分比
PVR是一种以细胞增生及牵拉性视网膜脱离为特征的眼部疾患;是孔源性视网膜脱离和眼外伤最严重的并发症,常常引起失明和眼球萎缩。它的基本病理过程是眼内细胞,包括 RPE细胞、神经胶质细胞和成纤维细胞样细胞等移行进入玻璃体内;黏附在玻璃体视网膜界面上,增生产生细胞外基质,在玻璃体内及视网膜表面形成有收缩能力的膜;膜收缩牵拉视网膜脱离,视力丧失[10]。GPNMB作为一种糖基化的跨膜蛋白,参与了多种细胞的生理功能。最近研究表明GPNMB在多种细胞的增生过程中起到重要作用[11-13],因此,本文研究了 GPNMB与 PVR的关系以及GPNMB对RPE细胞的作用。
免疫荧光结果显示,PVR增生膜的病变程度越高,GPNMB的荧光强度越强,该结果表明了GPNMB与PVR疾病的发展过程可能有着密切的联系。为了验证GPNMB与PVR疾病有关系,我们采用酶联免疫吸附试验比较了正常人与PVR患者血清中GPNMB的含量,结果表明PVR患者血清中GPNMB的含量远高于对照组,由此我们推测GPNMB可以作为PVR患者血清的生物标志,用于PVR疾病的诊断。PVR的发病机制主要是与RPE细胞的病理性增生相关,结合GPNMB在RPE细胞中有表达,我们推测GPNMB对RPE细胞的增生可能起着一定的作用。本实验我们构建了GPNMB的siRNA以及过表达载体,采用转染的方法将其转入RPE细胞,然后采用MTT法检测GPNMB对RPE细胞增殖的影响。结果表明GPNMB-siRNA可以显著抑制RPE细胞的增殖,而GPNMB过表达则会显著促进其增殖,由此我们推测GPNMB可能是RPE细胞的一个调控分子,影响着它的增生,进而导致PVR的发展。流式细胞仪测定RPE细胞周期结果显示,GPNMB转染组的S期细胞比例与无血清培养的对照组相比有明显的增加,而GPNMB-siRNA转染组则显著减少,进一步印证了MTT的实验结果。
综上所述,GPNMB作为PVR中的一个关键分子,通过细胞周期调控途径影响RPE细胞的增殖,但其具体作用机制还有待于进一步研究,这为PVR的预防及治疗提供了有益的思路。
1 惠延年.增生性玻璃体视网膜病变:带入21世纪的课题[J].中华眼底病杂志,1999,15(2):67-68.
2 Lu B,Malcuit C,Wang S,Girman S,Francis P,Lemieux L,et al.Long-term safety and function of RPE from human embryonic stem cells in preclinical models of macular degeneration[J].Stem Cells,2009,27(9):2126-2135.
3 Carr AJ,Vugler A,Lawrence J,Chen LL,Ahmado A,Chen FK,et al.Molecular characterization and functional analysis of phagocytosis by human embryonic stem cell-derived RPE cells using a novel human retinal assay[J].Mol Vis,2009,15(3):283-295.
4 Chuang JZ,Chou SY,Sung CH.Chloride intracellular channel 4 is critical for the epithelial morphogenesis of RPE cells and retinal attachment[J].Mol Biol Cell,2010,21(17):3017-3028.
5 Lewis GP,Matsumoto B,Fisher SK.Changes in the organization and expression of cytoskeletal proteins during retinal degeneration induced by retinal detachment[J].Invest Ophthalmol Vis Sci,1995,36(12):2404-2416.
6 Rose AAN,Grosset AA,Dong Z,Russo C,MacDonald PA,Bertos NR,et al.Glycoprotein nonmetastatic B is an independent prognostic indicator of recurrence and a novel therapeutic target in breast cancer[J].Clin Cancer Res,2010,16(7):2147-2156.
7 Hoashi T,Sato S,Yamaguchi Y,Passeron T,Tamaki K,Hearing VJ.Glycoprotein nonmetastatic melanoma protein b,a melanocytic cell marker,is a melanosome-specific and proteolytically released protein[J].FASEB J,2010,24(5):1616-1629.
8 Tomihari M,Hwang SH,Chung JS,Cruz Jr PD,Ariizumi K.Gpnmb is a melanosome-associated glycoprotein that contributes to melanocyte/keratinocyte adhesion in a RGD-dependent fashion[J].Exp Dermatol,2009,18(7):586-595.
9 Okazawa M,Shiraki T,Ninomiya H,Kobayashi S,Masaki T.Endothelin-induced apoptosis of A375 human melanoma cells[J].J Biol Chem,1998,273(20):12584-12592.
10 Wang C,Cao GF,Jiang Q,Yao J.TNF-α promotes human retinal pigment epithelial(RPE)cell migration by inducing matrix metallopeptidase 9(MMP-9)expression through activation of Akt/mTORC1 signaling[J].Biochem Biophys Res Commun,2012,425(1):33-38.
11 Rose AAN,Siegel PM.Emerging therapeutic targets in breast cancer bone metastasis[J].Future Oncol,2010,6(1):55-74.
12 Xiao Y,Qiao Z,Zhang X,Liu Z,Xie J,Hao Y,et al.Expression of glycoprotein non-metastatic melanoma protein B in prostate cancer and its significance[J].Health Sci,2011,43(4):496-499.
13 Zhang P,Liu W,Zhu C,Yuan X,Liu D,Gu W,et al.Sliencing of GPNMB by siRNA inhibits the formation of melanosomes in melanocytes in a MITF-independent fashion[J].PLoS One,2012,7(8):e42955.
