核因子-κB在BN大鼠脉络膜新生血管中的表达△
2014-11-13高小燕何守志
高小燕 何守志
核因子-κB(nuclear factor-kappa B,NF-κB)是1986年首先从B细胞核中提取到,近年在肿瘤中研究较热的一个核转录因子,参与多种炎症细胞因子、趋化因子及免疫基因表达的转录和调节。一般情况下,NF-κB 与其抑制蛋白 IκB(inhibitory кB,IκB)结合呈非活性状态,但受刺激后可以和IκB解离,进入细胞核内,参与细胞因子、黏附分子、生长因子和急性蛋白等因子的转录调控,在疾病的调节,尤其是炎症性疾病的启动中起重要作用[1]。近年来研究的焦点在于NF-κB在新生血管形成中的作用[2-3]。本实验仅就NF-κB在脉络膜新生血管(choroidal neovascularization,CNV)中的表达作一研究。
1 材料与方法
1.1 仪器设备与主要药品试剂 氪激光机(美国Coherent公司,型号为Novua 2000);FFA摄像机(德国Heideberg公司);Image-Pro Plus 5.1图像分析系统(美国Media Cybernetics公司)。小鼠抗大鼠NF-κB单克隆抗体0.1 mL、AEC显色试剂盒(北京中杉金桥生物技术有限公司);兔抗大鼠单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)多克隆抗体、血管内皮生长因子(vascular endothelial growth factor,VEGF)原位杂交检测试剂盒、即用型SABC 试剂盒、0.01 mol·L-1枸橼酸盐缓冲液、SP-9002免疫组织化学染色试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 BN大鼠CNV模型的建立 48只健康雄性棕色BN大鼠由中国医学科学院实验动物中心提供,系清洁级动物,体质量200~220 g,随机选取一眼作为实验眼。0.5 g·L-1复方托品酰胺滴眼液滴双眼散瞳,左下腹腔内注射100 g·L-1水合氯醛溶液(3.0 mL·kg-1)麻醉,检查双眼前节和眼底均正常。依照赵世红等[4]的方法建立CNV动物模型,实验眼前放置-53 D的接触镜,氪激光(647 nm)距视盘等距离围绕视盘视网膜光凝20点。激光参数:功率360 mW,光斑直径 100 μm,曝光时间 0.05 s。
1.2.2 FFA检查 分别于视网膜光凝后 1周、2周、3周、4周、5周、6周、7周、8周,各选取 6只大鼠进行全身麻醉、散瞳,腹腔内注射100 g·L-1荧光素钠0.3 mL,行FFA检查。每个时间点选取6张FFA图像,进行积分光密度(integrated optical density,IOD)值计算,取其平均值。
1.2.3 病理标本的制作 分别在1周、2周、3周、4周、5周、6周、7周、8周深度麻醉下,随机摘除6只BN大鼠的双眼眼球,使用二乙基焦碳酸酯(diethylprocarbonate,DEPC)处理过的蒸馏水冲洗,置于40 g·L-1多聚甲醛-0.1 mol·L-1PBS-DEPC 液中固定2 h。梯度酒精脱水、透明、浸蜡、包埋,蜡块4℃保存备用。眼球组织5 μm厚度连续切片,置于50℃ DEPC处理过的蒸馏水中展片,捞片,置烤箱37℃烤片12 h后,4℃保存,备用做HE染色、免疫组织化学检测及原位杂交检测。400倍显微镜下观察CNV生长情况,免疫组织化学方法检测 NF-κB、MCP-1蛋白表达及VEGF mRNA的转录情况,并测量不同时期CNV面积。
1.2.4 NF-κB与MCP-1的免疫组织化学检测 石蜡切片,常规脱蜡至水;体积分数30%H2O2室温孵育10 min,阻断内源性过氧化物酶活性;微波中火加热15 min进行抗原微波炉热修复;免疫组织化学检测步骤依照试剂盒说明书进行,分别滴加一抗兔抗大鼠MCP-1多克隆抗体(1∶70)和小鼠抗大鼠的NF-κB单克隆抗体(1∶70),4℃过夜;滴加 AEC显色剂,室温显色,镜下控制反应时间(3~10 min);苏木素轻度复染 10 s,水溶性封片剂封片。0.01 mmol·L-1的 PBS 取代一抗孵育,作为阴性对照,试剂盒中已知阳性切片作为阳性对照。切片内被染成红色的点或团簇为阳性反应物。400倍光镜下,选取每个眼球连续切片中含有最大CNV直径的切片,对每张切片的NF-κB与MCP-1蛋白表达的免疫着色IOD值进行测量,取5张切片的平均IOD值作为每个标本的观察值,并观察CNV生长及细胞浸润情况。
1.2.5 VEGF的原位杂交检测 石蜡切片常规脱蜡至 DEPC水;体积分数 30%H2O2室温作用 10 min,灭活内源性酶;切片上滴加30 g·L-1胃蛋白酶室温消化10 min暴露mRNA片段;10 g·L-1多聚甲醛 0.1 mol·L-1PBS-DEPC 室温固定 10 min;滴加20 μL预杂交液,于杂交湿盒中40℃预杂交3 h;滴加含VEGF寡核苷酸标记探针的杂交液20 μL,原位杂交专用盖玻片盖在玻片上,置湿盒中于42℃杂交18 h,依照试剂盒说明书进行杂交;AEC室温显色,镜下控制反应时间,苏木素复染20 s,GVA水溶性封片剂封片。呈团簇、点状的红色着色为阳性。用不含探针的杂交液进行杂交作为阴性对照,试剂盒中已知阳性切片作为阳性对照。400倍光镜下,选取每个眼球连续切片中含有最大CNV直径的切片,对每张切片的VEGF mRNA阳性着色的IOD值进行测量,取5张切片的平均IOD值作为每个标本的观察值,并观察CNV生长及细胞浸润情况。
1.3 图像分析与数据处理 应用 Image-Pro Plus 5.1图像分析系统对NF-κB、MCP-1蛋白表达的阳性着色及VEGF mRNA的阳性着色、CNV面积、FFA检查结果(IOD值)进行半定量分析。
1.4 统计学处理 应用SPSS 13.0统计软件包进行统计学处理,实验测试指标的数据资料以表示,不同时间点内组内差异的显著性情况用单因素方差分析,组间两两比较用 S-N-K检验。同时,分别对NF-κB 蛋白与 MCP-1、VEGF mRNA、CNV 面积、FFA检查结果(IOD值)进行相关性分析。
2 结果
2.1 光凝后不同时间点 CNV面积及 FFA(IOD值)情况 由BN大鼠的病理切片可见,正常BN大鼠视网膜、脉络膜各层组织结构清晰,光凝后1周可见Bruch膜破裂,少量CNV形成,之后CNV面积逐渐增加,至光凝后8周可见明显CNV形成(图1),不同时间点 CNV面积间差异均有统计学意义(均为P<0.05;见表1)。FFA检查结果示,光凝后早期可见在激光光凝损伤区小的、沿光凝斑较淡的云雾状荧光渗漏,2周后荧光渗漏明显增强,之后荧光渗漏扩散,表现为晚期强荧光。不同时间点荧光渗漏的IOD值检测结果表明,随时间推移IOD呈逐渐增加趋势(表1)。
2.2 光凝后不同时间点 NF-κB蛋白、MCP-1和VEGF mRNA的表达情况 免疫组织化学检测结果显示,NF-κB蛋白在光凝后1周即有表达,主要表达于CNV组织中的色素上皮细胞、巨噬细胞及血管内皮细胞,之后表达逐渐增多,至8周时达到高峰(图2);IOD检测结果显示,光凝后不同时间点间NF-κB蛋白表达差异均有统计学意义(均为P<0.05;见表2)。光凝后1周MCP-1呈微弱点状表达,之后表达逐渐增强,至第8周时达到高峰(图3,表2)。原位杂交检测结果表明,VEGF mRNA的表达主要位于CNV的新生血管组织中,可见红色的阳性表达物随时间延长逐渐增加,不同时间点间差异均具有统计学意义(均为 P<0.05;见表2)。
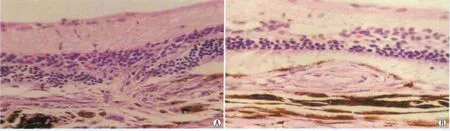
Figure 1 Changes of CNV after photocoagulation.A:At 1 week after photocoagulation,broken bruch membrane could be obviously seen,a small amount of CNV formed;B:At 8 weeks after photocoagulation,CNV obvious formed 光凝后CNV的变化。A:光凝后1周,可见Bruch膜破裂,少量CNV形成;B:光凝后8周,可见明显的CNV形成
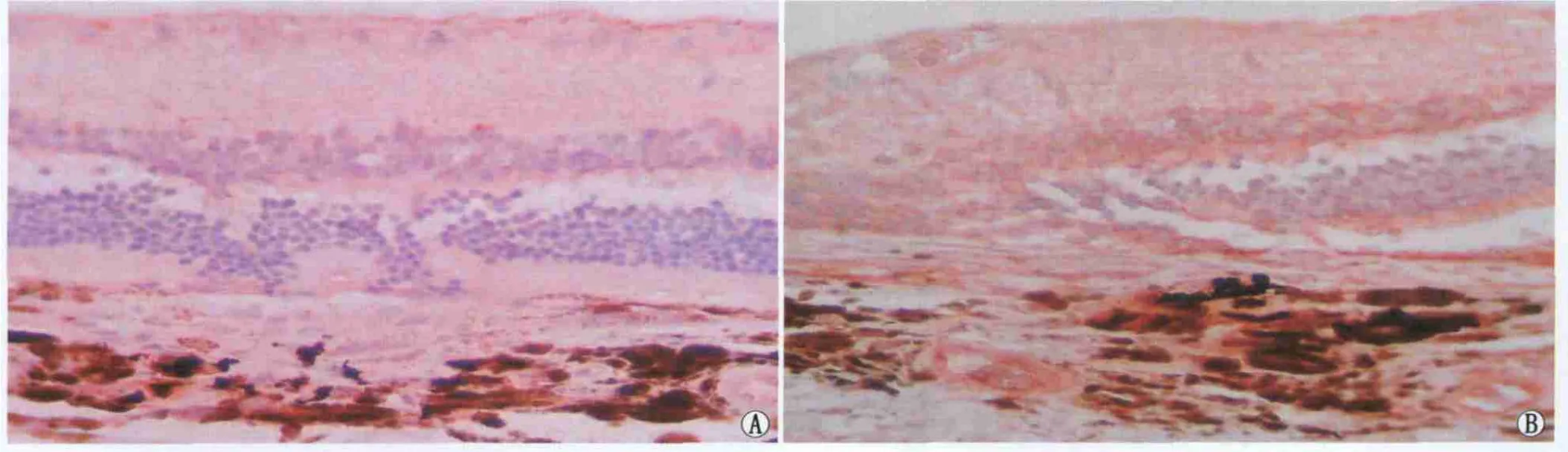
Figure 2 Expression of NF-κB in CNV.A:At 1 week after photocoagulation,NF-κB in CNV tissues weakly expressed and scattered;B:At 8 weeks after photocoagulation,NF-κB expression reached the peak NF-κB蛋白在CNV中的表达。A:光凝后1周,NF-κB在CNV组织中散在微弱表达;B:光凝后8周,NF-κB表达达到高峰

Figure 3 Expression of MCP-1 in CNV.A:At 1 week after photocoagulation,MCP-1 protein was weakly expressed;B:At 8 weeks after photocoagulation,MCP-1 expression reached the peak MCP-1蛋白在CNV中的表达。A:光凝后1周MCP-1呈微弱点状表达;B:光凝后8周,MCP-1表达达到高峰
表1 不同时间点CNV面积和FFA检查结果Table 1 Changes of CNV area and FFA(IOD)at different time points after photocoagulation(,n=6)

表1 不同时间点CNV面积和FFA检查结果Table 1 Changes of CNV area and FFA(IOD)at different time points after photocoagulation(,n=6)
Note:Compared with previous group,*P <0.05
Time CNV area(S/μm2)IOD 1 week 3981.42±608.07 268.38±61.91 2 weeks 4864.28±146.80* 557.88±94.58*3 weeks 5381.77±170.64* 663.30±69.13*4 weeks 6122.99±202.08* 718.12±33.14 5 weeks 6631.10±517.24* 828.66±40.75*6 weeks 7448.10±423.42* 872.87±64.63 7 weeks 9368.43±435.50* 906.57±40.19 8 weeks 10 470.63±353.90*967.57±33.78
表2 不同时间点 NF-κB蛋白、MCP-1和 VEGF mRNA的表达变化Table 2 Changes of NF-κB,MCP-1,VEGF mRNA expression at different time points after photocoagulation (,n=6)

表2 不同时间点 NF-κB蛋白、MCP-1和 VEGF mRNA的表达变化Table 2 Changes of NF-κB,MCP-1,VEGF mRNA expression at different time points after photocoagulation (,n=6)
Note:Compared with previous group,*P <0.05
Time NF-κB MCP-1 VEGF mRNA 1 week 14.50±3.47 11.96±4.87 16.72±4.22 2 weeks 31.48±8.37* 58.23±8.94* 60.64±6.49*3 weeks 55.21±12.02* 100.04±12.73* 81.83±13.15*4 weeks 89.89±12.76* 130.09±4.71* 116.41±11.42*5 weeks 125.42±7.35* 180.02±10.24* 151.35±12.63*6 weeks 174.57±9.03* 330.31±15.11* 212.92±12.92*7 weeks 215.26±11.33* 390.51±11.97* 322.01±9.88*8 weeks 379.96±12.66* 421.88±9.13* 417.41±18.66*
2.3 相关性分析 将NF-κB蛋白表达情况与CNV面积、MCP-1、VEGF mRNA及FFA(IOD)结果进行相关性分析发现,NF-κB蛋白与上述各因素间均呈显著正相关(r=0.951、0.924、0.976、0.824,均为 P <0.05)。
3 讨论
NF-κB是一个普遍存在的转录因子,具有广泛的生物学活性。1986年,Sen和 Baltimore首先从 B淋巴细胞核抽提物中检出 NF-κB,它是可与免疫球蛋白的轻链基因增强子κB序列(GGGACTTTCC)特异结合的核蛋白因子。在哺乳动物细胞中最常见的二聚体是 p50/RelA异源二聚体,也称NF-κB。NF-κB的结合位点可接受多种免疫刺激,细胞浆中NF-κB/IκB 复合物中 IκB 磷酸化而与 NF-κB 解离,继而NF-κB进入细胞核,作用于靶基因,迅速诱导基因的表达,并产生级联效应。NF-κB作为具有多向调节功能的转录因子,广泛参与许多基因的转录调控,如趋化因子和酶的表达调控,防止凋亡和死亡,以及编码血管形成因子或黏附分子等的基因调控[5-7]。目前的研究表明,NF-κB可能对血管形成具有核心的调节作用[7-8]。尽管目前对 NF-κB在新生血管形成中的参与机制还没有详细的阐明,但现有证据表明NF-κB在毛细血管形成中起到一定作用,并且它也是视网膜新生血管形成的必要因子[6-9]。
NF-κB总是被缺氧诱导[5],Yoshida 等[10]和Hammes等[11]在视网膜新生血管模型中研究发现,因为视网膜血管主要供应视网膜内层结构,在视网膜相对缺氧状态下,NF-κB主要在视网膜内核层和神经纤维层的胶质细胞和内皮细胞的细胞核中表达。缺氧是缺血性视网膜病变和年龄相关性黄斑变性患者中CNV的共同启动因素。在本实验的BN大鼠CNV模型中,激光光凝导致脉络膜毛细血管萎缩,故引起RPE、外层视网膜和脉络膜组织的缺血缺氧。我们在BN大鼠的眼球组织切片中,采用小鼠抗大鼠的NF-κB单克隆抗体检测其表达定位,在正常的视网膜、脉络膜组织中几乎不能检测到NF-κB的表达,而CNV组织中的血管内皮细胞、巨噬细胞、增生的色素上皮细胞及少量的视网膜外颗粒层组织均有NF-κB的表达。除了损伤区的缺血缺氧致NF-κB表达增加外,直接的激光损伤导致的在视网膜和脉络膜组织中的防御和修复反应,也引起了NF-κB的表达增加。在1~8周内 NF-κB的表达与 CNV面积、FFA(IOD)、VEGF mRNA 呈正相关,揭示 NF-κB在CNV的形成中起了重要作用。这点与以往报道[12]结果一致。在本实验中,NF-κB除在增生的新生血管内皮细胞表达外,也在迁移增生的色素上皮细胞中表达,我们推测NF-κB可能介导了血管内皮细胞和色素上皮细胞的增生。有研究者在体外实验模型中发现,NF-κB反义寡核苷酸和 PDTC(NF-κB活化的抑制剂)可以抑制新生血管形成[6]。因此我们推测,NF-κB为治疗视网膜新生血管及CNV提供了一个干预点。还有实验者发现在激光诱导的小鼠CNV中,姜黄素降低了MCP-1的表达及NF-κB的活化,抑制了 CNV 的形成[13]。
NF-κB对于毛细血管的形成是很重要的,尽管不能确定到底是在哪一步依赖于 NF-κB,但是 NF-κB对于抑制凋亡是必需的,许多黏附分子的激活也需要 NF-κB。此外,NF-κB可以诱导基质金属蛋白酶和VEGF受体flk-1的表达,对VEGF可能有正向调节作用[14-15],VEGF基因包含转录因子 NF-κB 和AP-1 的识别位点[16]。Shono 等[6]研究证实 NF-κB可以在体外调节新生血管形成,这进一步证明了NF-κB的强有力的促血管形成功能。在本实验研究中,可见VEGF mRNA的基因表达主要位于CNV中的新生血管组织内,且在CNV发展的8周内,呈逐渐增加的趋势,随NF-κB蛋白表达的增强而增强,二者的表达呈正相关(P<0.05),说明VEGF在缺氧状态下可在眼内组织中表达,且NF-κB的活化对于它的表达是必要的。此外,NF-κB正向调节 VEGF mRNA转录水平,VEGF反过来又能增强 NF-κB的结合能力,共同促进新生血管的形成[1]。
MCP-1是已知最有效的巨噬细胞趋化因子,主要由单核细胞、淋巴细胞、成纤维细胞、内皮细胞以及视网膜色素上皮细胞[17-18]产生,但几乎所有的细胞和组织经适当刺激后均能产生MCP-1。细胞在缺氧状态下,NF-κB 活化引起 MCP-1的产生增加[19]。本研究证实,MCP-1主要在CNV的新生血管内皮细胞周围及色素上皮细胞和巨噬细胞周围表达,并且随时间推移而增加。MCP-1参与了炎症细胞在CNV部位的聚集,在实验模型及手术剥离的CNV中已经证实巨噬细胞存在于CNV的基质中[20],由巨噬细胞产生的炎症因子和生长因子参与了血管形成和CNV的细胞移行。大量巨噬细胞和增生的视网膜色素上皮细胞浸润在CNV组织中,与MCP-1的表达增加有一定关系。Shyy等[21]曾报道,MCP-1基因的5’侧翼序列区有几个作用元件与NF-κB的结合基序具有同源性。NF-κB一旦活化,可以产生信号级联反应导致磷酸化和 IκB降解;NF-κB在摆脱了 IκB后,可以易位到细胞核内,引起MCP-1基因的转录。本研究结果可见,光凝后1~8周 MCP-1的表达与 NF-κB呈正相关。
Jo等[22]采用以脂质体为载体视网膜下注射的方法在实验性CNV中转染,以对抗NF-κB在核内结合位点的顺式作用元件的“decoy”(一段双链磷硫寡核苷酸),成功地将“decoy”转染到 CNV的色素上皮细胞和巨噬细胞中。FFA显示激光诱导的CNV的形成被抑制。表明以 NF-κB为靶点的“decoy”是一个很有效的治疗新生血管的方法。Hara等[23]利用小鼠CNV模型中腹腔注射N-乙酰半胱氨酸,发现可以抑制NF-κB活化从而抑制CNV形成。
总之,NF-κB可激活前炎症性细胞因子、趋化因子、细胞间黏附分子等的靶基因,上调这些细胞因子的表达,这些靶基因的表达产物又反过来激活 NF-κB,从而形成恶性循环加重局部和全身炎症反应[23],NF-κB 在 CNV 中表达持续增加,可能在 CNV的起始和发展中起了很重要的作用。
1 Chen F,Eriksson P,Hansson GK,Herzfeld I,Klein M,Hansson LO ,et al.Expression of matrix metalloproteinase 9 and its regulators in the unstable coronary atherosclerotic plaque[J].Int J Mol Med,2005,15(1):57-65.
2 Arjamaa O,Nikinmaa M,Salminen A,Kaarniranta K.Regulatory role of HIF-1alpha in the pathogenesis of age-related macular degeneration(AMD)[J].Ageing Res Rev,2009,8(4):349-358.
3 Moreira EF,Larrayoz IM ,Lee JW,Rodríguez IR.7-Ketocholesterol is present in lipid deposits in the primate retina:Potential implication in the induction of VEGF and CNV formation[J].Invest Ophthalmol Vis Sci,2009,50(2):523-532.
4 赵世红,何守志.氪激光诱导的大鼠脉络膜新生血管模型研究[J].中华眼科杂志,2003,39(5):298-302.
5 Grilli M ,Chiu JJ,Lenardo MJ.NF-kB and Rel:Participants in a multiform transcriptional regulatory system[J].Int Rev Cytol,1993,143(1):1-62.
6 Shono T,Ono M,Izumi H,Jimi SI,Matsushima K,Okamoto T,et al.Involvement of the transcription factor NF-kappaB in tubular morphogenesis of human microvascular endothelial cells by oxidative stress[J].Mol Cell Biol,1996,16(8):4231-4239.
7 Yoshida S,Ono M,Shono T,Izumi H,Ishibashi T,Suzuki H,et al.Involvement of interleukin-8,vascular endothelial growth factor,and basic fibroblast growth factor in tumor necrosis factor alpha-dependent angiogenesis[J].Mol Cell Biol,1997,17(7):4015-4023.
8 Oitzinger W,Hofer-Warbinek R,Schmid JA,Koshelnick Y,Binder BR,de Martin R.Adenovirus-mediated expression of a mutant IkB kinase 2 inhibits the response of endothelial cells to inflammatory stimuli[J].Blood,2001,97(6):1611-1617.
9 陈慷,盛艳娟.核因子-κB在糖尿病大鼠视网膜中的表达和意义[J].眼科新进展,2010,30(1):31-34.
10 Yoshida A,Yoshida S,Hata Y,Khalil AK,Ishibashi T,Inomata H.The role of NF-κB in retinal neovascularization in the rat:Possible involvement of cytokine-induced neutrophil chemoattractant(CINC),a member of the interleukin-8 family[J].J Histochem Cytochem,1998,46(4):429-436.
11 Hammes HP,Hoerauf H,Alt A,Schleicher E,Clausen JT,Bretzel RG,et al.N(epsilon)(carboxymethyl)lysin and the AGE receptor RAGE colocalize in age-related macular degeneration[J].Invest Ophthalmol Vis Sci,1999,40(8):1855-1859.
12 Wu T,Handa JT,Gottsch JD.Light-induced oxidative stress in choroidal endothelial cells in mice[J].Invest Ophthalmol Vis Sci,2005,46(4):1117-1123.
13 Xie P,Zhang W,Yuan S,Chen Z,Yang Q,Yuan D,et al.Suppression of experimental choroidal neovascularization by curcumin in mice[J].PLoS One,2012,7(12):e53329-53334.
14 Yu HG,Zhong X,Yang YN ,Luo HS,Yu JP,Meier JJ,et al.Increased expression of nuclear factor-kappaB/RelA is correlated with tumor angiogenesis in human colorectal cancer[J].Int J Colorectal Dis,2004,19(1):18-22.
15 Nagineni CN ,Kommineni VK,William A,Detrick B,Hooks JJ.Regulation of VEGF expression in human retinal cells by cytokines:implications for the role of inflammation in age-related macular degeneration[J].J Cell Physiol,2012,227(1):116-126.
16 Bancroft CC,Chen Z,Dong G,Sunwoo JB,Yeh N,Park C,et al.Coexpression of proangiogenic factors IL-8 and VEGF by human head and neck squamous cell carcinoma involves coactivation by MEKMAPK and IKK-NF-kappaB signal pathways[J].Clin Cancer Res,2001,7(2):435-442.
17 Bian ZM,Elner VM,Yoshida A,Kunkel SL,Elner SG.Signaling pathways for glycated human serum albumin-induced IL-8 and MCP-1 secretion in human RPE cells[J].Invest Ophthalmol Vis Sci,2001,42(7):1660-1668.
18 Bian ZM,Elner SG,Yoshida A,Elner VM.Differential involvement of phosphoinositide 3-kinase/Akt in human RPE MCP-1 and IL-8 expression[J].Invest Ophthalmol Vis Sci,2004,45(6):1887-1896.
19 Lakshminarayanan V,Lewallen M ,Frangogiannis NG,Evans AJ,Wedin KE,Michael LH,et al.Reactive oxygen intermediates induce monocyte chemotactic protein-1 in vascular endothelium after brief ischemia[J].Am J Pathol,2001,159(4):1301-1311.
20 Grossniklaus HE,Hutchinson AK,Capone A,Woolfson J,Lambert HM.Clinicopathologic features of surgically excised choroidal neovascular membranes[J].Ophthalmology,1994,101(6):1099-1111.
21 Shyy Y,Li Y,Kolattukudy PE.Structure of human monocyte chemotactic protein gene and its regulation by TPA[J].Biochem Biophys Res Comm,1990,169(2):346-351.
22 Jo N ,Ogata N,Aoki M,Otsuji T,Morishita R ,Kaneda Y,et al.Effective transfection of a cis element“decoy”of the nuclear factor-kappa B binding site into the experimental choroidal neovascularization[J].Curr Eye Res,2002,24(6):465-473.
23 Hara R,Inomata Y,Kawaji T,Sagara N,Inatani M,Fukushima M,et al.Suppression of choroidal neovascularization by N-acetyl-cysteine in mice[J].Curr Eye Res,2010,35(11):1012-1020.
