塔克拉玛干沙漠南缘3个沙拐枣种的抗旱特性比较
2014-11-12黄彩变曾凡江雷加强
黄彩变,曾凡江,雷加强
(1.中国科学院新疆生态与地理研究所,新疆 乌鲁木齐830011;2.新疆策勒荒漠草地生态系统国家野外科学观测研究站,新疆 策勒848300)
沙拐枣(Calligonum)属于蓼科沙拐枣属,是干旱区(半干旱区)沙漠和戈壁上广泛分布的旱生或超旱生植物,也是中亚和亚洲中部荒漠植被的重要建群植物之一,在亚洲、欧洲南部和非洲北部均有分布[1]。具有抗风蚀、耐沙埋、抗干旱、耐贫瘠,萌蘖力强,根系发达等特性,能在极端严酷的干旱荒漠区生长,全球共有35种,均为固沙造林的先锋树种[2]。网状沙拐枣(C.cancellatum)、心形沙拐枣(C.cordatum)和红皮沙拐枣(C.rubicundum)在新疆吐鲁番沙漠植物园已引种多年,均能在气温近50℃,风速超过30 m/s的恶劣环境中正常生长,目前欲在塔克拉玛干沙漠南缘引进种植。研究区域降水极少,风沙危害严重,干旱早已成为当地植被生长和存活的最主要制约因子,因此,在研究区域开展引种植物的抗旱性研究十分必要。
抗旱性是植物自身形态特征、生理生化特性与环境因素相互作用而构成的一个复杂性状。有研究表明抗旱性强的植物具有良好的抵御和适应不良环境的生理策略,例如在干旱胁迫时抗旱性强的植物可维持较高的抗氧化酶活性,以利于降低和消除氧胁迫,减轻质膜损伤[3]。渗透调节物质的积累也是植物响应干旱胁迫的重要方式之一。有研究指出植物种的抗旱性越强,可溶性糖和游离脯氨酸等渗透调节物质的含量也越高[4-5]。还有研究发现,在干旱胁迫下抗旱性强的植物叶片持水能力也较强[6],光合色素含量也较高[7]。这表明水分胁迫时植物体内会产生一系列生理和生化变化来响应或适应干旱环境,要系统、深入地了解不同植物种在相同环境条件下的抗旱性差异,就必须利用与抗旱性有关的多项生理指标来进行综合评价[4,8]。
有关其他沙拐枣种如头状沙拐枣(C.caput-medusae)在干旱区的形态和生理适应特征已有大量研究。头状沙拐枣在干旱生境中具有较高的水分利用效率[9],可维持较高的水势和光合能力[10],属于生理抵抗型[11]。干旱条件下,头状沙拐枣幼苗可通过增加根系深度和根冠比、同化枝枯落等途径来适应干旱胁迫[12],其幼苗株高、基茎和冠幅等形态特征和水分条件呈正相关[13]。但是针对网状、心形和红皮沙拐枣这方面的研究还鲜有报道。为此,在塔克拉玛干沙漠南缘策勒绿洲外围生态学试验场,采用水分控制试验,研究了网状、心形和红皮沙拐枣在干旱胁迫和复水过程中的生理生态响应,并比较了3个沙拐枣种的抗旱性差异,研究结果可为绿洲外围生态防护体系建设中植物种的筛选工作提供科学依据。
1 材料与方法
1.1 研究区域概况
试验区位于塔克拉玛干沙漠南缘策勒绿洲外围生态学试验场(80°43′45.9″E,37°01′20.7″N),海拔为1340~1380 m,属于暖温带极端干旱区。年平均风速1.9 m/s,年平均大于8级大风天数为40 d,沙尘暴频繁,年均30 d。年平均气温11.9℃,极端最高气温41.9℃,极端最低气温-23.9℃,植物生长季(4-9月)的平均气温为21.8℃。年均降水量仅35.1 mm,且主要集中在4-9月,年均蒸发量高达2595.3 mm,无霜期平均约为209 d。策勒境内有9条季节性河流,均属于降雨、积雪融水和冰川融水综合补给性河流,年径流总量为5.85亿m3,约68.6%左右集中在夏季(6-8月)。该区域地下水位约在16 m,因此,策勒绿洲前缘植被的生长过程中水资源补给主要依赖于夏季洪水灌溉。绿洲外围植被稀少,以骆驼刺(Alhagi sparsifolia)群落为主,并伴生有少量的柽柳(Tamarix ramosissima)和花花柴 (Karelinia caspica)。
1.2 试验设计
实验材料为网状沙拐枣、心形沙拐枣和红皮沙拐枣的1年生幼苗,均由吐鲁番沙漠植物园提供。2011年4月10日将幼苗移至策勒绿洲外围的生态学试验场,定植于高40 cm、上口径35 cm、下口径20 cm的塑料盆中。盆底开3个直径1 cm的圆形小孔,小孔上盖2层0.25 mm纱网。每盆装土28 kg,植苗1株,每种植物50盆。供试土壤采自绿洲外围荒漠区0~60 cm土层。土壤p H为8.3,有机质含量为2.18 g/kg,全量氮、磷、钾含量平均值分别为0.17,0.49,14.6 g/kg,速效氮、速效磷、速效钾含量相应为17.6,1.7,145.7 mg/kg。
幼苗种植后保持土壤湿润,经过1个月的适应生长后,每个植物种选取生长良好、大小相对一致的幼苗,进行水分处理。设置3个灌水梯度,即干旱处理:单株灌水1.9 kg/(株·次)(W1)、中等灌溉3.2 kg/(株·次)(W2)、充分灌溉4.6 kg/(株·次)(W3),可使土壤水分含量分别达到田间持水量(18%)的35%(W1)、60%(W2)和85%(W3)。每个处理12个重复。
据观察,在0~10 cm土层变干时,干旱(W1)处理的沙拐枣同化枝出现脱落,因此灌水周期主要依此来确定。总体来看,灌水周期为5-6月间隔12 d灌溉1次,6-7月间隔5 d灌溉1次。7-8月为沙拐枣生长的旺季,也是植物经历高温、干旱考验的关键期,因此生理指标的测定在该时期进行。7月底进行最后1次水分处理后,停止灌水,干旱胁迫10 d,然后复水3 d(每天适当供水以保证表层土壤湿润)。分别于干旱胁迫处理的第10天、复水后第4天进行生理指标测定。
1.3 测定指标与方法
每个处理选取长势一致的幼苗4株,并做标记。采集不同方位的成熟同化小枝,同株混合后用湿布擦去浮尘,再用吸水纸擦干,放入冰盒备用。
1.3.1 相对含水量 相对含水量采用烘干称重法测定[14]。用分析天平称得同化枝鲜重,在暗中浸入蒸馏水8 h后,取出用吸水纸擦干表面水分,称得饱和鲜重,将称重后的样品装入牛皮信封中,放入烘箱,在105℃下杀青1 h,65℃烘至恒重,用万分之一天平称其干重。

1.3.2 水势 水势测定参见刘爱荣等[15],早上8:00采集同化枝,用自封袋装好后,放入冰盒,迅速带回实验室。将同化枝切成2 mm的小段,铺满WP4-T露点水势仪样品杯底部,后将此样品杯置于WP4-T露点水势仪中测定叶片水势。
1.3.3 叶绿素 叶绿素含量参见舒展等[16],将同化枝切成0.2 mm的小段混匀后,称取0.2 g,置于5 m L丙酮∶乙醇(1∶1)混合溶液的带塞试管中,放于暗处浸提至同化枝脱色完全为止(约24 h),提取液摇匀后比色,根据663,646和470 nm下的吸光值计算叶绿素a、叶绿素b及总叶绿素含量。
1.3.4 丙二醛(MDA)含量 丙二醛采用硫代巴比妥酸法测定[17]。将同化枝切成0.2 mm的小段混匀后,准确称取鲜样0.2 g,加入2 m L 10%三氯乙酸研磨成匀浆,再加3 m L 10%三氯乙酸进行洗涤,合并匀浆液后离心(4000 r/min,10 min),取上清液2 m L,加0.67%硫代巴比妥酸2 m L,混合后,沸水浴中煮30 min,再次离心后在450,532和600 nm下比色,根据吸光值计算出MDA含量。
1.3.5 脯氨酸含量 脯氨酸含量测定参见李合生等[17]。将同化枝切成0.2 mm的小段混匀后,准确称取鲜样0.2 g,放入干净的大试管中,加入5 m L 3%的磺基水杨酸,在沸水浴煮10 min,过滤后,吸取滤液2 m L,采用茚三酮比色法测定。显色后在520 nm下比色。根据标准曲线计算脯氨酸含量。
1.3.6 可溶性糖含量 可溶性糖含量测定参见李合生等[17]。将同化枝切成0.2 mm的小段混匀后,准确称取鲜样0.25 g,放入干净的刻度试管中,加水10 m L,封口后,在沸水浴中提取1 h。冷却后,反复漂洗过滤至25 m L容量瓶中,吸取0.5 m L滤液,加1.5 m L蒸馏水,采用苯酚比色法测定,在485 nm下比色,根据标准曲线计算可溶性糖含量。
1.3.7 根冠比 2次生理指标测定完毕后,进行生物量测定。将标记植株地上和地下部分开,在75℃烘至恒重后称量,根系和地上部分干重比值即为根冠比。
1.4 抗旱性综合评价
根据干旱胁迫后测定的各项生理生化指标和根冠比,采用隶属函数法进行抗旱性综合评价[5]。利用下列公式对各项测定指标进行标准化处理,最后把每份材料的各项指标隶属函数值进行累加,求平均值,平均值越大,表示抗旱性越强。

式中,Ru为隶属函数值,X为各材料某一指标测定值变化率,Xmin为该指标的最小变化率,Xmax为该指标的最大变化率。如果某一指标测定值变化率越高越好用公式(1)计算,反之,则用公式(2)计算。
1.5 数据处理
采用SPSS 16.0软件进行统计分析,选择单因素方差分析(one-way ANOVA)进行不同处理间差异显著性检验。
2 结果与分析
2.1 干旱胁迫和复水条件下同化枝相对含水量变化
干旱处理后,同化枝相对含水量在所有处理下均为红皮沙拐枣最高,网状和心形沙拐枣差异则不显著(图1)。对同种植物而言,增加灌溉量对网状和红皮沙拐枣的相对含水量有显著促进作用,心形沙拐枣仅在W3处理下有显著提升。
复水后,在 W1和 W3处理红皮沙拐枣的相对含水量均最高,在W2处理下红皮与心形沙拐枣差异不显著,显著低于网状沙拐枣。W1至W3处理下网状沙拐枣相对含水量分别增加了7.80%,8.28%和8.94%,心形沙拐枣相应增加了11.05%,6.03%和4.09%,红皮沙拐枣则分别为10.24%,-2.32%和3.76%。
2.2 干旱胁迫和复水条件下同化枝水势变化
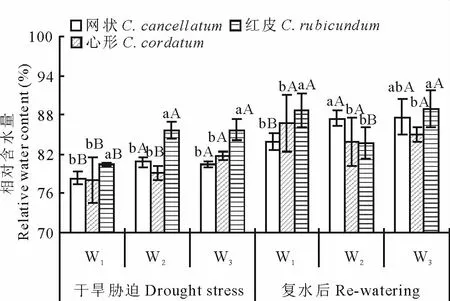
图1 干旱胁迫和复水对同化枝相对含水量的影响Fig.1 Effect of drought stress and re-watering on the relative water content of assimilating branches不同小写字母表示相同处理下种间差异显著(P<0.05),不同大写字母表示同种植物在不同处理下差异显著(P<0.05)。下同。Different small letters under the same treatment meant significant difference among species at 0.05 level,and different capital letters for the same species meant significant difference among treatments at 0.05 level.The same below.
干旱处理后,同化枝水势在相同处理下均为红皮沙拐枣最高,但在W1处理和网状沙拐枣差异不显著,在W3处理和心形沙拐枣差异也不显著(图2)。同种植物不同处理相比较,在W2处理下网状和红皮沙拐枣水势均显著高于其他处理,心形沙拐枣则在W3处理达到最高。
复水后,网状沙拐枣水势增加最为显著,W1至W3处理分别增加了50.3%,41.7%和55.3%,且显著高于其他植物种;其次是红皮沙拐枣,相应增加比例为22.1%,16.3%和27.3%;心形沙拐枣增加最慢,W1至 W3分别增加8.26%,16.40%和6.06%,且显著低于其他植物种。
2.3 干旱胁迫和复水条件下叶绿素含量变化
干旱处理后,在W1和W3处理下网状与红皮沙拐枣叶绿素含量差异不显著,显著高于心形沙拐枣;W2处理下红皮沙拐枣显著最高,其次为网状沙拐枣,心形沙拐枣最低(图3)。同种植物不同处理比较发现,在灌溉量增加到W2处理时网状沙拐枣叶绿素含量显著降低,红皮沙拐枣叶绿素含量显著提高,二者在W1和W3处理下差异均不显著。心形沙拐枣叶绿素含量受前期灌溉量影响不显著。
复水后,心形沙拐枣种叶绿素含量仍最低,网状沙拐枣最高。和复水前相比,W1和W2处理下网状沙拐枣叶绿素含量分别增加了6.80%和8.73%,W3处理却降低了11.50%;心形沙拐枣分别增加了5.06%,8.44%和17.20%;红皮沙拐枣却分别降低了9.27%,34.08%和2.52%。

图2 干旱胁迫和复水对同化枝水势的影响Fig.2 Effect of drought stress and re-watering on water potential of assimilating branches

图3 干旱胁迫和复水处理对同化枝叶绿素含量的影响Fig.3 Effect of drought stress and re-watering on chlorophyll content of assimilating branches
2.4 干旱胁迫和复水条件下MDA含量变化
干旱处理后,红皮沙拐枣MDA含量在W1和W2处理下均显著低于其他植物种,在W3处理却显著高于其他种(图4)。网状和心形沙拐枣的MDA含量在W1和W3处理下差异均不显著,但在W2处理下差异显著。同种植物不同处理比较发现,增加灌溉量有显著降低心形沙拐枣MDA含量的趋势,网状沙拐枣仅在W3处理下有显著降低,红皮沙拐枣却在该处理下有显著增加。
复水后,在W1和W2处理下网状沙拐枣MDA含量均显著高于其他植物种,在W3处理却显著低于其他种,心形和红皮沙拐枣差异却不显著。和复水前相比网状沙拐枣MDA含量分别降低了10.7%,19.4%和18.4%,心形沙拐枣也相应降低了33.3%,25.1%和1.35%,红皮沙拐枣在 W1和 W3处理下分别降低了3.57%和23.8%,但在W2处理下却增加了0.65%。
2.5 干旱胁迫和复水条件下渗透调节能力变化
干旱处理后,网状沙拐枣具有较高的可溶性糖含量,但在W1和W3处理下和心形沙拐枣差异不显著(图5)。红皮沙拐枣可溶性糖含量最低,在W1和W2处理下和心形沙拐枣差异也不显著。同种植物不同处理相比较发现,在灌溉量增加到W2处理时心形和红皮沙拐枣的可溶性糖含量均显著下降,网状沙拐枣在W3处理时才有显著降低。
复水后,心形沙拐枣可溶性糖含量在W1和W2处理下显著低于其他种,在W3处理下也显著较低,但与红皮沙拐枣差异不显著。和复水前相比,W1和W2处理下网状沙拐枣可溶性糖含量分别降低了7.39%和5.27%,W3处理却增加了6.84%;心形沙拐枣则相应降低了17.8%,14.6% 和27.3%;红皮沙拐枣在 W1和W3处理下分别降低了7.48%和25.70%,W2处理下却增加了5.90%。
干旱处理后,在W1处理下心形沙拐枣脯氨酸含量最高,网状沙拐枣最低;在W2和W3处理下均是网状沙拐枣含量最高,但与心形沙拐枣差异不显著,红皮沙拐枣最低(图6)。同种植物不同处理相比较,增加灌溉量有显著降低心形和红皮沙拐枣脯氨酸含量的趋势,网状沙拐枣在W2处理下却显著增加。复水后,在W1和W2处理下3个沙拐枣种脯氨酸含量差异均不显著,在W3处理下网状沙拐枣显著高于其他种。和复水前相比,W1至W3处理网状沙拐枣脯氨酸含量分别降低了50.2%,72.5%和52.4%;心形沙拐枣相应降低了65.4%,74.5%和72.4%;红皮沙拐枣也分别降低了67.0%,71.2%和73.1%。
2.6 不同水分条件下3个植物种的根冠比差异
由图7可以看出,3个灌溉条件下均是心形沙拐枣根冠比最高,且显著高于其他植物种。在W1和W3处理下均是网状沙拐枣根冠比最低,但在W2处理下则为红皮沙拐枣最低。网状和心形沙拐枣根冠比受灌溉量影响不显著,平均分别为0.84和1.29。红皮沙拐枣根冠比在W2处理下显著低于其他处理,平均为0.85。

图4 干旱胁迫和复水处理对同化枝丙二醛含量的影响Fig.4 Effect of drought stress and re-watering on MDA content of assimilating branches

图5 干旱胁迫和复水处理对沙拐枣可溶性糖含量的影响Fig.5 Effect of drought stress and re-watering on soluble sugar content of assimilating branches

图6 干旱胁迫和复水处理对同化枝脯氨酸含量的影响Fig.6 Effect of drought stress and re-watering on proline content of assimilating branches
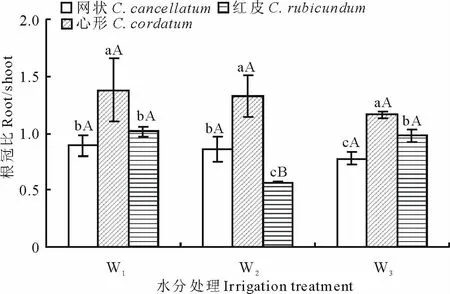
图7 不同灌水处理下3个沙拐枣种的根冠比差异Fig.7 The difference of root/shoot under different irrigation treatments
2.7 抗旱性评价
选取干旱胁迫后上述7个测定指标,采用隶属函数法进行植物抗旱性综合评价,评价结果见表1。网状、心形和红皮沙拐枣综合评价值分别为0.48,0.42和0.55,因此,3个植物种抗旱性综合评价结果为红皮>网状>心形沙拐枣。
3 讨论
相对含水量和水势常被用来反映植物受干旱胁迫的程度,确定植物抗旱能力的高低。有研究表明,在干旱胁迫下,抗旱性强的植物能够维持较高的叶片相对含水量和水势,复水后二者又能较快地恢复到正常水平[18-19]。本研究发现,持续干旱处理后,红皮沙拐枣的相对含水量和水势均最高,干旱和中等灌溉量下尤为显著。复水后,3个植物种水势变化速率显著高于相对含水量,其中网状沙拐枣的水势增加最为显著。这表明在干旱条件下红皮沙拐枣的细胞持水能力最强,水分胁迫程度最低,在复水后水分状况恢复较慢可能是因为其在胁迫条件下同化枝水势较高有关。
叶绿素是植物光合作用的基础,干旱胁迫下可在一定程度上反映植物光合作用的变化规律,对植物的耐旱性有一定的指示作用[7,20]。大多研究认为在水分胁迫下叶绿素含量会降低[21-22],但也有研究发现持续干旱胁迫后叶绿素含量出现增加,复水后则又降低[18,23]。本研究表明,干旱胁迫下红皮沙拐枣叶绿素含量相对较高,但在最高和最低灌溉量下与网状沙拐枣差异不显著,心形沙拐枣最低。复水后,心形和网状沙拐枣均有所增加,红皮沙拐枣则出现降低。这表明干旱胁迫下红皮沙拐枣具有相对较高的光合作用潜力,在逆境胁迫解除后却有下降趋势。这可能是由于干旱胁迫对红皮沙拐枣的叶绿素合成存在着显著补偿和超补偿效应[24];复水后由于同化枝含水量较高,其扩展生长的补偿效应可能强于叶绿素合成,产生稀释效应致使叶绿素含量降低[25]。

表1 3个沙拐枣种抗旱性评价Table 1 Drought resistant comprehensive evaluation of 3 Calligonum
环境胁迫往往会造成植物体内活性氧的大量积累,生成具有强氧化性的脂质过氧化物和各种小分子的降解物,其中以MDA浓度增高最为显著[3],因此,MDA是检测植物膜伤害程度的一个重要指标[26]。本研究表明,在严重和中等干旱胁迫下,网状沙拐枣质膜损害最严重,红皮沙拐枣最轻;但在复水后心形沙拐枣修复最快,红皮沙拐枣最慢。轻度胁迫条件下红皮沙拐枣质膜受伤害最严重,网状沙拐枣最轻;复水后红皮沙拐枣修复最快,心形沙拐枣最慢。这表明干旱胁迫下红皮沙拐枣的膜稳定性较强,即使质膜损伤严重,在胁迫解除后也可快速修复,这也可能是其对干旱逆境的一种重要的适应机制。
干旱胁迫下,植物体内会主动积累一些渗透调节物质,如脯氨酸和可溶性糖等,以降低植物细胞内的渗透势,提高抗旱性[27]。通常认为,抗旱性强的植物可溶性糖和脯氨酸含量也较高[28-29]。本研究表明,在严重干旱胁迫下3个沙拐枣种均有大量的可溶性糖累积,心形和红皮沙拐枣的脯氨酸含量也显著较高。在中等和轻度干旱胁迫下,3个沙拐枣种的脯氨酸和可溶性糖含量均有降低趋势,其中红皮沙拐枣含量最低,网状沙拐枣相对较高。这表明3个沙拐枣种都具有通过渗透调节抵御和适应干旱胁迫的特点,种间渗透调节物质累积差异显著受到干旱胁迫程度影响,因此不能单纯根据可溶性糖和脯氨酸含量高低来确定种间抗旱性差异[30-31]。复水后,3个沙拐枣种脯氨酸含量均显著下降,降低幅度显著高于可溶性糖,其中心形和红皮沙拐枣降低幅度更大,表明二者的渗透调节能力要强于网状沙拐枣。
根冠比发生变化是植物适应干旱的重要机制之一。大多研究表明,根冠比随干旱胁迫程度增加而增加[32],和植物抗旱性呈正相关[5,33],较高的根冠比可提高植物的抗旱性和耐瘠薄能力[34]。本研究表明,心形沙拐枣根冠比显著高于其他种,网状沙拐枣除中等灌溉处理外均最低,且二者受灌溉量影响较小。这与不同生理指标的种间差异显著不一致,因此也不能由此来推断种间抗旱性强弱。水分条件对同种植物根冠比影响与前人研究结果也不一致,主要原因可能是植物在所有处理下均经历了多个干湿交替过程,这对不同处理下植物根系生长可能均有一定的促进作用,致使处理间根冠比变化较小。
综上所述,干旱胁迫下3个沙拐枣种根冠比与生理指标的变化趋势并不完全一致,即使同种植物的各项生理生态指标在干旱胁迫下表现也不完全一致,因此,单独以某一指标来评价植物种间抗旱性差异会存在一定误差,应采用多项指标来进行综合定量分析,才能客观地评价植物的抗旱性。采用多指标隶属函数法对3个植物种抗旱性进行综合评价,评价结果为红皮>网状>心形沙拐枣,这与田间生长实际观测情况一致。这表明在极端干旱贫瘠的荒漠环境中,红皮沙拐枣的耐受能力和适应能力显著优于其他种,可作为干旱区防护林建设的优选植物种。
