自然种群淡色库蚊钠通道基因全长的克隆及序列分析*
2014-11-10赵明惠董言德郭晓霞张映梅吴治明李春晓赵彤言1
赵明惠 冉 鑫 董言德 郭晓霞 张映梅 邢 丹 吴治明 李春晓** 赵彤言1,**
(1.安徽医科大学,合肥 230032;2.军事医学科学院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071; 3.贵阳医学院,贵阳 550004)
淡色库蚊Culexpipienspallens属于尖音库蚊复合组Culexpipienscomplex(赵彤言和陆宝麟,1994),是我国主要的家栖蚊种,而且是丝虫病和乙型脑炎的重要媒介,因此是城市卫生杀虫剂防控的主要对象(何建国等,2011;张金光和霍新北,2011)。但是由于杀虫剂的长期、大量应用,已经导致该蚊虫抗药性的持续发生(Sarkaretal.,2009;刘斯璐等,2011;孟凤霞等,2011),蚊虫抗药性的产生不仅使城市蚊虫控制面临更大的挑战,同时也对公众健康产生更大的威胁。
蚊虫产生抗药性的机制有多个方面,其中,钠通道基因位点的突变是抗性分子机制之一(唐振华,2000)。昆虫神经细胞膜上钠离子通道是拟除虫菊酯类杀虫剂的作用靶标,通过控制钠通道的失活而使昆虫出现兴奋状态或中毒症状。昆虫由于钠通道基因的突变对该类杀虫剂产生抗药性,即击倒抗性 (knockdown resistance,kdr) (Salgadoetal.,1983)。目前,国内外学者对kdr进行了深入的研究,但大多数的研究基本仅限于通道ⅡS4~ⅡS6片段(宋锋林等,2005;Garciaetal.,2009;Kawadaetal.,2011;Xuetal.,2011;Singhetal.,2011;刘宏美等,2012;Tanetal.,2012;郑重等,2012),而对这一区段之外的大部分钠通道基因研究报道的相对较少。特别是淡色库蚊,由于其孳生环境的特殊性,已经发现其对拟除虫菊酯类杀虫剂高达几百倍甚至上千倍的抗性。如果只对钠通道ⅡS4~ⅡS6片段进行研究,已经不能很好的解释产生如此高倍数抗性的原因。因此,需要对钠通道ⅡS4~ⅡS6片段外的大部分基因区段进行全面的检测,以期发现对抗性水平具有直接作用的新位点突变,来更好解释高倍抗性的来源。本文的目的在于建立一种淡色库蚊野外种群钠通道基因全长的分子克隆方法,分析野外种群钠通道基因的变异,为蚊虫抗性的综合治理提供新的靶标。
1 材料与方法
1.1 蚊虫的采集
本实验所采用的蚊虫标本为野外采集的河北株淡色库蚊,采集地点为河北省邯郸市成安县(N36°26′33.41″,E114°41′4.04″),采集时间是2012年8月。采集方法:幼虫勺舀法,采集到幼虫并饲养,羽化3~5 d后收集成雌蚊,用液氮冻存。
1.2 主要试剂
吉百特生物技术有限公司的RNA提取试剂盒(Trizol、漂洗液);TaKaRa公司的DEPC原液和逆转录试剂盒;北京全式金生物技术有限公司的Taq 酶套餐,pEASY-T1载体,Trans1-T1感受态细胞和DNA Marker DL2000;TIANGEN公司的琼脂糖凝胶回收试剂盒,LB培养基,溴化乙锭(EB),氨苄青霉素、X-gal、IPTG;INVITROGEN公司的琼脂糖;北京鼎国昌盛生物技术有限公司的50×TAE电泳缓冲液。其他试剂为国产分析纯。
1.3 引物设计
根据GenBank公布的致倦库蚊钠通道基因序列(GenBank登录号:AB453977.1),在NCBI-Primer-BLAST里设计引物,引物由生工生物工程股份有限公司合成,引物序列见表1。

表1 扩增钠通道的六对引物序列及片段大小Tab.1 Six pairs of primers for amplifying sodium channel gene
1.4 蚊虫基因组RNA的提取
取单只蚊虫放入1.5 mL离心管,加入200 μL Trizol试剂,离心研磨后加入800 μL Trizol,静置10 min。加入200 μL氯仿,震荡后静置5 min。15 ℃,12 000 r/min离心15 min,取上清到离心柱中,12 000 r/min离心1 min,弃滤液(分两次取上清)。向离心柱中加入500 μL漂洗液,12 000 r/min离心1 min,弃滤液,再空转2 min,风干2 min。将离心柱放入到干净的1.5 mL离心管中,加入20μL DEPC水,静置3 min,12 000 r/min离心1 min,滤液即为RNA提取液,保存于-70 ℃备用。
1.5 逆转录与PCR扩增
逆转录应体系如下:氯化镁 2μL,10×RT 缓冲液1 μL,灭菌水3.75 μL,dNTP 混合液1 μL,RNA酶抑制剂0.25μL,AMV 逆转录酶0.5 μL,自由引物0.5 μL。加入1 μL模板之后进行反应。反应条件如下:30 ℃,10 min,45 ℃,30 min,95 ℃,5 min,5 ℃,5 min,4 ℃,保存。反应液保存于-20 ℃备用。PCR 50 μL反应体系如下:Taq酶25 μL,灭菌水 18 μL,引物各1 μL,模板5 μL。反应条件如下:预变性94 ℃,5 min;变性94 ℃,30 s,退火58/60/62/65 ℃,30 s,延伸72 ℃,1 min,循环35次;之后72 ℃,7 min,4℃保存。
1.6 PCR产物的回收与克隆
使用TIANGEN公司的回收试剂盒对PCR产物进行纯化、回收。回收产物与pEASY-T1载体连接,转入Trans1-T1感受态细胞培养,菌液涂LB固体培养基(含氨苄青霉素、X-gal、IPTG)培养过夜。
1.7 重组质粒的筛选与鉴定
采用蓝白斑筛选,挑取白色菌落加入LB液体培养基培养(约4 h)。鉴定选择菌落PCR鉴定法,25 μL PCR反应体系:Taq酶12.5 μL,无菌水 8.5 μL,M13F 0.5 μL,M13R 0.5 μL,菌液3 μL。反应条件如下:预变性94 ℃,10 min;变性94 ℃,30 s,退火55 ℃,30 s,延伸72 ℃,1 min,循环35次;之后72 ℃,10 min,4℃保存。琼脂糖凝胶电泳检测阳性克隆并送生工生物工程股份有限公司测序。
1.8 序列分析
采用DNAStar软件和CLC Genomics Workbench1.3 软件对测序结果进行拼接和对比分析。
2 结果
2.1 PCR扩增与重组子鉴定
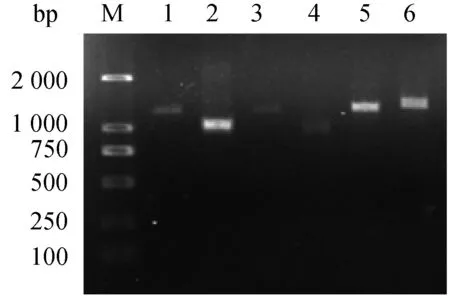
图1 kdr 基因PCR扩增结果Fig.1 The six target fragments of kdrM:Marker;1:引物K1;2:引物K2;3:引物K3;4:引物K4;5:引物K5;6:引物K6。M: Marker; 1: Primer K1; 2: Primer K2; 3: Primer K3; 4: Primer K4; 5: Primer K5; 6: Primer K6.

图2 重组子的PCR鉴定结果Fig.2 The identification of recombinant plasmidsM:Marker;1:空组质粒;2~9:重组质粒。M: Marker; 1: Vector plasmid; 2-9: Recombinant plasmids.
利用设计的6对引物,成功克隆出野外株淡色库蚊kdr基因全长,扩增电泳结果显示,在Marker的1 kb附近有6条特异性的条带,条带大小与表1设计相符(图1)。重组质粒的PCR鉴定结果显示,在1 kb附近有一条特异性的条带,与设计相符(图2)。
2.2 序列分析结果
采用DNAStar软件对测序结果进行分析,与GenBank公布的钠通道基因序列能够吻合上,说明我们成功得到了野外种群淡色库蚊的钠通道基因全长,GenBank登录号是KC977455。通过对比分析,我们发现了野外种群淡色库蚊钠通道基因上都存在多处氨基酸突变和可变剪接(图3)。这些突变包括A32T、T336A、S342P、K535E、L1035F、N1595S和F1982L。其中,发现的L1035F突变与经典的kdr突变L1014F是同一种突变,只是在不同种群中编码位置不同。另外,发现钠离子通道中存在不同形式的可变剪接。
3 讨论
本研究以重要媒介蚊虫淡色库蚊为材料,利用RT-PCR技术,克隆出野外种群淡色库蚊钠通道基因全长。
通过序列对比分析,发现在淡色库蚊野外种群蚊虫的钠通道上存在多处氨基酸突变和可变剪接。Loughney等(1989)首次从果蝇Drosophilamelanogaster中分离克隆了钠离子通道基因,并通过实验证明了钠离子通道基因的突变可能改变其功能,从而导致昆虫对菊酯类农药产生抗性。昆虫通过钠通道基因的突变对该类杀虫剂产生抗性,称为击倒抗性(kdr)。击倒抗性最初是在对DDT具有抗性的意大利品系家蝇Housefly中首次被描述(Busvine,1951)。之后,在多种昆虫中也发现这样的基因突变。经过多年研究发现,昆虫钠通道ⅡS6节段L1014位点是一个较保守的突变位点,经典突变类型L1014F普遍见于各种昆虫例如,德国小蠊German Cockroach此位点的突变与DDT、氯菊酯和胺菊酯抗性有关(Dong,1997),棉蚜虫Aphisgossypii此位点的突变与高效氯氟氰菊酯抗性密切相关(Marshalletal.,2012)、烟蚜Myzuspersicae此位点的突变可以导致对溴氰菊酯和DDT抗性的增加(Martinez-Torresetal.,1999)。此外,在蚊虫中,也发现此位点的突变与抗性密切相关。例如,冈比亚按蚊Anophelegambiae、斯氏按蚊An.stephensi、阿拉伯按蚊An.arabiensis位点突变与溴氰菊酯、氯菊酯和DDT抗性有关(Yewhalawetal.,2011)。本研究也发现野外株淡色库蚊中存在L1014F(L1035F)的突变。此突变的产生与发展也许与当地杀虫剂的使用密切相关。另外,在野外株淡色库蚊钠离子通道基因上还发现其他位点的几个突变,例如,A32T、T336A、S342P、K535E、N1595S和F1982L。这些突变与Rinkevich(2013)总结的昆虫钠离子通道基因出现的基因突变不尽相同,其与抗性的关系也有待进一步研究。

图3 野外淡色库蚊(HD)与NCBI公布的致倦库蚊(MB)钠通道氨基酸序列的比较Fig.3 Sequences of deduced amino acids of sodium channel from Culex pipiens pallens(HD),aligned with those Culex pipiens quinquefasciatus(NCBI number:AB453977.1).不同氨基酸用不同颜色表示,logo代表对比后氨基酸异同,-代表可变剪接,方框位置是L1014位点。Different colors indicate different amino acids,logo is the difference after alignment,-indicates alternative splicing and the pane location is the L1014 locus.
mRNA的可变剪接反映了遗传信息的动态变化与遗传信息在更高层次的重新组合,在不改变基因组DNA的前提下,使编码序列的丰富度大大提高,是一种高效的蛋白形成方式(Blencoweetal.,2006)。He等(2012)在研究钠通道基因的可变剪接时,发现了致倦库蚊13个不同的钠通道剪接本,并证明这些可变剪接与拟除虫菊酯抗性有一定的关系。本研究也发现了多处可变剪接,这些可变剪接在丰富钠通道蛋白多样性方面也许会有一定的意义,但与拟除虫菊酯的抗性关系有待进一步研究。其中有一处是新发现的可变剪接,这段序列有63 bp,作为插入序列出现在模板序列(AB453977.1)的第5 490和5 491位碱基之间,GenBank里没有该序列的报道。该序列中包含两个终止密码,具体的生理功能有待研究。
目前对蚊虫击倒抗性的研究,主要集中于钠通道基因的ⅡS4~ⅡS6节段,而对该基因其他节段的认识并不十分清楚,研究的也相对来说较少。近年来,蚊虫抗药性的不断增强,人们也放眼于钠通道ⅡS4~ⅡS6片段之外的大部分基因片段,以期找寻其他与抗性关系密切的新突变。对蚊虫钠通道点突变的研究对于理解蚊虫抗药机理有重要的意义,也为新型杀虫剂的研究提供了理论基础,为蚊虫防治提供了新的思路。对钠通道基因点突变的研究必须基于通道基因序列的获得,本研究成功克隆出了野外种群淡色库蚊钠通道基因全长,并且分析了钠离子通道上存在的变异,发现了与抗药性关系密切的L1014F突变。这一方法的建立将有助于各研究学者得到需要研究的目的片段,为抗性相关突变的寻找奠定了基础。
