七叶皂苷钠通过抑制Akt和ERK信号通路诱导HeLa细胞凋亡及对死亡受体表达的影响*
2014-05-16齐世美戚之琳凌烈锋吕俊章尧
齐世美,戚之琳,凌烈锋,吕俊,章尧
(皖南医学院生物化学教研室,安徽芜湖 241002)
七叶皂苷钠通过抑制Akt和ERK信号通路诱导HeLa细胞凋亡及对死亡受体表达的影响*
齐世美,戚之琳,凌烈锋,吕俊,章尧△
(皖南医学院生物化学教研室,安徽芜湖 241002)
目的:探讨七叶皂苷钠诱导宫颈癌HeLa细胞凋亡的作用及其分子机制。方法:采用MTT法检测七叶皂苷钠对宫颈癌HeLa细胞的生长和增殖抑制作用;倒置显微镜观察细胞形态改变;利用annexin V-FITC/PI流式细胞术检测细胞凋亡率;采用DAPI单染法荧光显微镜下观察细胞核变化情况;利用Western blotting检测凋亡相关蛋白[聚(ADP-核糖)聚合酶(PARP)、cleaved caspase-8、cleaved caspase-9、pro-caspase-3]和细胞存活相关信号通路(Akt、ERK)以及TRAIL受体(DR4、DR5)的变化情况。结果:七叶皂苷钠以剂量依赖的方式显著抑制宫颈癌HeLa细胞的生长和增殖;七叶皂苷钠作用于HeLa细胞后,可见典型的凋亡细胞形态学特征,细胞凋亡率显著增加;随着七叶皂苷钠浓度升高,cleaved PARP、cleaved caspase-8和cleaved caspase-9明显增多,pro-caspase-3显著减少,p-Akt和p-ERK激活减少,细胞内DR4和DR5总蛋白水平上调。结论:七叶皂苷钠通过抑制细胞存活相关信号通路,上调死亡受体水平,抑制细胞增殖,促进细胞凋亡。
七叶皂苷钠;宫颈肿瘤;细胞凋亡;死亡受体;Akt通路;ERK通路
七叶皂苷钠(sodium aescinate,SA)是从七叶树科植物天师栗的干燥成熟果实娑罗子中提取得到的三萜皂苷钠盐,临床主要用于治疗脑水肿以及创伤引起的肢体炎症肿胀。近年来的研究显示,七叶皂苷具有显著的抗炎[1]、提高缺血脑组织超氧化物歧化酶(superoxide dismutase,SOD)活性[2]、抑制血管新生[3-5]、抑制胰脂肪酶活性[6]等作用。已有文献报道,七叶皂苷可以抑制人类慢性髓细胞样白血病K562细胞[7]和急性T细胞白血病Jurkat细胞[8]的增殖,另外能够明显增强5-氟尿嘧啶等抗肿瘤药物的杀伤作用[9]。但是关于七叶皂苷钠对宫颈癌的抗肿瘤效果还未见文献报道,它发挥抗肿瘤作用的具体分子机制和生物标靶尚未阐明。本研究以宫颈癌HeLa细胞株为研究模型,探讨七叶皂苷钠对死亡受体水平的调控作用,检测它对细胞增殖和凋亡信号通路的影响,试图阐明其发挥抗肿瘤作用的关键节点,为制定七叶皂苷钠的临床治疗方案和拓展七叶皂苷钠的临床用药范围提供有价值的实验和理论依据。
材料和方法
1 材料
人宫颈癌HeLa细胞株由本实验室保存。七叶皂苷钠购自上海阿拉丁试剂公司;DMEM完全培养液和胎牛血清购自HyClone;MTT和DAPI购自Sigma;Annexin V-FITC/PI试剂盒购自BD;聚(ADP-核糖)聚合酶[poly(ADP-ribose)polymerase,PARP]、pro-caspase-3、cleavedcaspase-8、phospho-p42/44 MAPK(Thr202/Tyr204)、phospho-Akt(Ser473)、DR4、DR5和β-actin抗体购自Cell Signaling Technology; GAPDH单克隆抗体购自Bioword;IRDye800荧光标记Ⅱ抗购自Odessey。
2 主要方法
2.1 细胞培养HeLa细胞株在37℃、5%CO2条件下,用含10%胎牛血清和抗生素(1×105U/L青霉素和100 mg/L链霉素)的DMEM完全培养液培养,取对数生长期细胞进行实验。
2.2 MTT法检测细胞存活率HeLa细胞提前24 h接种于96孔板,每孔细胞密度大约5×104,细胞分为空白对照组、溶剂对照组和实验组。空白对照组细胞常规培养,不做任何处理,溶剂对照组加入DMSO,实验组加入七叶皂苷钠,使其终浓度分别为5 mg/L、10 mg/L、20 mg/L、40 mg/L、60 mg/L、80 mg/L 和100 mg/L,每组设5个重复孔,同时设置空白调零孔。各组细胞继续培养36 h后,将培养液吸尽,加入5 g/L MTT 20 μL,培养4 h后加入150 μL DMSO溶解,酶标仪检测570 nm波长处的吸光度(A),细胞存活率(%)=(实验组A-空白调零孔A)/(A空白对照组×100%-空白调零孔A)×100%。
2.3 细胞形态学观察提前24 h把对数生长期细胞接种于6孔板,密度约2×108/L。将细胞分为空白对照组、溶剂对照组和实验组,实验组七叶皂苷钠为10 mg/L、20 mg/L和40 mg/L。加药24 h后于倒置显微镜下观察、拍照(×200)。
2.4 DAPI染色检测细胞核形态变化细胞处理同2.3,用PBS洗3次后,避光DAPI(1 mg/L)染色3 min,再用PBS避光洗3次。染好色的细胞在荧光显微镜下观测并拍照分析。
2.5 Annexin V-FITC/PI检测细胞凋亡率分组处理细胞,0.25%胰酶消化,800 r/min离心收集细胞样品,冷PBS洗2次,按Annexin V-FITC/PI试剂盒说明书处理细胞样品,即用含Annexin V-FITC 5 μL和PI 5 μL的标记液重悬细胞后,避光室温孵育15 min,加入1×Binding Buffer 400 μL。流式细胞仪检测和数据分析,每次计数1×104个细胞。
2.6 免疫印迹法各组细胞处理后,用预冷的PBS漂洗2次,加入预冷的细胞裂解液在冰上孵育30 min,收集细胞裂解物,4℃、15 000×g离心15 min,收取离心上清液。用紫外分光光度法测定样品蛋白浓度。加入上样缓冲液煮沸5 min,按蛋白含量测定结果上等量样品,进行SDS-PAGE(10%或12%)并转移至NC膜上。再将膜置于5%脱脂奶粉的TBS封闭液中封闭1 h,加入Ⅰ抗4℃孵育过夜,荧光标记Ⅱ抗室温孵育1 h,用Odyssey红外双色激光成像系统扫描并计算信号条带荧光值。
3 统计学处理
用SPSS 13.0软件处理,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1 七叶皂苷钠对HeLa细胞存活率及细胞形态学的影响
未经处理的HeLa细胞多呈铺路石状,细胞轮廓清晰;用10 mg/L七叶皂苷钠处理细胞24 h后,部分细胞边缘收缩,与邻近细胞分离、脱壁;40 mg/L组发生明显的凋亡现象,细胞出现空泡、破碎,见图1。MTT结果显示七叶皂苷钠可以显著降低HeLa细胞的存活率,且七叶皂苷钠对细胞增殖的抑制作用呈剂量依赖性,见图2。

Figure 1.Morphology of HeLa cells after sodium aescinate(SA)treatment.图1 七叶皂苷钠对细胞形态学变化的影响

Figure 2.Sodium aescinate(SA)inhibited the viability of HeLa cells.Mean±SD.n=5.*P<0.05,**P<0.01 vs control.图2 七叶皂苷钠对HeLa细胞存活率的影响
2 七叶皂苷钠对HeLa细胞核形态的影响
空白对照组中细胞核外观为不规则椭圆形,染色均匀,呈浅蓝色。用不同浓度七叶皂苷钠处理后,细胞核大小不均,染色加深,视野中可见新月形或大小不等的圆形小体,即核小体,见图3。
3 七叶皂苷钠对细胞凋亡率的影响
Annexin V-FITC/PI结果显示,七叶皂苷钠低浓度组就能引起HeLa细胞凋亡,中浓度组和高浓度组HeLa细胞凋亡率显著增高,呈量-效关系,见图4。
4 七叶皂苷钠对细胞凋亡相关蛋白的影响
Western blotting结果显示,空白对照组和溶剂对照组的凋亡相关蛋白没有明显变化,但随着七叶皂苷钠作用浓度的升高,PARP切割显著增多,cleaved caspase-8和cleaved caspase-9切割带明显增强,procaspase-3前体显著减少,见图5。

Figure 3.Nuclear morphology of HeLa cells after sodium aescinate(SA)treatment.图3 七叶皂苷钠对HeLa细胞核形态的影响

Figure 4.Cell apoptosis induced by sodium aescinate(SA).图4 七叶皂苷钠对细胞凋亡率的影响
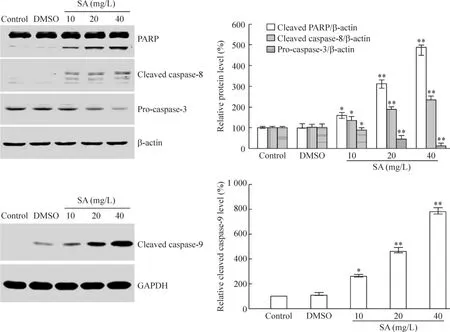
Figure 5.Effects of sodium aescinate(SA)on apoptosis-related proteins.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图5 七叶皂苷钠对细胞凋亡相关蛋白的影响
5 七叶皂苷钠对Akt和ERK信号通路的影响
不同浓度的七叶皂苷钠处理HeLa细胞4 h后,明显抑制了Akt和ERK的活化,p-Akt和p-ERK蛋白表达水平明显减少,见图6。
6 七叶皂苷钠对死亡受体蛋白表达的影响
与空白对照组相比,20 mg/L和40 mg/L七叶皂苷钠能使DR4和DR5的表达明显上调,而10 mg/L组变化不显著,溶剂对照组基本没有变化,见图7。

Figure 6.Sodium aescinate(SA)inhibited the phosphorylation of Akt and ERK.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图6 七叶皂苷钠抑制Akt和ERK的磷酸化

Figure 7.Effects of sodium aescinate(SA)on the expression of TRAIL receptors(DR4 and DR5)in HeLa cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs control.图7 七叶皂苷钠对TRAIL受体(DR4和DR5)表达的影响
讨论
虽然已有文献报道,七叶皂苷钠具有抗肿瘤作用[8-10],但其对宫颈癌HeLa细胞的凋亡诱导作用尚未见报道。我们的实验结果表明,七叶皂苷钠能够显著降低HeLa细胞存活率。经过七叶皂苷钠处理的HeLa细胞,具有典型的凋亡形态学变化特征,包括染色体聚集和细胞核破碎。Annexin V-FITC/PI实验结果表明七叶皂苷钠明显增加HeLa细胞的凋亡率。以上结果证实,七叶皂苷钠能够诱导宫颈癌He-La细胞凋亡,且具有剂量依赖性。
在本研究中,我们首次证实七叶皂苷钠通过外源性死亡受体途径和内源性线粒体途径诱导HeLa细胞凋亡;在细胞凋亡的早期阶段,caspase-8和caspase-9显著激活;死亡受体DR4和DR5总蛋白水平在七叶皂苷钠作用后明显增加。DR4和DR5又称为TRAIL受体1和TRAIL受体2,在其胞浆端含有死亡结构域,通过募集接头蛋白Fas相关死亡结构域蛋白,向细胞内传递凋亡信号[11]。因此,在HeLa细胞表面的DR4和DR5表达增加,可能促进下游caspase-8蛋白的激活。七叶皂苷钠作用HeLa细胞后,线粒体通透性增加,激活caspase-9形成凋亡小体。Caspase-8和caspase-9的活化可进一步引起效应蛋白caspase-3的活化及其底物PARP的切割。
众所周知,多种蛋白激酶途径参与调节细胞增殖和细胞存活。丝裂原活化蛋白激酶家族(mitogenactivated protein kinases,MAPKs),在多种细胞模型中,参与细胞凋亡和细胞周期的调控[12]。MAPKs家族包括3个成员,分别是细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和p38 MAPK。 JNK和p38 MAPK主要发挥诱导细胞凋亡作用,而ERK作为细胞存活调节子,在促进细胞存活和细胞分化中扮演着关键的角色。除了MAPKs家族,另外一个蛋白激酶Akt通过磷酸化与细胞死亡相关的多种因子,保护细胞免受凋亡伤害[12]。我们的实验结果表明,七叶皂苷钠能够阻断ERK和Akt信号途径,在浓度为10 mg/L时ERK和Akt磷酸化水平已经显著下调,在浓度为40 mg/L时可见ERK和Akt磷酸化信号非常弱。因此,七叶皂苷钠促进HeLa细胞凋亡可能与抑制Akt和ERK细胞存活信号通路有关。
综上所述,我们的研究结果证实七叶皂苷钠能够抑制宫颈癌HeLa细胞增殖,促进细胞凋亡,其作用机制与抑制细胞存活信号途径Akt和ERK有关。激活外源性死亡受体途径和内源性线粒体途径也是七叶皂苷钠触发细胞凋亡的重要分子机制。本研究为临床制定宫颈癌预防和治疗策略提供有价值的参考。而且七叶皂苷钠能够明显提高细胞内TRAIL受体DR4和DR5水平,在对TRAIL不敏感的肿瘤的治疗中,能否作为辅助药物增加肿瘤对TRAIL的敏感性,将具有很大的研究前景,也是我们下一步研究的方向。
[1]Fu F,Hou Y,Jiang W,et al.Escin:inhibiting inflammation and promoting gastrointestinal transit to attenuate formation of postoperative adhesions[J].World J Surg,2005,29(12):1614-1620.
[2]王超,韩博,丁晓洁.七叶皂苷钠对大鼠脑缺血再灌注损伤SOD的影响[J].中国医药导报,2007,4 (6):18-19.
[3]Wang XH,Xu B,Liu JT,et al.Effect of β-escin sodium on endothelial cells proliferation,migration and apoptosis[J].Vascul Pharmacol,2008,49(4-6):158-165.
[4]杨晓冉,赵保忠,崔景荣.β-七叶皂苷钠对鸡胚血管新生的影响[J].中国新药杂志,2006,15(11):868-870.
[5]赵保忠,杨晓冉,郭维,等.β-七叶皂苷钠抗大鼠主动脉血管形成作用及机制初探[J].中国新药杂志,2007,16(17):1357-1360.
[6]Hu JN,Zhu XM,Han LK,et al.Anti-obesity effects of escins extracted from the seeds of Aesculus turbinata BLUME(Hippocastanaceae)[J].Chem Pharm Bull,2008,56(1):12-16.
[7]Niu YP,Li LD,Wu LM.Beta-aescin:a potent natural inhibitor of proliferation and inducer of apoptosis in human chronic myeloid leukemia K562 cells in vitro[J].Leuk Lymphoma,2008,49(7):1384-1391.
[8]万贵平,张真真,蔡雪婷,等.七叶皂苷钠抑制人白血病Jurkat细胞增殖的机制研究[J].中草药,2012,43 (1):106-110.
[9]张好生,刘明义,张莲梅.七叶皂苷的药理作用机制研究进展[J].世界科学技术:中医药现代化,2004,6 (3):45-46.
[10]McCubrey JA,Steelman LS,Chappell WH,et al.Ras/ Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR cascade inhibitors:how mutations can result in therapy resistance and how to overcome resistance[J].Oncotarget,2012,3 (10):1068-1111.
[11]Allen JE,El-Deiry WS.Regulation of the human TRAIL gene[J].Cancer Biol Ther,2012,13(12):1143-1151.
[12]Siegfried Z,Bonomi S,Ghigna C,et al.Regulation of the Ras-MAPK and PI3K-mTOR signalling pathways by alternative splicing in cancer[J].Int J Cell Biol,2013,2013: 568931.
Sodium aescinate induces apoptosis of HeLa cells by inhibiting Akt/ERK signaling pathways and increasing death receptor expression
QI Shi-mei,QI Zhi-lin,LING Lie-feng,LÜ Jun,ZHANG Yao
(Department of Biochemistry,Wannan Medical College,Wuhu 241002,China.E-mail:juliaqi@163.com)
AIM:To study the effects of sodium aescinate on the apoptosis of cervical cancer HeLa cells and its molecular mechanism.METHODS:MTT assay was used to detect the growth and proliferation of HeLa cells.The morphological alteration was observed under inverted microscope.Annexin V-FITC/PI double staining and DAPI nuclear staining were used to determine the apoptosis of HeLa cells induced by sodium aescinate.The apoptosis-related proteins PARP,cleaved caspase-8 and pro-caspase-3,and the proliferation-associated molecules Akt and ERK,as well as TRAIL receptors DR4 and DR5 were detected by Western blotting.RESULTS:Sodium aescinate inhibited the growth of HeLa cells in a concentration-dependent manner.Treatment with sodium aescinate induced the typical morphology of apoptotic cells and increased the apoptotic rate significantly.The cleaved PARP,cleaved caspase-8 and cleaved caspase-9 protein expression was observed.The expression of DR4 and DR5 was up-regulated.Meanwhile,pro-caspase-3 was decreased,and the levels of p-Akt and p-ERK were down-regulated by sodium aescinate in a dose-dependent manner.CONCLUSION:Sodium aescinate inhibits the proliferation and promotes the apoptosis of HeLa cells by increasing death receptor expression and repressing proliferation-associated signaling pathways.
Sodium aescinate;Uterine cervical neoplasms;Apoptosis;Death receptors;Akt pathway;ERK pathway
Q28
A
10.3969/j.issn.1000-4718.2014.02.008
1000-4718(2014)02-0239-06
2013-10-09
2013-12-13
国家自然科学基金资助项目(No.31301171);活性生物大分子研究安徽省重点实验室项目(No.1306C083008);高等学校省级优秀青年人才基金重点项目(No.2013SQRL055ZD);皖南医学院博士科研启动基金资助项目
△通讯作者Tel:0553-3932462;E-mail:juliaqi@163.com
