NF-κB及下游炎症因子在胰岛素抵抗大鼠肾脏中的表达
2014-11-05闫双通李春霖陆菊明田慧谷昭艳刘瑜
闫双通,李春霖,陆菊明,田慧,谷昭艳,刘瑜
有研究认为,核转录因子(NF-κB)是糖尿病及其慢性并发症发生、发展中的一个重要因素。已经明确,NF-κB与糖尿病的多种并发症如糖尿病肾脏病变、糖尿病心肌病变、糖尿病视网膜病变等均存在相关性[1-4]。然而,目前关于NF-κB的活化与胰岛素抵抗(IR)相关性的研究并不多,而IR的发生与代谢异常密切相关,因此是否在IR阶段就已存在NF-κB的活化值得探讨。本研究通过建立实验性IR大鼠模型,从蛋白和基因水平探讨NF-κB及其下游炎症因子iNOS和COX-2在IR大鼠肾脏组织损伤发生发展中表达的变化及其作用。
1 材料与方法
1.1 实验动物及分组 同一批号SPF级健康雄性2月龄Wistar大鼠30只,体重200~250g,随机分为正常对照(NC)组(n=15)和IR组(n=15),分别给予普通饮食和高脂饮食喂养。Wistar大鼠购自北京维通利华实验动物技术有限公司,批号为:SCXK(京)2007-0001。实验大鼠在解放军总医院动物中心SPF环境下喂养,自由进食饮水,室内温度22~24℃,湿度40%~60%,定期紫外线消毒。普通动物饲料及高脂饲料均购于中国医学科学院北京协和医科大学动物所。
1.2 体重及生化指标的检测 两组大鼠于饲养期间每10d于固定时间测体重1次并记录。喂养2个月后禁食12h,将大鼠麻醉后经腹主动脉取空腹血,4℃过夜,1000r/min离心后取上清液测生化指标:空腹血糖(FBG)、空腹胰岛素(FINS)、胆固醇(Ch)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)及游离脂肪酸(FFA)。
1.3 高胰岛素-正葡萄糖钳夹实验 在大鼠清醒状态下以2%利多卡因尾根部局部麻醉,尾静脉插管,尾动脉末端取血。钳夹实验开始10min,以12mU/(kg·min)的速率微量泵入人胰岛素溶液(诺和灵40U/ml),使血糖水平低于空腹水平0.5mmol/L,随后的110min内以4mU/(kg·min)的速率持续输入胰岛素。在此期间使用罗氏血糖仪每5min测血糖1次,根据血糖调整葡萄糖液输注速率(GIR),使钳夹血糖接近正常空腹血糖值,即4.4~5.5mol/L,并记录调整时间。计算60~120min的稳态葡萄糖GIR,以此反映胰岛素敏感性;用血糖变异系数(CVBG)反映钳夹实验准确性,GIR变异系数(CVGIR)反映钳夹实验可靠性。
1.4 样品采集及制备 所有大鼠在喂养2个月后处死。乙醚快速麻醉后迅速打开腹腔,取出肾脏,用等渗生理盐水清洗并充分灌洗,滤纸吸干,去肾脏包膜及结缔组织。将肾脏组织切割成若干份,置入10%中性甲醛溶液固定2h;梯度乙醇脱水,常规石蜡包埋,均匀间断切片10张,切片厚度约4~5μm。同时留取肾脏组织入液氮内保存。
1.5 HE染色观察肾小球形态的变化 将经石蜡包埋的肾脏组织切片放入二甲苯中脱蜡→无水乙醇,95%、80%、70%乙醇各5min后放入自来水水化→苏木素染色后自来水洗→显微镜下观察细胞核着染情况→0.5%盐酸乙醇分化数秒后,流水冲洗水化→伊红染色后50%乙醇适当分化→分别经75%、95%、100%乙醇脱水→二甲苯透明5min×2次→中性树胶封片,镜下观察结果。
1.6 免疫组化染色检测iNOS、COX-2的表达 肾脏组织石蜡包埋后制成切片,将切片进行烤片、乙醇脱水、枸橼酸盐煮沸抗原修复3min后H2O2中孵育15min。相应滴加兔多克隆iNOS抗体(1:165稀释)及兔COX-2抗体(1:70稀释,Santa Cruz公司)50μl,其后根据一抗类型分别选择滴加相应辣根过氧化物酶标记的二抗50μl,温箱内孵育1h左右,PBS缓冲液冲洗,DAB显色1~5min。阴性对照用PBS代替一抗。
1.7 RT-PCR检测大鼠肾脏组织NF-κB、iNOS及COX-2 mRNA的表达 分离部分肾脏组织,提取总RNA后经反转录反应得到cDNA溶液。PCR反应体系为cDNA 2μl,2×SYBR Mix(加4mmol/L Mg2+)25μl,目的基因上下游引物各1μl,Taq DNA聚合酶0.3μl。PCR反应条件:95℃预变性20s,58℃退火25s,72℃延伸30s,共47个循环。以同样体系进行看家基因GAPDH荧光定量作为内参照,用2-ΔΔCt值表示基因的相对表达量。
1.8 电泳迁移率变动分析(EMSA)检测肾脏组织NF-κB蛋白结合力 具体步骤:冰上研磨肾脏组织,加PBS成细胞悬液,离心回收细胞,先后使用细胞裂解液Ⅰ及细胞裂解液Ⅱ、核裂解液处理细胞,其后离心,取上清液于-80℃保存。使用BSA法对各组肾脏组织蛋白进行含量测定。凝胶电泳照相后测定其相应灰度值,对各组大鼠标本所得结果进行分析,灰度值越高则相应组别核蛋白NF-κB结合程度越高,则相应组别的NF-κB激活程度越高。双链寡核酸NF-κB探针序列为:5-AGTTGAGGGGACTTTCCCAGGC-3;3-TCAACTCCCCTGAAAGGGTCCG-5。
1.9 统计学处理 采用Stata 8.0软件进行统计学处理,计量资料以s表示,组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 两组大鼠体重及生化指标比较 与NC组相比,IR组大鼠体重、心脏重量、肾周和附睾脂肪重量/体重均明显增加(P<0.05),FINS、FFA、HDL-C、Ch、HOMA-IR水平均明显升高(P<0.05),GIR明显低于NC组(P<0.05,表1)。
表1 大鼠体重及生化指标结果比较(s,n=15)Tab.1 Comparison of body weight and biochemical results of rats s, n=15)
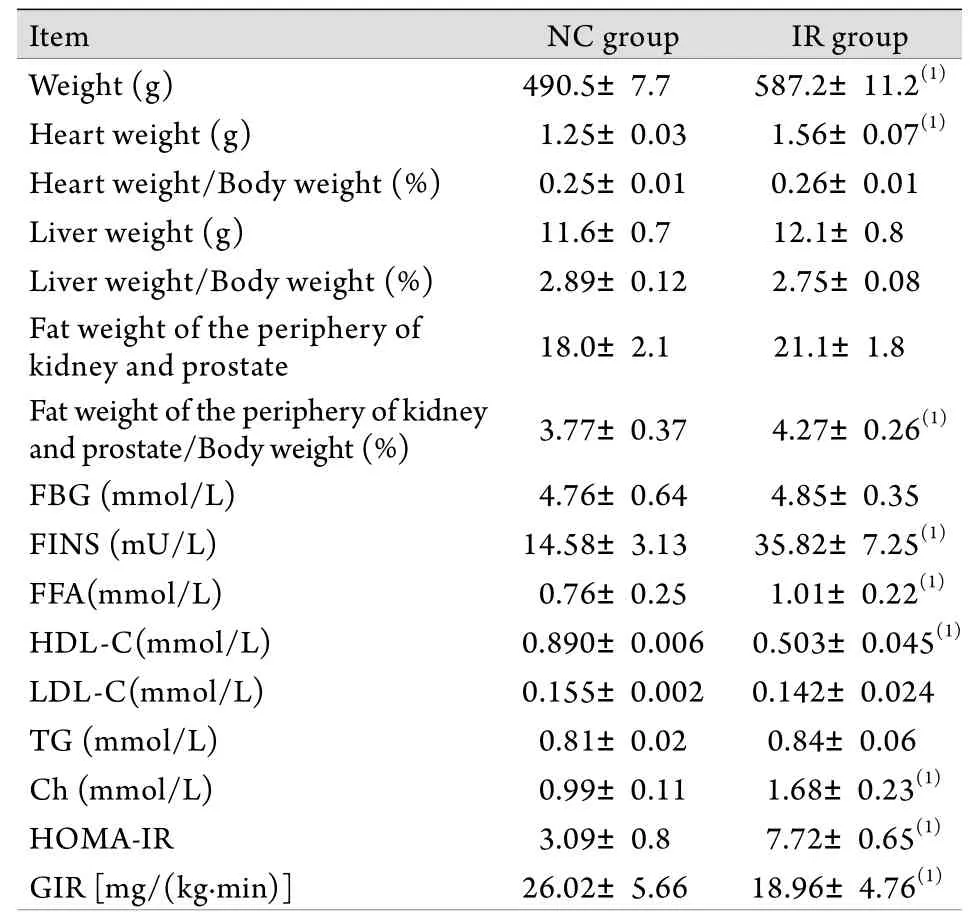
表1 大鼠体重及生化指标结果比较(s,n=15)Tab.1 Comparison of body weight and biochemical results of rats s, n=15)
FBG. Fasting blood glucose; FINS. Fasting insulin; FFA. Free fatty acid; HDL-C. High-density lipoprotein cholesterol; LDL-C. Lowdensity lipoprotein cholesterol; TG. Triglyceride; Ch. Cholesterol;HOMA-IR. Homeostasis model assessment of insulin resistance; GIR.Glucose infusion rate. (1) P<0.01 compared with NC group
Item NC group IR group Weight (g) 490.5±7.7 587.2±11.2(1)Heart weight (g) 1.25±0.03 1.56±0.07(1)Heart weight/Body weight (%) 0.25±0.01 0.26±0.01 Liver weight (g) 11.6±0.7 12.1±0.8 Liver weight/Body weight (%) 2.89±0.12 2.75±0.08 Fat weight of the periphery of kidney and prostate 18.0±2.1 21.1±1.8 Fat weight of the periphery of kidney and prostate/Body weight (%) 3.77±0.37 4.27±0.26(1)FBG (mmol/L) 4.76±0.64 4.85±0.35 FINS (mU/L) 14.58±3.13 35.82±7.25(1)FFA(mmol/L) 0.76±0.25 1.01±0.22(1)HDL-C(mmol/L) 0.890±0.006 0.503±0.045(1)LDL-C(mmol/L) 0.155±0.002 0.142±0.024 TG (mmol/L) 0.81±0.02 0.84±0.06 Ch (mmol/L) 0.99±0.11 1.68±0.23(1)HOMA-IR 3.09±0.8 7.72±0.65(1)GIR [mg/(kg·min)]26.02±5.66 18.96±4.76(1)
2.2 肾脏组织HE染色结果 与NC组相比,IR组大鼠肾小球明显肥大、基质明显增宽、炎细胞浸润明显增多(图1)。
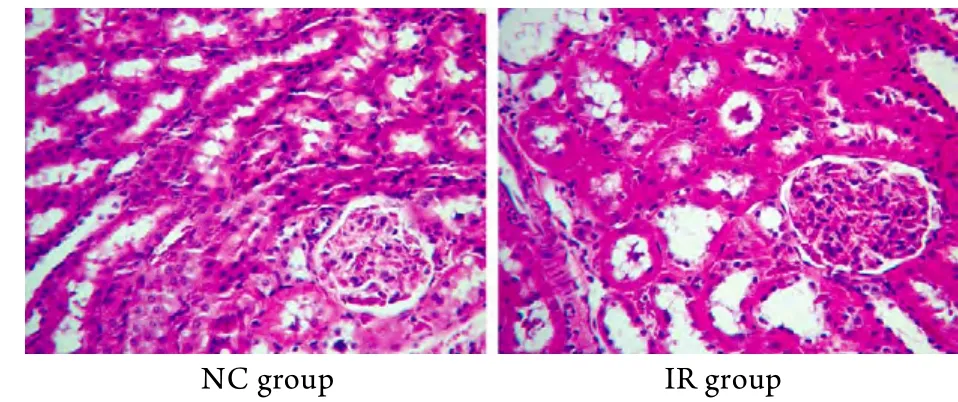
图1 大鼠肾脏组织HE染色(×200)Fig.1 HE staining of renal tissue in rats (×200)
2.3 两组肾脏组织iNOS和COX-2表达情况 免疫组化染色结果显示,IR组大鼠肾脏组织iNOS和COX-2表达(分别为0.480±0.028、0.532±0.088)与NC组(分别为0.036 ±0.041、0.235±0.028)比较明显增多,差异有统计学意义(P<0.05,图2)。
2.4 肾脏组织NF-κB及iNOS、COX-2 mRNA表达情况 RT-PCR检测结果显示,IR组大鼠肾脏组织中NF-κB、iNOS及COX-2 mRNA表达水平与NC组比较均明显升高(P<0.05,图3)。
2.5 EMSA结果 使用生物素标记的NF-κB寡核苷探针,对两组大鼠肾脏组织的NF-κB核蛋白NF-κB DNA结合力进行比较,结果显示,IR组大鼠肾脏组织核蛋白NF-κB DNA结合力显著升高,表明IR组大鼠肾脏组织NF-κB激活程度较高(P<0.05,图4)。
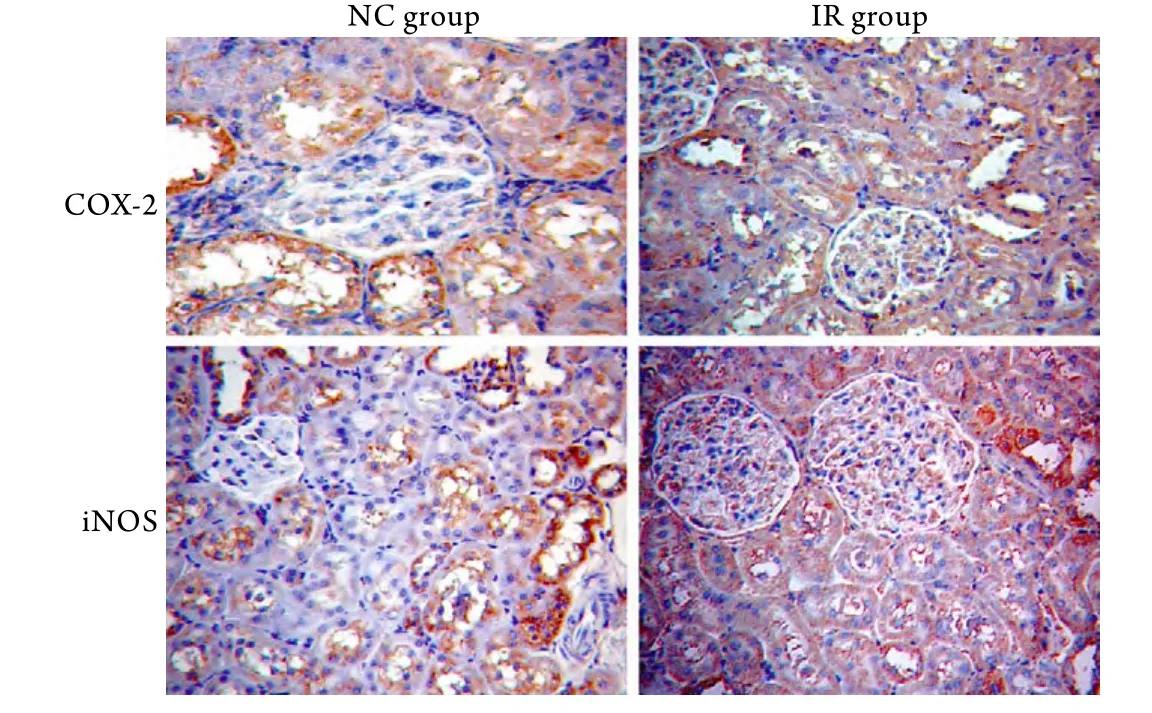
图2 免疫组化检测大鼠肾脏组织COX-2、iNOS表达(DAB ×200)Fig.2 Expressions of iNOS and COX-2 in rats detected by immunohistochemistry (DAB ×200)
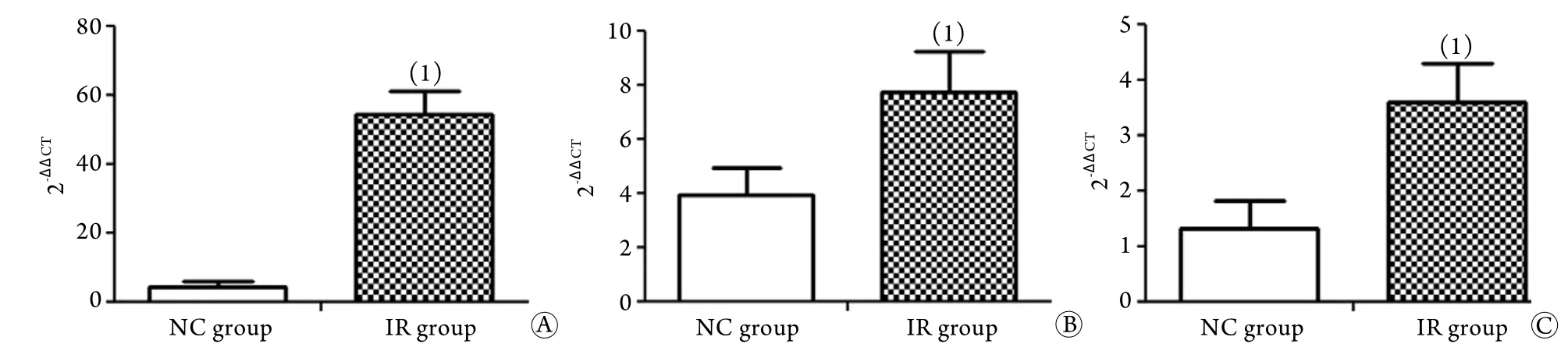
图3 肾脏组织NF-κB (A),COX-2 (B)和iNOS (C) mRNA的表达情况Fig.3 mRNA expression of NF-κB (A), COX-2 (B) and iNOS (C) in renal tissue measured by RT-PCR
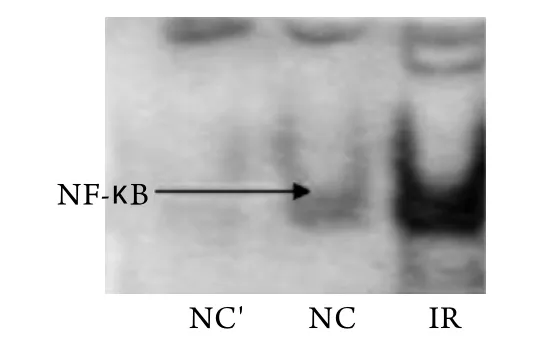
图4 大鼠NF-κB蛋白结合强度比较(EMSA)Fig.4 Comparison of binding activity of NF-κB in rat kidney(EMSA)
3 讨 论
目前2型糖尿病的具体病因及发病机制还不十分清楚,而IR被认为是其发病的中心环节。近年来,一些临床流行病学的研究发现IR个体血中炎症因子水平升高,存在着低度炎症表现[5]。与此同时,很多研究也发现,在非糖尿病的代谢综合征患者如肥胖、冠心病、高血压、血脂异常等也存在C反应蛋白(CRP)及白介素6(IL-6)水平的升高,且代谢综合征组分的增多与炎症因子水平增高呈正相关[6]。这就提示我们低度的炎症反应不仅与糖尿病的发生发展相关,可能也与IR的发生有着密切的关系[7-8]。
影响炎症反应和IR的因素很多,许多免疫细胞和脂肪细胞释放的多种介质都参与IR的发生[5]。而NF-κB作为炎症相关的关键标志物,在IR的发生中可能也起着重要作用。正是基于这种相关关系,我们研究了IR大鼠脏器内是否存在NF-κB及其下游炎症因子的激活,从而分析NF-κB系统激活是否是造成IR的一个因素。本研究采用高脂饮食喂养Wistar大鼠2个月后成功制备IR模型。与NC组比较,IR组体重明显增加,体脂含量明显上升(附睾及肾周脂肪占体重百分比上升),血糖水平虽在正常范围但伴有明显的肥胖、血脂异常、高胰岛素血症。同时,IR组HOMA-IR增高、生化指标及组织学改变均符合IR状态。
在糖尿病肾病模型中发现,肾脏中炎症细胞的出现早于肾小球和间质的损伤[9]。有研究显示,无论是在糖尿病发病的早、中、晚期,活体中的NF-κB表达均有不同程度增加,提示其可能是糖尿病发病过程的一个重要致病因素,在糖尿病肾脏病变的发病过程中有着重要作用[10-11]。本研究显示,在IR大鼠肾脏组织中,无论是NF-κB的表达,还是核蛋白DNA结合力,均显著增加,从表达与功能两方面论证了NF-κB的激活在血糖尚未显著性升高的IR阶段就已经发生,提示早期高血糖可能不是引起NF-κB激活的主要原因,而高胰岛素血症、血脂异常等因素均可能参与NF-κB的激活过程。引起NF-κB激活的因素是综合性的,因此在对糖尿病的治疗过程中,应该注重综合治疗,更有效地减少NF-κB等炎症因子的激活,从而起到保护脏器防止其受损的作用。
有研究认为,NO是细胞因子介导的β细胞损害及功能异常的潜在介质[12]。有研究者在离体状态下使用IL-1β和IFN-γ处理分离的鼠胰岛细胞,结果发现处理的细胞发生损伤,而这种损伤与iNOS以及NO的产生呈正相关[13]。NO在组织中直接测定非常困难,直接检测机体组织中iNOS的含量可以客观反映组织中NO的含量[14]。本研究显示IR大鼠肾脏组织iNOS的表达明显增强。iNOS的表达受到多种转录因子的调控,NF-κB是其中最主要的一种[15]。吴文等[16]的研究表明,抑制NF-κB的活性可以使糖尿病大鼠肾脏组织中iNOS的表达明显降低。
COX-2是花生四烯酸代谢合成各种前列腺素的限速酶,属于诱导型酶,与炎症反应密切相关,参与多种病理生理过程[17]。COX-2在糖尿病肾病发展过程中的表达水平上调以及过激化被认为可能是导致糖尿病肾损伤的机制之一,是目前研究肾脏保护常用的靶基因之一。已有研究表明COX-2在糖尿病肾病的发生发展中起重要作用[18]。高糖条件下通过线粒体电子传递链致使线粒体活性氧簇的产生增加,导致NF-κB激活,诱导COX-2 mRNA和蛋白表达增加。COX-2的表达增加激活了炎症因子的释放,炎症因子通过刺激肾小球系膜细胞的增生,使肾小球肥大,导致肾小球硬化。Nishikawa等[19]研究表明,糖尿病早期肾脏的高滤过是由于COX-2过度表达所致,这种高滤过最终导致肾小球硬化。炎症因子还能诱导氧自由基增多从而损伤血管内膜,同时诱导血管内皮细胞产生血小板活化因子,促进血栓的形成,导致肾功能的损害。本研究结果显示,COX-2在IR大鼠肾脏组织中表达显著增加并伴有肾脏的病理性损害,提示COX-2可能参与了糖尿病肾病的发生。COX-2的高表达被证明与糖尿病并发症的发生密切相关,且抑制COX-2的表达可以对糖尿病肾脏病变起到保护作用[20-21]。
iNOS和COX-2是NF-κB信号通路下游中重要的两种蛋白分子。COX-2的启动子序列中含有NF-κB特异结合序列,该序列与NF-κB结合后可以促进COX-2基因的转录。iNOS与COX-2相互协调,可直接损伤细胞的DNA和蛋白质。本研究结果显示,IR大鼠肾脏组织中存在NF-κB的激活,从而启动下游靶基因COX-2、iNOS表达的增加,进而导致肾脏组织受损。NF-κB的激活可能是导致IR大鼠肾脏病变的始动因子之一,目前这方面的研究有限,有待进一步研究证实。
[1]Chen L, Zhang J, Zhang Y, et al. Improvement of inflammatory responses associated with NF-kappa B pathway in kidneys from diabetic rats[J]. Inflamm Res, 2008, 57(5): 199-204.
[2]Lorenzo O, Picatoste B, Ares-Carrasco S, et al. Potential role of nuclear factor kappaB in diabetic cardiomyopathy[J]. Mediators Inflamm, 2011, 2011: 652097.
[3]Kumar R, Yong QC, Thomas CM. Do multiple nuclear factor kappa B activation mechanisms explain its varied effects in the heart[J]? Ochsner J, 2013, 13(1): 157-165.
[4]Kern TS. Contributions of inflammatory processes to the development of the early stages of diabetic retinopathy[J]. Exp Diabetes Res, 2007, 2007: 95103.
[5]Tilg H, Moschen AR. Inflammatory mechanisms in the regulation of insulin resistance[J]. Mol Med, 2008, 14(3/4):222-231.
[6]Pickup JC. Inflammation and activated innate immunity in the pathogenesis of type 2 diabetes[J]. Diabetes Care, 2004, 27(3):813-823.
[7]Muller S, Martin S, Koenig W, et al. Impaired glucose tolerance is associated with increased serum concentrations of interleukin 6 and co-regulated acute-phase proteins but not TNF-alpha or its receptors[J]. Diabetologia, 2002, 45(6): 805-812.
[8]Luan J, Zhang JT, Dong YH, et al. Correlation of serum C-reactive protein level with insulin resistance in obese hyperglycemic case[J]. Chin J Pract Inter Med, 2010, 30(7): 640-641. [栾健,张杰涛, 董砚虎, 等. 高血糖伴肥胖患者血清C反应蛋白与胰岛素抵抗的相关性研究[J]. 中国实用内科杂志, 2010,30(7): 640-641.]
[9]Rodriguez-Iturbe B, Pons H, Herrera-Acosta J, et al. Role of immunocompetent cells in nonimmune renal diseases[J].Kidney Int, 2001, 59(5): 1626-1640.
[10]Wu J, Guan TJ, Zheng S, et al. Inhibition of inflammation by pentosan polysulfate impedes the development and progression of severe diabetic nephropathy in aging C57B6 mice[J]. Lab Invest, 2011, 91(10): 1459-1471.
[11]Palsamy P, Subramanian S. Resveratrol protects diabetic kidney by attenuating hyperglycemia mediated oxidative stress and renal inflammatory cytokines via Nrf2-Keap1 signaling[J]. Biochim Biophys Acta, 2011, 1812(7): 719-731.
[12]Darville MI, Eizirik DL. Regulation by cytokines of the inducible nitric oxide synthase promoter in insulin-producing cells[J].Diabetologia, 1998, 41(9): 1101-1108.
[13]Lee JH, Song MY, Song EK, et al. Overexpression of SIRT1 protects pancreatic beta-cells against cytokine toxicity by suppressing the nuclear factor-kappaB signaling pathway[J].Diabetes, 2009, 58(2): 344-351.
[14]Kolodziejska KE, Burns AR, Moore RH, et al. Regulation of inducible nitric oxide synthase by aggresome formation[J]. Proc Natl Acad Sci USA, 2005, 102(13): 4854-4859.
[15]Nishiya T, Uehara T, Kaneko M, et al. Involvement of nuclear factor-kappaB (NF-kappaB) signaling in the expression of inducible nitric oxide synthase (iNOS) gene in rat C6 glioma cells[J]. Biochem Biophys Res Commun, 2000, 275(2): 268-273.
[16]Wu W, Ding HL, Fu ZZ. Effect of inhibiting nuclear factor-κB activity on level of nitric oxide in kidneys of diabetic rats[J]. Bull Acad Mil Med Sci, 2005, 29(2): 161-165. [吴文, 丁鹤林, 傅祖植. 抑制核因子-κB活性对糖尿病大鼠肾组织一氧化氮水平的影响[J]. 军事医学科学院院刊, 2005, 29(2): 161-165.]
[17]Shen LJ, Yin YB, Su Y, et al. Effect of xylitol on the COX-2 expression of renal tubule in diabetic rats[J]. Tianjin Med J,2010, 38(3): 219-222. [沈丽津, 尹彦斌, 苏悦, 等. 木糖醇对糖尿病大鼠肾小管环氧化酶-2表达的影响[J]. 天津医药, 2010,38(3): 219-222.]
[18]Jia Z, Sun Y, Liu S, et al. COX-2 but not mPGES-1 contributes to renal PGE2 induction and diabetic proteinuria in mice with type-1 diabetes[J]. PLoS One, 2014, 9(7): e93182.
[19]Nishikawa T, Araki E. Impact of mitochondrial ROS production in the pathogenesis of diabetes mellitus and its complications[J].Antioxid Redox Signal, 2007, 9(3): 343-353.
[20]Komers R, Lindsley JN, Oyama TT, et al. Immunohistochemical and functional correlations of renal cyclooxygenase-2 in experimental diabetes[J]. J Clin Invest, 2001, 107(7): 889-898.
[21]Zuo Y, Gu Y, Ma J, et al. Effect of selective cyclooxygenase -2 inhibitor on the renal lesion of streptozotocin-induced diabetic rats and its possible mechanism[J]. Natl Med J Chin, 2002,82(4): 239-243.
