重症中暑肠淋巴激活血管内皮细胞炎性活性的研究
2014-11-05童华生段鹏凯张兴钦安晓庆万鹏唐柚青苏磊
童华生,段鹏凯,张兴钦,安晓庆,万鹏,唐柚青,苏磊
新近研究认为在多种重症疾患应激早期,肠源性毒性物质即可通过肠系膜淋巴途径直接诱导全身炎症反应并引起内脏器官损害[1-2],本课题组前期研究亦发现重症中暑肠淋巴可激活血管内皮细胞,引发炎症反应,致其损伤[3]。更为重要的是目前研究已发现血管内皮细胞损伤是重症中暑多脏器功能损害发病的关键病理生理机制,血管内皮细胞炎症活性的激活是其中的重要环节之一,内皮细胞分泌炎性介质的同时表达相关细胞黏附分子可促进炎症细胞的黏附、浸润进而造成组织炎症损伤[4-6]。本研究通过观察重症中暑肠淋巴对血管内皮细胞炎症活性的影响,深入探讨重症中暑的发病机制。
1 材料与方法
1.1 重症中暑大鼠模型制备 由于雌激素对热损伤具有保护作用[7],本实验采用体重220~250g雄性Wistar大鼠,3%戊巴比妥钠(lml/kg)腹腔注射麻醉,固定于手术台。按照本课题组前期建立的方法制备重症中暑动物模型[3,8],观察大鼠在高温高湿环境热暴露状态下生命体征的变化趋势。模型制备成功标准:持续热暴露状态下,动物中心体温达42℃以上,平均动脉压(mean arterial pressure,MAP)从峰值下降25mmHg即为发生重症中暑[3,9]。
1.2 肠系膜淋巴液引流收集 将全肠道及网膜组织掀起,暴露肠系膜上动脉及肠系膜淋巴管,于近腹主动脉处剪开浆膜,钝性分离肠系膜上动脉及肠系膜淋巴干;轻提肠系膜淋巴干,在其上用眼科剪剪一小口,待少量淋巴液流出,用眼科镊夹持45°斜面硅胶导管于开口处顺淋巴管走向缓慢送入3~7mm;用少量医用胶涂抹于右肾旁浆膜处固定导管,分别收集热暴露前(Pre-HS)、热暴露期间(During-HS)和重症中暑后(Post-HS)的大鼠肠淋巴液。
1.3 ECV-340细胞的培养及处理 取对数期脐静脉内皮ECV-340细胞,用含10%胎牛血清的RPMI 1640液接种于96孔板培养,5×104/ml,待细胞生长至融合状态,换无血清培养基继续培养12h。分别加入5% Pre-HS、During-HS和Post-HS肠淋巴液孵育3、6h,每组设6个复孔。收集细胞培养上清用于炎症介质检测。由于实验结果发现热暴露后肠淋巴孵育ECV-340细胞6h后,ECV-340细胞炎性分泌活性明显,因此只检测肠淋巴孵育6h时的ICAM-1 mRNA表达和NF-κB活性水平。
1.4 炎症介质检测 采用ELISA法检测细胞培养上清高水平高迁移率族蛋白B1(Shino-Test Corporation,Sagamihara,HMGB1)、肿瘤坏死因子α(TNF α)、白介素1β(IL-1β)和IL-6水平,操作按说明书进行。
1.5 ICAM-1 mRNA表达检测 采用Trizol试剂盒提取ECV-340细胞RNA,反转录成cDNA。细胞间黏附分子1(intercellular cell adhesion molecule 1,ICAM-1)引物:正义5'-AACTTTTCAGCTCCGGTCCTG-3',反义5'-TCAGTGTGAATTGGACCTGCG-3'。采用PCR试剂盒扩增,反应条件:95℃ 30s,58℃ 30s,72℃ 50s,共35个循环;72℃ 8min。PCR产物经1.5%琼脂凝胶电泳,采用Image J 2.1.4.7进行图像分析处理。
1.6 NF-κB水平检测 采用细胞核蛋白试剂盒(江苏碧云天)提取ECV-340细胞核蛋白,采用TransFactor Profiling Kit-Inflammation试剂盒(BD Biosciences)检测核转录因子κB(NF-κB)的活性,上样量为40μg,具体操作按说明书进行。
1.7 统计学处理 采用SPSS 15.0进行统计学分析,计量资料采用s表示,多组间比较采用Oneway ANOVA分析,两组间比较采用LSD法,P<0.05为差异有统计学意义。
2 结 果
2.1 重症中暑肠淋巴诱导ECV-340细胞分泌炎症介质 ELISA法检测结果显示,热暴露前肠淋巴处理ECV-340细胞不分泌HMGB1,低水平分泌IL-6、IL-1β、TNF-α,而热暴露后,即During-HS和Post-HS情况下肠淋巴可诱导ECV-340细胞HMGB1、IL-6、IL-1β、TNF-α分泌增加(P<0.05或P<0.01),且诱导效应随着热暴露时间的延长而呈时间依赖性增强(P<0.05,图1)。
2.2 重症中暑肠淋巴诱导ECV-340细胞ICAM-1、NF-κB表达情况 热暴露后肠淋巴孵育6h后,ECV-340细胞ICAM-1 mRNA、NF-κB表达均增加(P<0.05或P<0.01),且诱导效应随着热暴露时间的延长也呈时间依赖性增强(P<0.05,图2)。
3 讨 论
肠道是众多危重疾病病理生理过程的扳机点,高热应激致肠源性毒素血症是驱动重症中暑发生发展的关键环节之一,而基于血管内皮损伤的病理效应是重症中暑发生、发展的平台。重症中暑时肠源性毒性物质进入循环,诱导血管内皮损伤,启动全身炎症反应,致凝血功能紊乱,这是重症中暑发病的根本机制[1-3]。本课题组前期研究发现,重症中暑肠淋巴途径可能是重症中暑肠源性毒性产物诱导血管内皮损伤的桥梁[3],但有关肠淋巴对血管内皮细胞炎性活性的影响,尚未见报道。
在热应激状态下,肠道血管收缩会导致缺血缺氧改变进而使肠黏膜通透性增加,促使肠源性毒性因子进入肠淋巴管,产生全身性病理损害效应[10-12]。本研究发现,During-HS肠淋巴可诱导ECV-340细胞呈时间依赖性分泌高水平IL-1β、IL-6、TNF-α和HMGB1,而Post-HS肠淋巴的诱导效应更为明显,提示热应激早期肠淋巴即可诱导血管内皮细胞释放炎性因子,且随着热应激时间的延长,肠淋巴毒性效应愈为明显。本研究也表明,血管内皮是重症中暑炎症反应的重要效应环节之一,这与既往研究结果一致[4-6]。早期炎症介质IL-1β、IL-6和TNF-α可进一步激活机体组织和全身性炎症反应,参与重症中暑全身炎性反应的发病过程且与疾病严重程度密切相关[13]。
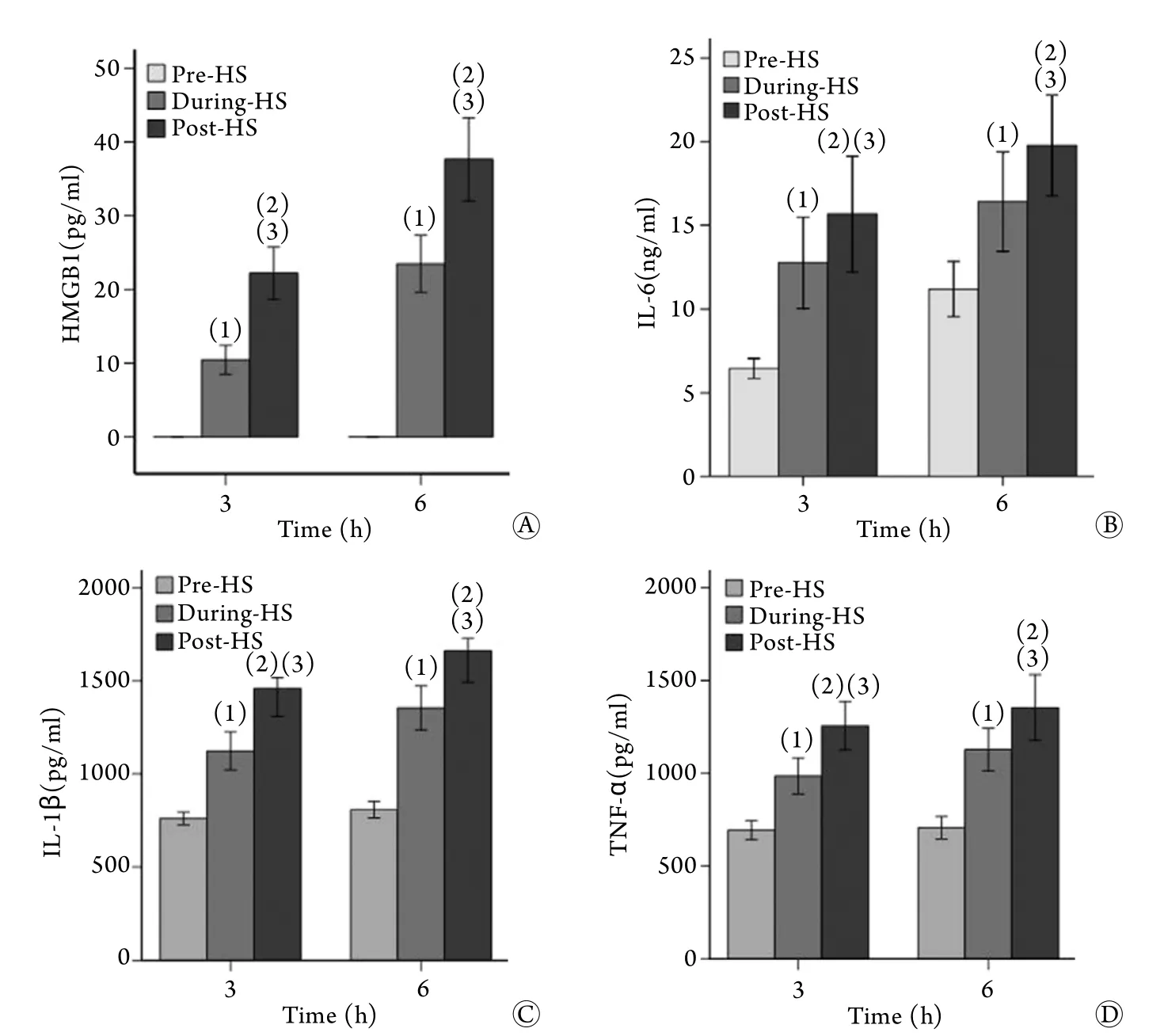
图1 重症中暑肠淋巴诱导ECV-340细胞炎性介质分泌的ELISA检测Fig.1 Secretion of inflammatory mediators of ECV-340 cells induced by severe heatstroke mesenteric lymph (ELISA)
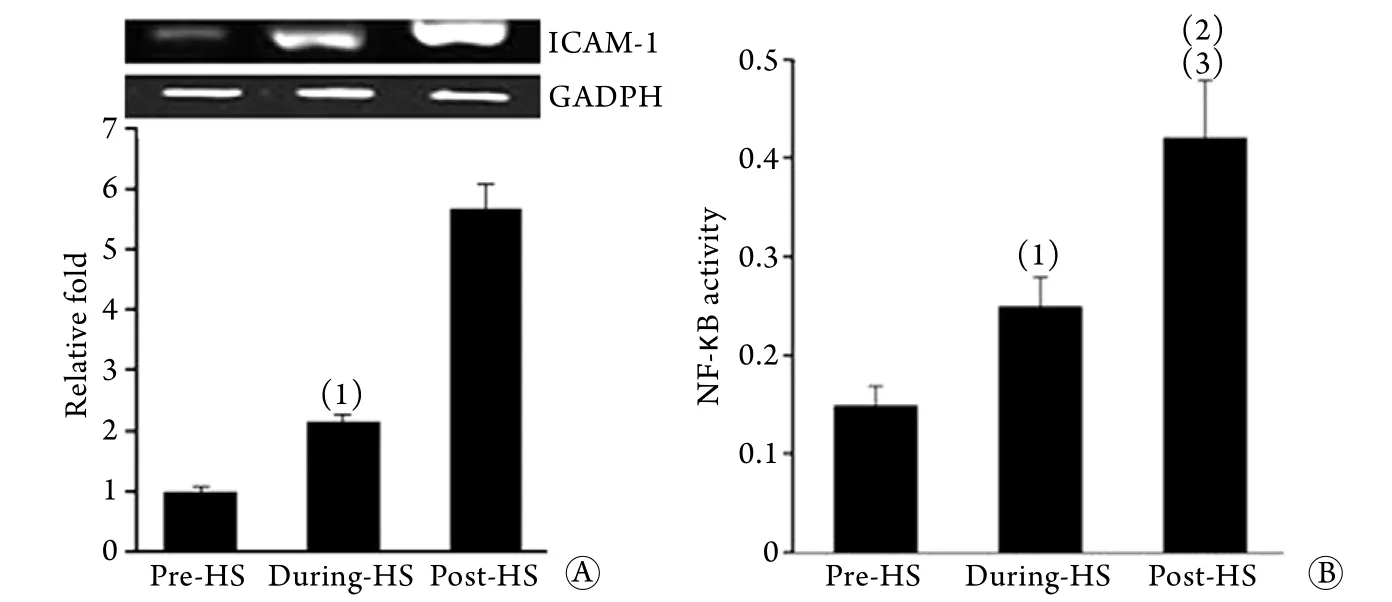
图2 重症中暑肠淋巴对ECV-340细胞ICAM-1、NF-κB表达的诱导作用Fig.2 Induction effect of severe heatstroke mesenteric lymph on ICAM-1 mRNA and NF-κB expression of ECV-340 cells
尽管HMGB1是一种参与脓毒症发病的晚期炎症介质,但其在重症中暑动物模型的热应激早期即可出现[14-16],更为重要的是HMGB1可在体内长时间高水平存在,可能在重症中暑持续性炎症反应中发挥重要作用,是重症中暑发病的关键性因子之一[17-18]。与肠淋巴诱导血管内皮炎性分泌效应一致的是,本研究还发现热应激肠淋巴可诱导血管内皮ICAM-1 mRNA表达明显上调。ICAM-1作为血管内皮与炎症细胞黏附的重要分子,可能介导多种炎性细胞向组织、器官定向转移、浸润,参与重症中暑炎症的发生和发展[19]。NF-κB是细胞炎性反应的主要转录因子,被激活后可导致炎性细胞因子、黏附分子以及许多其他调节转录凋亡的基因表达,进而参与机体炎性反应[20]。已有研究表明,肠淋巴诱导血管内皮损伤是基于NF-κB途径的[21],但重症中暑肠淋巴激活血管内皮炎症效应是否通过NF-κB途径目前尚不清楚。本研究结果发现,重症中暑肠淋巴可明显激活血管内皮NF-κB活性,且血管内皮NF-κB活性与其炎症效应增加趋势一致,提示重症中暑肠淋巴激活血管内皮炎性效应可能是基于NF-κB途径。
综上所述,本研究发现,重症中暑病程中肠淋巴可激活血管内皮炎症效应,且这种毒性激活效应随着热应激时间的延长而增强,提示基于肠淋巴途径的肠源性毒性物质和血管内皮构成了重症中暑的关键发病环节,NF-κB可能参与了热应激肠淋巴激活血管内皮炎症效应的分子通路,但仍需进一步研究证实。
[1]Gabriela C, Helori VD, Alexandre LS, et al. Lymphatic system as a path underlying the spread of lung and gut injury after intestinal isehemia/reperfusion in rats[J]. Shock, 2005, 23(4):330-336.
[2]Spindler-Vesel A, Wraber B, Vovk I, et al. Intestinal permeability and cytokine inflammatory response in multiply injured patients[J]. J Interferon Cytokine Res, 2006, 26(10): 771-776.
[3]Tong H, Wan P, Zhang X, et al. Vascular endothelial cell injury partly induced by mesenteric lymph in heat stroke[J].Inflammation, 2014, 37(1): 27-34.
[4]Bouchama A, Knochel JP. Heat stroke[J]. N Engl J Med, 2002,346(25): 1978-1988.
[5]Bouchama A, Kunzelmann C, Dehbi M, et al. Recombinant activated protein C attenuates endothelial injury and inhibits procoagulant microparticles release in baboon heatstroke[J].Arterioscler Thromb Vasc Biol, 2008, 28(7): 1318-1325.
[6]Roberts GT, Ghebeh H, Chishti MA, et al. Microvascular injury,thrombosis, inflammation, and apoptosis in the pathogenesis of heatstroke: a study in baboon model[J]. Arterioscler Thromb Vasc Biol, 2008, 28(6): 1130-1136.
[7]Chen SH, Chang FM, Niu KC, et al. Resuscitation from experimental heatstroke by estrogen therapy[J]. Crit Care Med,2006, 34(4): 1113-1118.
[8]Tong HS, Duan PK, Zhang XX, et al. Changes in mesenteric lymph microcirculation in rats suffering from severe heatstroke[J]. Med J Chin PLA, 2014, 39(4): 329-332. [童华生,段鹏凯, 张兴钦,等. 重症中暑大鼠肠系膜淋巴微循环变化[J]. 解放军医学杂志, 2014, 39(4): 329-332.]
[9]Chen SH, Chang FM, Chang HK, et al. Human umbilical cord blood-derived CD34+cells cause attenuation of multiorgan dysfunction during experimental heat stroke[J]. Shock, 2007,27(6): 663-671.
[10]Lu KC, Wang JY, Lin SH, et al. Role of circulating cytokines and chemokines in exertional heatstroke[J]. Crit Care Med, 2004,32(2): 399-403.
[11]Senthil M, Watkins A, Barlos D, et al. Intravenous injection of trauma-hemorrhagic shock mesenteric lymph causes lung injury that is dependent upon activation of the inducible nitric oxide synthase pathway [J]. Ann Surg, 2007, 246(5): 822-830.
[12]Xu DZ, Lu Q, Adams CA, et al. Trauma-hemorrhagic shockinduced up-regulation of endothelial cell adhesion molecules is blunted by mesenteric lymph duct ligation[J]. Crit Care Med,2004, 32(3): 760-765.
[13]Leon LR, Helwig BG. Heat stroke: role of the systemic inflammatory response[J]. J Appl Physiol, 2010, 109(6): 1980-1988.
[14]Hagiwara S, Iwasaka H, Goto K, et al. Recombinant thrombomodulin prevents heatstroke by inhibition of highmobility group box 1 protein in sera of rats[J]. Shock, 2010,34(4): 402-406.
[15]Hagiwara S, Iwasaka H, Shingu C, et al. High-dose antithrombin III prevents heat stroke by attenuating systemic inflammation in rats[J]. Inflamm Res, 2010, 59(7): 511-518.
[16]Tong HS, Duan PK, Zhang XQ, et al. Mechanism of HMGB1 secretion from THP-1 cells induced by double insults of heat and LPS [J]. Med J Chin PLA, 2014, 39(8): 640-644. [童华生, 段鹏凯, 张兴钦, 等. 热联合内毒素打击对THP-1细胞HMGB1分泌的诱导作用研究[J]. 解放军医学杂志, 2014, 39(8): 640-644.]
[17]Tong HS, Tang YQ, Chen Y, et al. Early elevated HMGB1 level predicting the outcome in exertional heatstroke[J]. J Trauma,2011, 71(4): 808-814.
[18]Tong HS, Tang Y, Chen Y, et al. HMGB1 activtiy inhibition alleviating Liver injury in heatstroke[J]. J Trauma Acute Care Surg, 2013, 74(3): 801-807.
[19]Hossain M, Qadri SM, Su Y, et al. ICAM-1-mediated leukocyte adhesion is critical for the activation of endothelial LSP1[J]. Am J Physiol Cell Physiol, 2013, 304(9): 895-904.
[20]Wu JF, Niu J, Li XP, et al. Effect of angiotensin Ⅱ on inflammatory responses of mouse bone marrow mesenchymal stem cell mediated by ERK1/2 and NF-κB pathways[J]. J Zhengzhou Univ (Med Sci), 2014, 49(4): 465-468. [武俊芳, 牛杰, 李晓鹏, 等. 血管紧张素Ⅱ对小鼠骨髓间充质干细胞中ERK1/2 和NF-κB信号途径介导的炎症反应的影响[J]. 郑州大学学报(医学版), 2014, 49(4): 465-468.]
[21]Damle SS, Moore EE, Nydam TL, et al. Post-shock mesenteric lymph induces endothelial NF-κB activation[J]. J Surg Res,2007, 143(1): 136-140.
