胶质瘤干细胞与神经干细胞基因表达差异的微阵列基因芯片分析
2014-11-05尹丰张剑宁赵明明周春辉王淑为郭欣如刘爽
尹丰,张剑宁,赵明明,周春辉,王淑为,郭欣如,刘爽
脑胶质瘤是成年人最常见的恶性脑肿瘤,尽管手术、放化疗等传统治疗方法目前已有了很大改进,但恶性胶质瘤的预后仍不理想,特别是胶质母细胞瘤,患者平均生存期仅为14个月[1]。最近的研究显示脑肿瘤中存在一小部分具有干细胞特性的细胞亚群,即脑肿瘤干细胞(BTSCs),目前认为BTSCs是脑肿瘤发生发展的根源以及产生放化疗抗性和肿瘤复发的原因[2-5]。研究显示,BTSCs与神经干细胞(NSCs)具有许多相似的特性,如自我更新、多向分化及成瘤性等,提示BTSCs可能起源于突变的NSCs[6-8]。探讨NSCs向胶质瘤干细胞(GSCs)恶性转化的分子机制对于进一步明确胶质瘤的起源以及开发特异性的治疗策略具有十分重要的意义。本研究采用含有29 186个人类mRNA探针的表达谱基因芯片对正常NSCs及GSCs中的差异表达基因进行对比筛查,并利用生物信息学方法对可能与NSCs向GSCs恶性转化有关的信号分子及信号路径进行预测,旨在为探索GSCs的起源及机制提供新的线索和方向。
1 材料与方法
1.1 人GSCs和NSCs的分离培养及鉴定 GSCs来源于新诊断的WHO Ⅳ级胶质母细胞瘤(GBM)患者手术切除的肿瘤组织。NSCs来源于10~13周自然流产胚胎的海马组织。采用Neurosphere法体外培养扩增所获GSCs和NSCs,在稳定传代的基础上,对这两种干细胞的表型特征和分化特性进行CD133和Nestin免疫化学染色鉴定,同时在裸鼠颅内进行定向移植试验检测两种干细胞的体内成瘤性[9]。本研究经海军总医院伦理委员会审查批准,标本的获取均经患者本人同意,患者了解所取标本的风险和用途,并签署知情同意书。
1.2 差异表达基因的微阵列基因芯片分析 采用RNeasy Midi试剂盒(Qiagen公司,加拿大)提取GSCs和NSCs的总RNA,利用Human HOA5.1 OneArray(Phalanx Biotech Group,中国台湾)对GSCs和NSCs的mRNA表达谱进行检测。收集所得数据,利用Rosetta Resolved System (Rosetta Biosoftware公司,美国)进行分析,根据所得FC值(GSCs与NSCs中mRNA表达丰度的比值)确定差异表达基因,标准为FC≥2或≤0.5且P<0.01。
1.3 qRT-PCR验证 利用Trizol试剂分别提取体外培养的GSCs和NSCs中的总RNA,根据待测mRNA序列设计合成引物(表1),利用SYBR Green 试剂盒(Applied Biosystems)进行qRT-PCR验证,以β-actin作为内参。扩增程序为97℃ 3min;95℃变性30s,56℃退火20s,72℃延伸30s,40个循环。实验重复3次。结果以2-ΔΔCt表示。
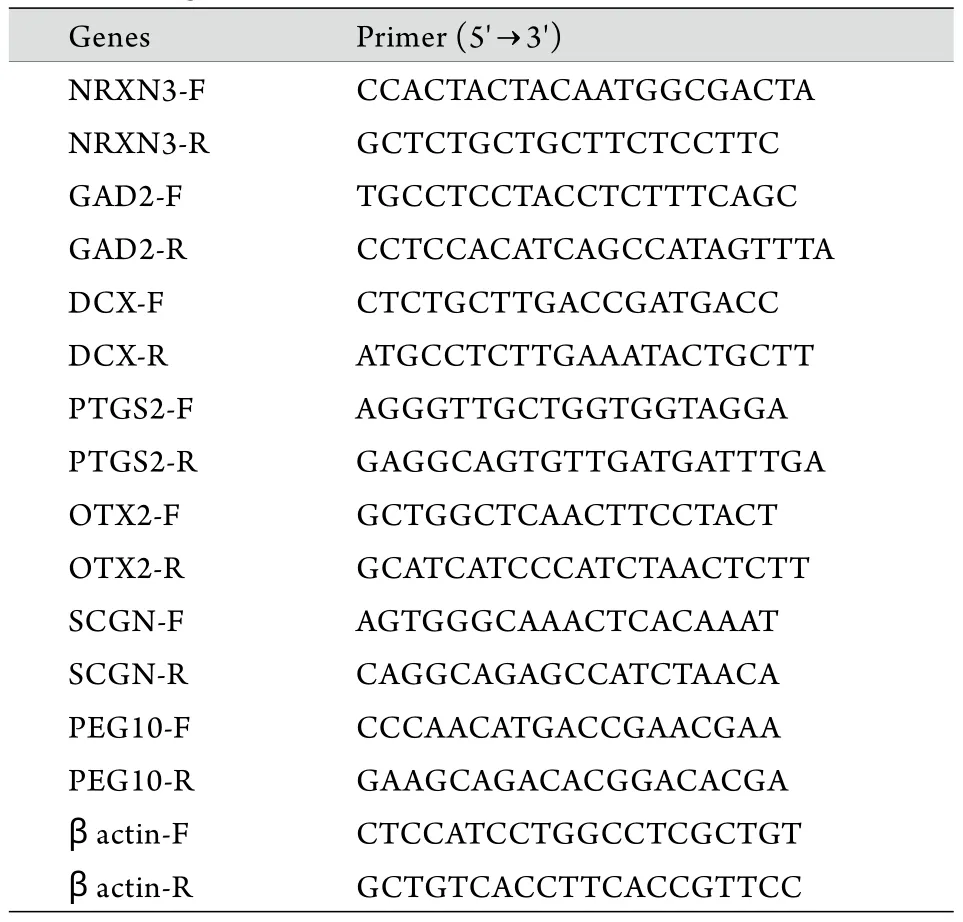
表1 实时定量RT-PCR的寡核苷酸引物Tab.1 Oligonucleotide primers in quantitative real-time RT-PCR
1.4 生物信息学分析 利用GO和KEGG富集分析研究差异表达基因可能参与的信号路径。
1.5 统计学处理 采用SPSS 19.0软件进行统计分析,数据结果以表示,差异表达基因的比较采用结合方差分析(ANOVA)和倍数变化(fold change,FC)分析的方法。P<0.05为差异有统计学意义。
2 结 果
2.1 GBM来源的GSCs的鉴定 无菌环境中分离GBM标本成单细胞悬液,无血清神经干细胞培养基体外培养7d,镜下可见许多小的神经球。免疫荧光染色显示CD133阳性。诱导分化后可形成胶质纤维酸性蛋白(GFAP)阳性的神经胶质细胞和β-tubulin阳性的神经元细胞。利用动物立体定向仪将这些神经球移植到裸鼠颅内可形成新的脑肿瘤(图1)。
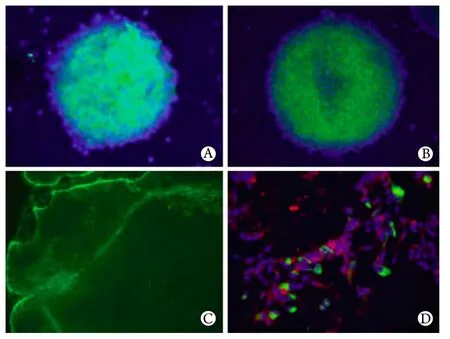
图1 GSCs的体外培养及鉴定(×20)Fig. 1 Culture in vitro and identification of GSCs (×20)
2.2 GSCs与NSCs中差异表达基因的芯片检测 微阵列基因芯片检测显示,与NSCs相比,GSCs中有1501个基因表达上调,1372个基因表达下调。表2显示了差异表达最显著的10个上调和下调基因。对2873个差异表达基因进行聚类分析,筛选条件为FC≥2或者≤1,调节P≤0.01,表达谱中最大值为6.166 69,最小值为-9.349 5,将每个mRNA在6个样本中的最大值标准化为1,最小值转化为0,如图2。GO及KEGG分析显示,在1372个下调基因中,错误发现率(FDR)<0.01的富集的GO生物过程有139个,在1501个上调基因中,FDR<0.01的富集的GO生物过程有62个。下调基因中,FDR<0.01的KEGG信号路径有5个,分别为神经轴突导向、细胞周期、细胞黏附、免疫炎症反应及癌症相关信号路径(图3)。

表2 GSCs中上调和下调最明显的前10个基因Tab.2 Top 10 up-and down-regulated genes in GSCs
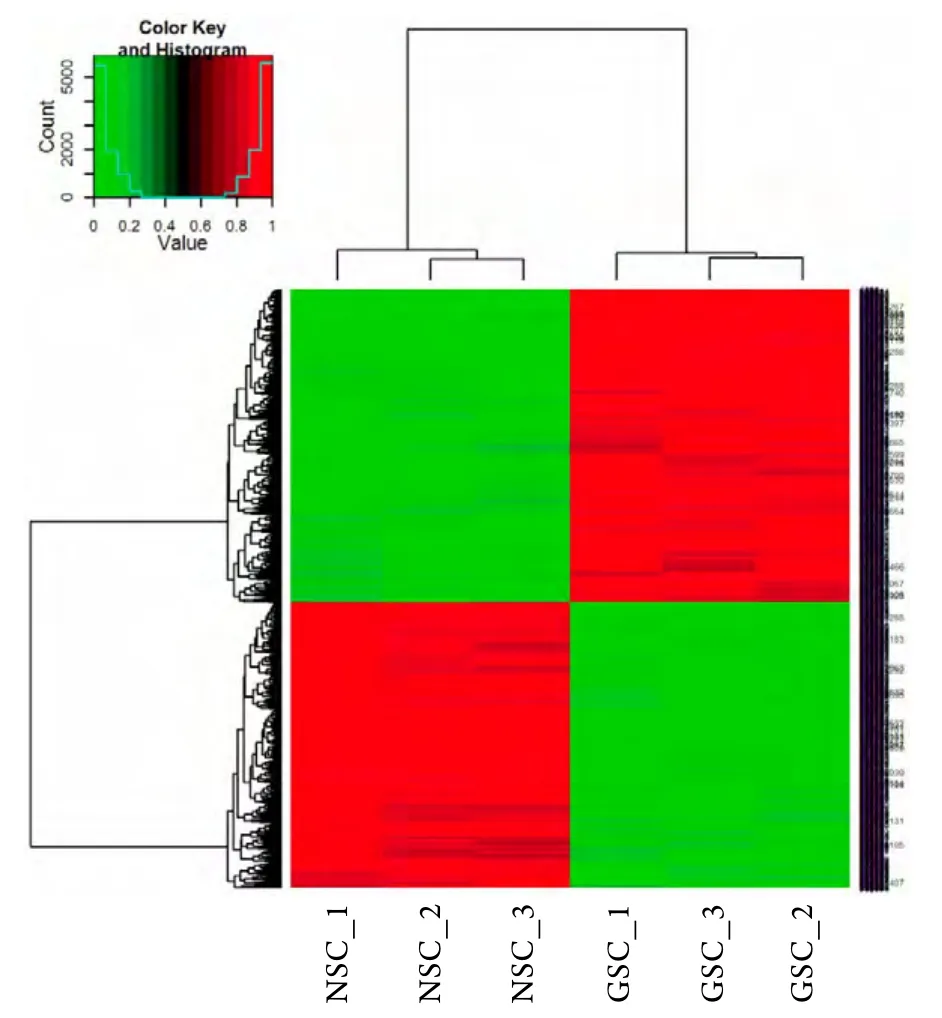
图2 GSCs及NSCs中差异表达基因的聚类分析Fig. 2 Heatmaps depicting hNSC and hGSC mRNAs derived from t-test and FC analyses
2.3 qRT-PCR验证 本研究选择7个芯片检测到的差异表达基因(DCX、PTGS2、SCGN、GAD2、OTX2、PEG10、NRXN3)进行qRT-PCR验证,根据各自mRNA序列设计引物,以β-actin作为内参照。验证结果显示,所选的7个基因在GSCs与NSCs中均存在差异表达,且与芯片检测结果相符(表3),两种方法检测的一致率为100%。
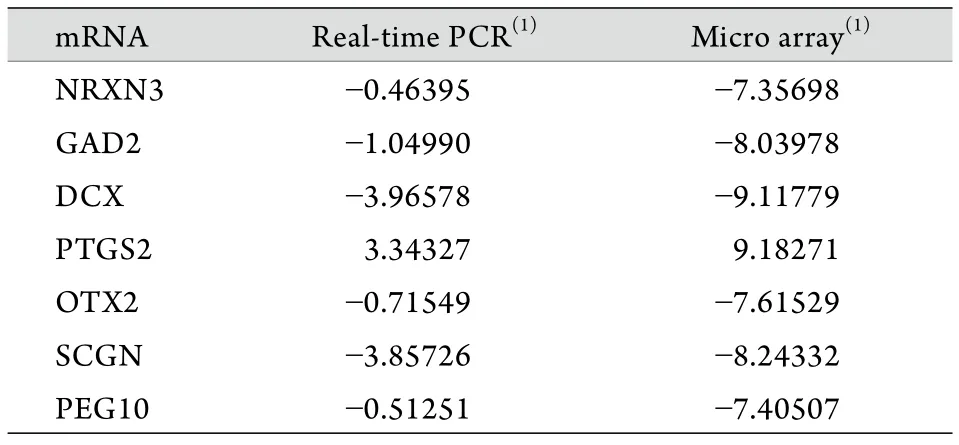
表3 部分芯片检测差异基因的实时定量RT-PCR验证Tab.3 Assay of some of the differential genes by quantitative real-time RT-PCR
3 讨 论
最近有研究显示,胶质瘤中存在一小群称为GSCs的、具有干细胞特性的细胞亚群,该细胞亚群来源于突变的NSCs[10-12],是胶质瘤复发及放化疗抗性的根源。为了进一步探索NSCs向GSCs恶性转化的机制,本研究对GSCs和NSCs进行了表达谱基因芯片对比筛查,结果发现2873个差异表达基因。其中尼克酰胺N-甲基转移酶(NNMT)在GSCs中的表达明显高于NSCs,而有研究显示NNMT在其他肿瘤细胞中也呈高表达,敲除NNMT能够抑制肿瘤细胞的增殖和集落形成能力[13],提示NNMT的异常表达可能参与了胶质瘤的发生与发展。相反,性别决定基因盒1(SOX1)在GSCs中的表达明显低于NSCs,而本研究所采用的标本均来自男性,因此可以忽略性别因素的影响,从而推测SOX1表达缺失可能参与了NSCs向GSCs的恶性转化。有研究证实肝癌细胞可通过启动子的超甲基化而下调SOX1的表达,而过表达SOX1可抑制肝癌细胞的增殖、克隆形成及侵袭能力[14]。
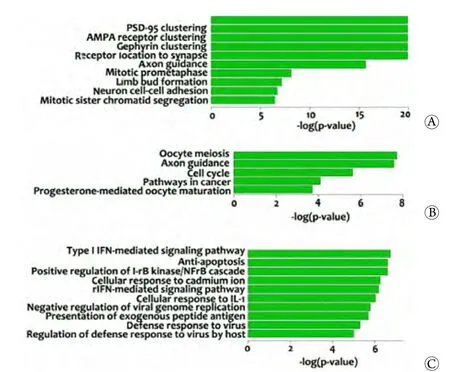
图3 对芯片检测的差异表达基因的GO功能和KEGG信号路径富集分析Fig. 3 The GO BP and KEGG signaling pathway analysis of differentially expressed genes
然而,本研究中一些差异表达基因的功能与已有的报道并不一致,如胰岛素样因子结合蛋白3(IGFBP3)在GSCs中的表达明显高于NSCs,而Wu等[15]的研究显示IGFBP3可通过活化caspases诱导多种肿瘤细胞的凋亡和细胞周期休止,提示同一种基因在不同的组织细胞中可能具有截然不同的功能和作用,尽管有些基因在其他肿瘤中的功能已被研究确定,但是在胶质瘤中的作用还有待于进一步深入探讨。
总之,本研究揭示了GSCs与NSCs在mRNA表达水平的差异,提示由mRNA所控制的转录调节网络对NSCs向GSCs的恶性转化具有重要影响。该结果为探索胶质瘤发生发展机制提供了线索,为胶质瘤的诊断和靶向治疗提供了新的靶点。
[1]Maher EA, Furnari FB, Bachoo RM, et al. Malignant glioma:genetics and biology of a grave matter[J]. Genes Dev, 2001,15(11): 1311-1333.
[2]Rich JN. Cancer stem cells in radiation resistance[J]. Cancer Res, 2007, 67(19): 8980-8984.
[3]Singh SK, Hawkins C, Clarke ID, et al. Identifi cation of human brain tumour initiating cells[J]. Nature, 2004, 432(7015): 396-401.
[4]Galli R, Binda E, Orfanelli U, et al. Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma[J]. Cancer Res, 2004, 64(19): 7011-7021.
[5]Dean M, Fojo T, Bates S. Tumour stem cells and drug resistance[J]. Nat Rev Cancer, 2005, 5(4): 275-284.
[6]Quinones-Hinojosa A, Chaichana K. The human subventricular zone: a source of new cells and a potential source of brain tumors[J]. Exp Neurol, 2007, 205(2): 313-324.
[7]Chaichana KL, Guerrero-Cazares H, Capilla-Gonzalez V, et al.Intra-operatively obtained human tissue: protocols and techniques for the study of neural stem cells[J]. J Neurosci Methods, 2009, 180(1): 116-125.
[8]Calabrese C, Poppleton H, Kocak M, et al. A perivascular niche for brain tumor stem cells[J]. Cancer Cell, 2007, 11(1): 69-82.
[9]Aboody KS, Brown A, Rainov NG, et al. Neural stem cells display extensive tropism for pathology in adult brain: evidence from intracranial gliomas[J]. Proc Natl Acad Sci USA, 2000, 97(23):12846-12851.
[10]Alcantara Llaguno S, Chen J, Kwon CH, et al. Malignant astrocytomas originate from neural stem/progenitor cells in a somatic tumor suppressor mouse model[J]. Cancer Cell, 2009,15(1): 45-56.
[11]Bachoo RM, Maher EA, Ligon KL, et al. Epidermal growth factor receptor and Ink4a/Arf: convergent mechanisms governing terminal differentiation and transformation along the neural stem cell to astrocyte axis[J]. Cancer Cell, 2002, 1(3): 269-277.
[12]Holland EC, Hively WP, DePinho RA, et al. constitutively active epidermal growth factor receptor cooperates with disruption of G1cell-cycle arrest pathways to induce glioma-like lesions in mice[J]. Genes Dev, 1998, 12(23): 3675-3685.
[13]Pozzi V, Mazzotta M, Lo Muzio L, et al. Inhibiting proliferation in KB cancer cell by RNA interference-mediated knowdown of nicotinamide N-Methyltransferase expression[J]. Int J Immunopathol Pharmacol, 2011, 24(1): 69-77.
[14]Tsuju K, Yasui K, Gen Y, et al. PEG10 is a probable target for the amplification at 7q21 detected in hepatocellular carcinoma[J].Cancer Genet Cytogenet, 2010, 198(2): 118-125.
[15]Wu C, Liu X, Wang Y, et al. Insulin-like factor binding protein-3 promotes the G1cell cycle arrest in several cancer cell lines[J].Gene, 2013, 512(1): 127-133.
