运输时间和密度对翘嘴鲌皮质醇、耗氧率及氧气袋内水质的影响
2014-11-05胡培培刘汝鹏赵忠波樊启学宗克金
胡培培 刘汝鹏 赵忠波 何 辉 樊启学 宗克金
(华中农业大学水产学院, 武汉 430070)
活鱼运输主要有封闭式和开放式运输两大类型[1],能引起鱼的应激反应, 对鱼体造成损伤, 死亡率高等[2,3],而运输时间、密度、水质等是影响活鱼运输成活率的主要因素, 尤其是水质恶化和累积效应[2,4]。氧气袋充氧运输具有运输水的体积小, 成活率高等优点, 广泛用于水产苗种运输, 而运输密度高会导致氧气袋内水质迅速恶化,水体高游离CO2和氨氮浓度会导致苗种死亡[1,4,5], 还可产生过度拥挤效应[4], 胁迫后消耗大量能量[6]。因此, 合理的运输制度包括合理的运输密度, 其可保持良好的水质条件, 降低鱼类应激水平, 提高存活率[2,4]。 翘嘴鲌(Culter alburnus Basilewsky)隶属鲌亚科, 鲌属, 中上层较大型经济鱼类, 具有较高营养价值, 但对捕捞、运输等应激敏感。本实验旨在研究运输时间和密度对氧气袋内水体氨氮、游离CO2、溶氧和pH的影响, 并对翘嘴 鲌全鱼皮质醇水平以及胁迫后耗氧率的影响, 寻求苗种合理的运输制度, 为实际生产提供理论依据。
1 材料与方法
1.1 实验鱼与装置
实验鱼为人工繁殖的同一批鱼, 全长(22.21±1.44) mm,实验开始前暂养于水泥池(内装水 15 m3)中, 放养密度为1.5 g/L, 微流水(换水量为10.5 L/min)养殖, 增氧机增氧,使DO>5.0 mg/L, 驯化2周, 每天定时饱食投喂鱼苗微粒子饲料(山东升索渔用饲料研究中心; 粗蛋白≥41%, 粗脂肪≥8%)2次, 11:00—15:00遮阴。暂养期间, 每日监测水质情况: 水温 25—31 ℃; pH 7.4—8.5; 亚硝态氮和H2S<0.05 mg/L; 氨氮<0.5 mg/L, 自然光照。正式实验前停食 2d。实验鱼平均体重全长分别为: (0.21±0.04) g、(35.07±1.65) mm (n=1800); 肥满度为(0.93±0.06) g/cm3。采用双层塑料尼龙袋(45 cm×20 cm)充氧密封法运输实验鱼, 路段设在华中农业大学和武汉繁生渔业科技有限公司(武汉江夏区流芳镇)之间: 从渔场到流芳镇为土路(6.5 km), 较颠簸, 从流芳镇到华中农业大学为柏油路和水泥路(35 km)(武汉三环), 较平坦。运输后实验鱼耗氧率测定采用密封式流水法, 参考陈宁生和施 瑔芳[7], 代谢瓶容积为1500 mL。
1.2 实验设计
2013年7月8日(气温 28—35℃)7:10将实验鱼从水泥池中捕获(水温28.1℃), 实验开始前先用冰块将遮阴处池塘水调节为26℃, 用烧杯量取池塘水1.5 L, 之后倒入小盆中, 再将小盆放在电子天平(0.01 g)上并归零, 然后用小网迅速捞鱼并放入小盆中, 准确称重后倒入氧气袋中, 最后充入纯氧2.5 L(氧气流量表调节流量, 30 L/min),立即打包, 以尼龙袋膨胀无凹瘪为度。运输密度为 33、40、47和 54 g/L, 运输时间为 0、2、4、6、8、10h, 采用4×6双因素实验, 各组设 3个平行, 并设 10个空白组(不装鱼), 并将带有细线的温度计放入空白组, 监测袋内水温, 共 82包, 放入泡沫盒(水温 26℃)中立即用面包车运输, 运输时间为 07:40—17:40。实验期间, 监测水温、车内气温(25℃)和车速, 土路为(20—25) km/h, 柏油路为(60—70) km/h, 学校水泥路为(30—40) km/h, 学校停留(3—5)min, 单程时间为1h, 往返重复10次。在运输0、2、4、6、8、10h后, 每个代谢瓶放置各组鱼8尾, 代谢时间为2h, 流速为100 mL/min, 实验期间出水口溶氧在4 mg/L以上, 各代谢瓶又放置在盛水的大呼吸室中, 调节水温为(27±0.5)℃, 遮光条件采用黑布覆盖, 设 3个平行和 1个空白对照组; 实验开始和结束时测定各代谢室进出水口溶氧, 实验结束后测定代谢室鱼的全长[游标卡尺(0.001 mm)]和体重[电子天平(0.001 g)]。
1.3 样品采集与分析及参数计算
在运输 0、2、4、6、8、10h时, 立即用便携式溶氧仪(美国YSI556)测定各组氧气袋内水体温度、溶氧和pH;迅速用50 mL移液管取水样, 测定游离CO2浓度(采用酸碱滴定法); 再用水样瓶(500 mL)采集水样, 测定氨氮浓度(采用预蒸馏—纳氏试剂分光光度法); 取各组鱼 8—10尾, 迅速放入液氮中, 测定全鱼皮质醇水平(采用美国鱼类皮质醇ELISA试剂盒法); 各项步骤的操作时间不超过30s, 并测定各组鱼的全长和体重(n=30); 运输 10h后,将各组取样剩余的鱼转入玻璃水缸(340 L)中观察 24h,记录死亡数。
耗氧率(Oxygen consumption rate, RO)参考陈宁生和施 瑔芳[7]。
1.4 统计分析
数据以平均值±标准差(x ±SD)表示, 采用SPSS 18.0软件进行双因素方差分析(two-way ANOVA analysis)(翘嘴 鲌体重、水温作为协变量), Duncan 氏法比较差异显著性; 显著水平P<0.05。
2 结果
2.1 运输时间和密度对翘嘴鲌氧气袋内水质变化的影响
在整个运输中氧气袋内水温为(26.0—27.5)℃, 氧气袋内水质变化情况如表 1。水体溶氧(Dissolved oxygen;DO)和 pH随运输时间和密度的增加而显著降低, 氨氮(Total ammonia nitrogen; TAN)和游离CO2浓度则随它们的增加而显著升高, 且交互作用显著; 在运输 0—2h时,各组DO和pH呈现大幅度的下降趋势, 单位时间平均下降了7.33 mg/L和0.34, TAN呈现大幅度的上升趋势, 单位时间平均上升了2.93 mg/L, 而游离CO2表现在(2—4)h,单位时间平均上升了 8.87 mg/L, 之后变化缓慢; 运输(8—10)h时, 各组DO、pH、TAN和游离CO2浓度再次呈现较大幅度的变化趋势; D3、D4组DO分别于运输8、10h降到10 mg/L以下。在整个运输中, 水体DO、pH、TAN和游离CO2单位时间变化值随密度的增加而增大。

表1 运输时间和密度对氧气袋内水体中溶氧、pH、氨氮和游离二氧化碳的影响Tab.1 Effect of transportation time and density on water dissolved oxygen, pH, ammonia nitrogen and carbon dioxide free in polyethylene bags
2.2 运输时间和密度对翘嘴鲌全鱼皮质醇和耗氧率的影响
在本实验条件下, 各组鱼存活率为 100%, 翘嘴鲌全鱼皮质醇水平及胁迫后耗氧率(RO)随密度的增加而显著增大, 随运输时间呈现先升高后降低再升高的趋势,且都显著高于对照水平(运输 0h), 交互作用不显著(图1)。各组皮质醇水平都于运输2h达到峰值, 之后开始下降, 而D2—D4组皮质醇水平又于运输8h后开始上升。各组RO都于运输4h达到峰值。运输时间的主效应更为突出。
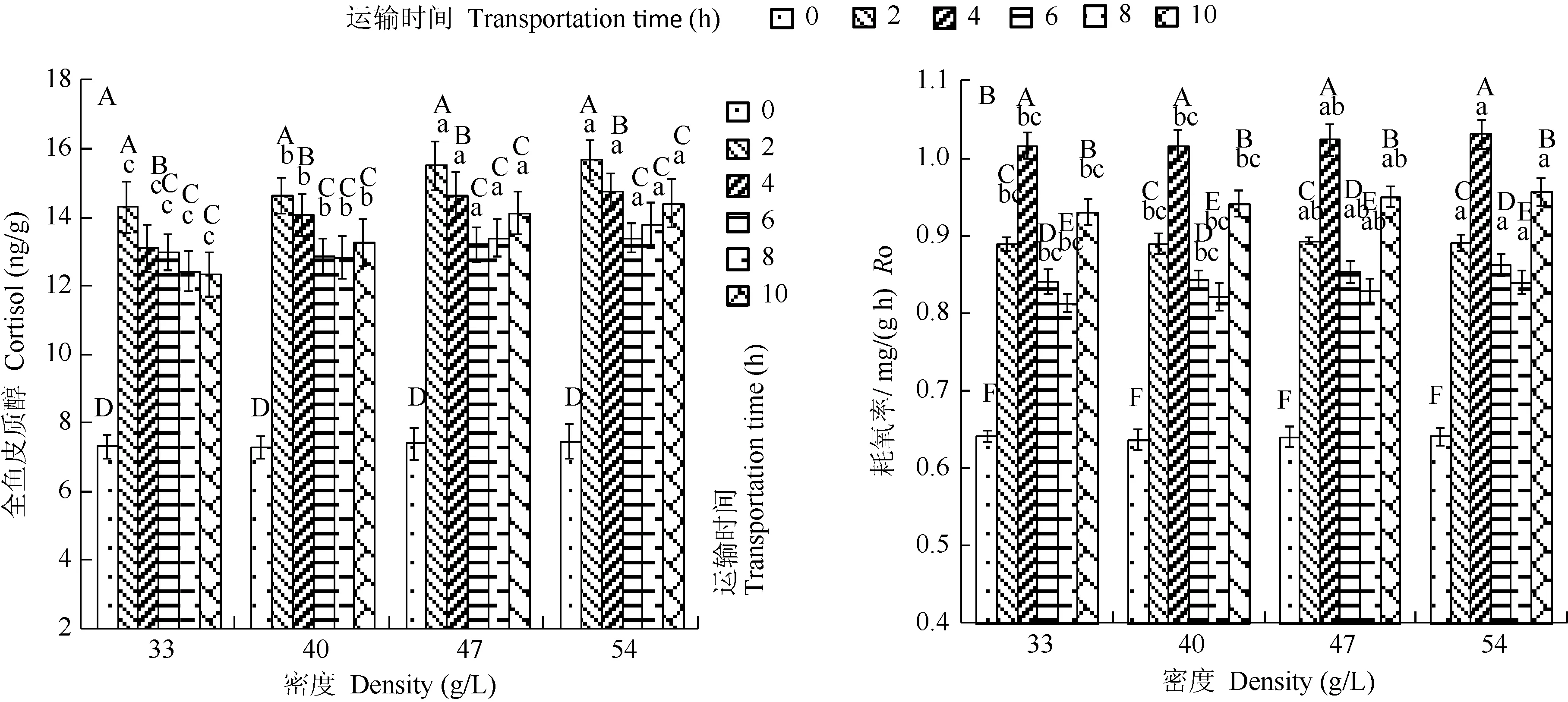
图1 运 输时间和密度对翘嘴 鲌全鱼皮质醇、耗氧率的影响Fig. 1 Effect of transportation time and density on whole-body cortisol and oxygen consumption rate of Culter alburnus
3 讨论
3.1 运输时间和密度对全鱼皮质醇水平的影响
运输包括捕获、转载、禁锢等一系列连续的强刺激性操作协迫是常见的复合应激因子, 皮质醇等激素水平的升高, 进而诱发鱼体代谢速率加快、抗病性和耐低氧能力等减弱, 其成活率也显著下降[2,4,8]。在运输2h内, 翘嘴鲌全鱼皮质醇水平显著上升了 1.9—2.2倍, 之后开始下降。在运输胁迫后, 革胡子鲇(Clarias gariepinus Valenciennes)血清皮质醇水平显著上升了4—5倍, 水体氨氮浓度也显著高于对照水平[9]; 重复而长时间的禁锢胁迫下,虹鳟(Salmo gairdneri Walbaum)血清皮质醇水平一直上升,并于16.5h时达到220 ng/mL, 是对照水平的110倍[10]; 在急性应激后, 银鲶(Rhamdia quelen Quoy et Gaimard)和罗非鱼(Oreochrmis niloticus Linnaeus)全鱼皮质醇水平都显著升高, 但罗非鱼应激水平更为强烈和持久, 其解释为罗非鱼为日间活动鱼类[11]; 而 Barton等[12]发现, 在空气暴露或运输胁迫后, 鲟形目鱼类血清皮质醇水平差异不显著。翘嘴 鲌全鱼皮质醇水平随密度的增加而增加, 运输8h后, 水质恶化和拥挤效应表现突出。彭士明等[13]运输银鲳(Pampus argenteus Euphrasen)12h, 血清皮质醇水平随运输密度的增加而增加, 并于运输 4h达到峰值(7—9) ng/mL, 16 g/L密度组加重了幼鱼应激反应, 死亡率也升高; 而对缺帘鱼(Brycon cephalus Günther)的研究发现,血清皮质醇水平随运输密度的增加而降低, 其解释为高密度组幼鱼“侵略行为”减弱[3]。因此, 鱼体应激水平与密度、鱼的种类、胁迫方式等密切相关。
3.2 运输时间和密度对氧气袋内水质变化的影响
水质是影响活鱼运输鱼的健康、应激水平和存活率的主要因素之一, 其中包括游离CO2、氨氮、DO和PH[2,4]。对黄尾(Seriola lalandi Valenciennes)[14]、大西洋鲑(Salmo salar Linnaeus)[15]和尖吻鲈(Lates calcarifer Block)[16]的研究表明, 运输胁迫后鱼体皮质醇水平显著升高, 鳃血流速度、代谢速率等加快, 耗氧增加, 氨氮和CO2等代谢产物也随之增加并迅速溶于水体, 降低水体pH。Colburn等[17]运输军曹鱼(Rachycentron canadum Linnaeus), 氧气袋内水体DO和pH随运输密度的增加而显著降低; Golombieski等[18]运输银鲶苗种(水温 25℃),各组氧气袋内水体氨氮和游离 CO2浓度随运输时间和密度的增加显著上升, 而DO随运输时间的增加呈现波动变化; 类似的, Urbinati等[3]运输缺帘鱼, 166 g/L密度组氧气袋内水体氨氮浓度低于125 g/L密度组, 其解释为低密度组幼鱼“侵略行为”增强, 活动增加。相对大规格鱼类, 实验鱼对运输胁迫极为敏感, 时间和密度交互作用显著。
Moran等[14]运输黄尾幼鱼, 30min内, 水体游离CO2升到20 mg/L, pH从8.2降到7.2; 氧气袋内水质的迅速变化通常发生在运输(1—2)h内, 且应激持续时间与运输时间和密度成正相关[2,4,15]。在本实验条件下, 翘嘴鲌峰值应激压力发生在运输(0—2)h; 运输(8—10)h时, 水体氨氮和游离CO2浓度高, 成为新的应激源, 且协同作用表现突出, 稚鱼代谢再次增强。尖吻鲈暴露在(12.6—21.6) mg/L氨氮浓度下, 血红蛋白运输氧能力降低, 鳃呼吸速率加快[16]; 黄尾暴露在75 mg/L CO2浓度下, 幼鱼出现严重的血碳酸过多症[14]; 而对真鲷(Pagrus pagrus Linnaeus)的研究发现, 水体氨氮浓度大于 7.94 mg/L时,仔鱼便出现死亡, 且死亡率与氨氮浓度成正相关[19]; 运输成年大西洋鲑, 水体 CO2对其亚致死浓度为19.60 mg/L[15]。在运输结束时, D4组密度最大, 水质条件最差, 实验鱼出现侧翻现象。运输时间为(10—15)h时,鲤科鱼类夏花苗种适宜运输密度为(250—375)尾/L(水温25℃)[1]; 运输时间为6h、9h、12h时, 大盖巨脂鲤(Colossoma macropomum Cuvier)的密度上限依次为90、80、70尾/L,氧气袋内水体 CO2浓度低于 100 mg/L, 稚鱼存活率为95%—100%[5]; 运输军曹鱼时, 应保持水体pH、DO分别在7.0、(6.0—8.0) mg/L以上, 其密度不易超过20 kg/m3[17]。因此, 水质条件可决定运输密度, 在活鱼运输中, 良好的水质条件包括DO饱和度在90%—100%以上, CO2浓度在(30—50) mg/L 以下[2,4]。
3.3 运输时间和密度对翘嘴鲌耗氧率的影响
运输使鱼类产生持续运动, 其中包括能量代谢等生物学功能的改变, 以清除水质变化等产生的不利影响,维持内稳态[3,4]鲌。运输胁迫后翘嘴 稚鱼耗氧率依次为对照水平的 1.39、1.60、1.33、1.30、1.49倍, 并随密度的增加而增大。在 2.5h低氧暴露后, 鲤鱼(Cyprinus carpio Linnaeus)和黑鲫(Carassius carassius Linnaeus)[20]的耗氧率显著上升, 代谢率增加到最大耗氧率的 60%, 恢复时间为7.0h和3.8h; 力竭运动后南方鲇(Silurus meridionalis Chen)耗氧率迅速升高了4—5倍, 之后开始下降, 而间隔10min的重复运动使幼鱼耗氧率一直保持在0.36 mg/(g·h)以上, 其为静止水平的 2—4倍[6]。运输(0—4)h, 急性应激反应使稚鱼消耗大量能量用于组织恢复与更新, 鱼体最大代谢率出现在这一阶段。急性升温, 大西洋鲑幼鱼耗氧率大且快的上升, 而慢性升温, 其耗氧率上升缓慢, 且与升温前差异不显著[21]; 曾令清等[22]研究也表明, 急性变温显著影响南方鲇耗氧率。因此, 耗氧率与鱼的种类和应激水平密切相关, 运输 8h后, 慢性胁迫表现突出, 更会使鱼类能量耗竭, 恢复时间更长。
运输结束的2周内,南亚野鲮(Labeo rohita Hamilton)苗种死亡率从2.13%上升到45.83%, 可称其为“运输损失”[23],运输胁迫长期影响鱼的生长与健康[2,4]。在本实验条件下, 运输时间为 10h时,翘嘴鲌苗种合理的运输密度为(47—54) g/L。
