南极磷虾种群生物学研究进展III—摄食
2014-11-05朱国平朱小艳
朱国平 朱小艳
(1. 上海海洋大学海洋科学学院, 上海 201306; 2. 国家远洋渔业工程技术研究中心, 上海 201306; 3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海海洋大学, 上海 201306; 4. 远洋渔业协同创新中心, 上海 201306)
浮游动物几乎存在于各种类型水体中, 与其他水生动物相比, 其具有个体小、数量多及代谢活动强等特点。浮游动物既能以浮游植物、细菌和碎屑等为食, 同时又是鱼类和其他水生动物的食物来源[1]。作为海洋生态系统物质循环和能量流动中的重要环节, 浮游动物的动态变化控制着初级生产力的节律、规模及归宿, 并影响着鱼类资源的变动, 其种群动态变化和生产力高低对于整个海洋生态系统的结构功能、生态容纳量以及生物资源补充量等均有着非常重要的影响[2]。
南极海域蕴藏着丰富的海洋生物资源, 其中南极磷虾的生物量约为10亿—30亿吨。南极磷虾, 通常指南极大磷虾(Euphausia superba Dana, 下简称磷虾), 为地球上资源量最大的单种生物之一[3], 也是目前世界上资源量较大的大型甲壳类浮游动物[4,5]。磷虾在渔业资源、生态研究及南大洋海洋生态系统中均有着极为重要且特殊的地位, 并受到各方的日益注意。多年来, 不少国家投入了大量的努力从各个角度对其进行深入的研究, 之前也有学者就此进行了总结[6,7], 但迄今为止, 有关磷虾摄食方面的研究仍较为缺乏。作为有机物由初级生产向更高营养级转移的关键环节, 磷虾摄食率的大小对整个南极海洋生态系统的物质循环和能量流动产生着重要的影响, 是建立南极海洋生态系统动力学模型的关键参数。为了更好地了解磷虾种群变动情况及其在生态系统中的作用, 更好地理解南极海洋生态系统的结构、功能和管理, 对磷虾摄食生态学的研究显得非常迫切。为此, 本文尝试从食物组成、摄食方式、选食机制及摄食率等几个方面对近百年来磷虾摄食生态学研究进行总结和归纳, 以期为国内外学者开展相关研究提供基础信息, 并为进一步开展其摄食生态学研究提供科学思路。
1 摄食对象
1.1 食物组成
摄食随生活史阶段的变化 磷虾仔体、幼体和成体生化组成和新陈代谢要求不同, 并表现出各异的摄食行为[8,9]。鉴于南极地理及环境的特殊性, 目前关于磷虾摄食的研究多集中在某一季度尺度内, 少有周年研究,尤其是野外调查。考虑到磷虾摄食时空差异较大, 本文在总结磷虾不同生活史阶段的摄食情况时, 也考虑了空间(海区)和时间(季节)上的因素。
有学者认为, 夏季南乔治亚岛水域仔体摄食桡足类时滤水率最高, 其次为摄食原生动物和藻类[10]。相反, 拉扎列夫海西南水域仔体秋季摄食藻类、原生动物和桡足类的比例相当[11]。摄食实验结果也显示, 仔体秋季主要摄食浮游植物[12,13], 而冬季摄食行为则更为灵活。之前于南极半岛西部水域开展的相关研究表明, 仔体冬季主要为植食性[14],而来自该地区及维德尔海—斯科舍海的其他研究却表明,仔体为杂食性[15]。最近, 来自拉扎列夫海的一项冬季研究显示, 小型浮游动物是仔体冬季非常重要的食物来源[13],且仔体对浮游动物种类或大小并无摄食偏好[9]。相比于仔体, 尤其是仔体后期个体, 带叉幼体期个体脂肪酸分析显示该阶段磷虾含有更高比例的细菌源脂肪酸, 而异养鞭毛藻(Heterotrophic flagellate)为带叉幼体期个体的主要食物来源[16]。根据食物可获性及食物群落组成情况,Oarkes[17]认为幼体会摄食自然收集的海冰微生物, 这也显示其食物选择较为灵活, 通过这种摄食行为, 幼体可在冬季满足最低的能量需求。与夏末至秋季相比, 幼体冬季也显示其无需降低新陈代谢以应对冬季水体中的不利情况, 且此时幼体可通过海冰摄食微生物群落补充能量。这点也较容易理解, 通常微生物脂肪酸可通过食菌原生动物由食物链进入到桡足类体中[18], 而带叉幼体期个体则可能会从原生动物这类摄食对象中同化此类脂肪酸。对于磷虾成体而言, 其主要摄食桡足类[10,11,19], 而其摄食浮游植物和桡足类的滤水率也较为相近。
摄食组成季节性变化 南大洋初级生产力波动较大, 春夏季节为浮游植物主要暴发季节, 而秋冬季节的浮游植物密度相对较低, 因此在浮游植物暴发的春季及初夏季节, 磷虾为植食性种类, 这点有别于其他磷虾种类[20—24]。但考虑到夏季为磷虾的产卵季节, 所需求的能量较高, 而此时水体中浮游植物种类组成出现了更替, 大型浮游动物和非自养微生物的生物量超过了浮游植物, 因此这些浮游动物和微生物也成为磷虾的备选食物来源[25,26]。冬季, 在浮游植物丰度较低的情况下, 为了避免饥饿, 磷虾的食物来源较为广泛, 如碎屑, 细菌或后生动物(杂食性或肉食性)[11,27]。多位学者报道了磷虾冬季摄食冰藻的情况, 认为冬季及春初, 磷虾通常停留在海冰下方, 以利用冰藻补充食物来源[28]。碎屑和异养生物, 如桡足类等也可能作为磷虾额外的能量来源[29]。
Ligowski[30]发现, 磷虾胃含物中含有105种硅藻, 其中60种为浮游种, 42种为底栖种。包括硅藻在内的底栖生物成为夏季和冬季西南极沿岸水域磷虾的重要食物来源, 尤其是冬季和浮游植物稀少的水域, 磷虾摄食附生硅藻、浅海硅藻及其他底栖有机物等。尽管许多研究显示,磷虾胃含物中可辨识的来源主要由藻类细胞组成[21,22], 一些分析也显示磷虾可以通过肉食性行为补充其摄食[12,31]。冬季和夏季, 磷虾胃含物中可发现有甲壳动物和原生动物[29,32]。胃含物分析也表明, 磷虾可摄食多种浮游动物[31,33]。
摄食的空间差异 磷虾摄食严重依赖于浮冰的形成和消融, 尤其是冬季月份。磷虾摄食的藻类依附在海冰下, 海冰覆盖范围的年际变化会对磷虾的繁殖和补充产生影响, 并进而决定其种群动态[34]。在通常情况下, 覆冰范围决定着浮游生物动力学的发展, 并由此产生食物网效应(上行控制)。但磷虾对食物网产生捕食性影响(下行控制), 目前尚不知晓这种影响产生的结果。磷虾的捕食性效应可解释南大洋某些区域桡足类优势种有时较为稀少的现象。尽管海冰消融对磷虾的摄食产生显著的影响, 但有些现象迄今尚未得到较好的解释, 如磷虾从不摄食隐藻, 即使该藻种为唯一的食物来源。南极半岛近岸水域,隐藻通常栖于近表层低盐水体中, 尤其冰川消融水域[35],而硅藻则喜深层高盐水体或近海[36]。在隐藻占优的表层水体中, 磷虾摄食活动降至最低, 然后游至硅藻丰度较高的近海摄食。相反, 当隐藻与硅藻混栖时, 磷虾则停留下来摄食。
在开阔水域中, Alonzo等[37]通过控制摄食实验和野外研究相结合的方法得出, 硅藻在磷虾食物中的比重较高, 但O’Brien等[16]并未得出类似的结论, 且鞭毛藻对成体的摄食贡献也不大, 不过同一研究时期内磷虾带叉幼体或仔体的主要食物来源则是鞭毛藻[38]。近岸与近海站位的磷虾样本肠含物组成存在明显的差异[39], 近海站位中的磷虾肠含物大部分为菱形藻, 而在近岸站位, 磷虾肠含物中大型浮游动物(大部分为铃虫)的比例非常高。
磷虾的垂直移动与其食物来源也存在一定关系。Kawaguchi等[27]报道, 冬季中段, 磷虾摄食海底的碎屑,并预测冬末春初磷虾因趋光特性会采取昼夜垂直移动的活动方式。春初, 随着冰藻和浮游植物丰度的提高, 磷虾在利用这两种食物来源的同时, 还会摄食海底的碎屑。Williams等[40]也表示, 诸如桡足类等浮游动物会在一天的某个时间段内垂直移动至较深的水层, 而磷虾的垂直移动也可能与这些小型浮游动物的移动有关, 从而将其作为额外的食物来源。
1.2 研究方法及应用
目前, 用于估算磷虾摄食组成的常见方法有如下四种, 这些技术的发展大大拓展了我们对磷虾摄食的认知。
胃含物分析法 磷虾摄食通常利用显微镜检查胃含物和肠道含物等予以分析, 该方法通过生物消化道内未被消化的食物来确定生物的食性, 是最常见的传统食性分析方法。它能确定生物在被采集前所摄取的食物, 比较直观, 但存在一定的偶然性, 需作大量的统计调查才能消除这种偶然性。由于消化道内食物颗粒通常无定型,因此很难确定其来源, 它不能区分生物对所摄取食物消化的难易程度, 而往往偏向于较难消化的食物, 其在辨识无硬质部位的摄食对象(如, 纤毛虫和原生动物)时也有所限制。与胃含物分析相关的一个主要问题是很难鉴定部分已消化的摄食对象, 且测量起来非常耗时, 不易量化。朱根海[41]曾利用此法对磷虾胃含物进行了分析, 初步鉴定出浮游植物29属、93种或变种, 其中硅藻类占优。
脂肪酸标记法 脂类含量提供了大量有关生物发育、繁殖、条件及摄食生态学等方面的信息, 在此方面,中上层浮游动物有着大量的研究[42,43]。作为生物体必需组成成分的脂肪酸, 由于其结构具多样性, 能够在一定程度上指示其来源, 并且能够从较低营养级(初级生产者)向较高营养级进行保守传递, 因此, 脂肪酸标记法能够更为准确的在物种水平上反映出动物在一段时期内的摄食情况及其所处的营养级地位[44,45]。过去几十年来, 大洋性浮游动物的脂类存储动力学及脂肪酸组成等方面的基础信息也得到了较大的完善, 尤其是南北极水域[46,47]磷虾等种类的关注度更高。
生物标记法分析磷虾的脂肪酸及稳定同位素组成,其可标定大量食物组成。Cripps等[48]基于脂肪酸含量描述了不同区域磷虾的差异, 其表示不同地区磷虾组织类脂含量可反映不尽相同的摄食史(即, 通过优势藻种和桡足类状况估算磷虾的食物环境存在空间差异)。
同位素分析法 稳定同位素法是依消费者稳定同位素比值与其食物相应同位素比值相近的原则判断此生物的食物来源, 进而确定其食物贡献, 而通过测定生态系统中不同生物的同位素比值还能比较准确地测定食物网结构和生物营养级[49]。测定生物的稳定同位素比值不仅可以判断其食物来源、各种食物贡献比例、食物季节性变化及其在生命中不同生长阶段的生态营养作用和时空变化, 也能对低营养级或个体较小生物的营养来源进行较为准确的测定, 进而为生物种群间的相互关系及整个生态系统的能量流动进行准确定位。近年来, 稳定同位素比在海洋生态系统研究中得到了广泛的应用[50], 同时也成为研究食物网传统手段的一个有利补充及描述海洋食物网的复杂结构一个非常有用的工具[51]。最近, Polito等[52]利用稳定同位素手段对南设得兰群岛水域磷虾个体发育生态位扩展进行了分析, 结果显示浮游植物为磷虾终生重要的食物来源, 且随着体长的增长, 其摄食生态位也会扩展到更高营养级的食物来源。
PCR法 摄食研究最有前景的新方法为基于研究物种肠道或粪便中摄食对象 DNA测定的聚合酶链反应(PCR)。类属特异性PCR用来扩增被捕食者基因并从DNA克隆库进行比较得出结果。即利用DNA作为磷虾捕食对象生物标记, 所有的生物均有特定的 DNA序列, 而这可用作生物标记以作查看及辨识, 并用于研究任何感兴趣的捕食对象种类或捕食对象组[53,54]。DNA法也为样本的快速高效检测提供了潜力[55]。Martin等[56]评估了 PCRDGGE(变性梯度凝胶电泳)区分磷虾幼体肠道及粪便样本中的摄食成分。从实验室试验测序PCR-DGGE明确区分了硅藻和桡足类, 在原位喂养分析显示, 其摄入了广阔的多样性类群, 包括硅藻、鞭毛藻、纤毛虫、领鞭虫和涡虫等。
以上四种方法是现在用于研究磷虾食物组成的主要方法, 许多学者也会选择其中两至三种方法同时进行实验, 以确保其结果的可靠性, 并进行相互验证。例如,Whitledge等[57]曾采用稳定同位素技术和传统的食性分析方法相结合, 对美国密苏里州Jacks Fork河中两种淡水鳌虾的能量来源(食物来源)进行了研究, 结果表明, 采用传统的胃含物分析法, 并对食物消化吸收率进行校正后的数据, 与采用稳定同位素技术分析的数值较接近, 说明了两种方法的一致性。Schmidt等[58]通过胃含物、脂肪酸和稳定同位素分析得知, 野捕磷虾较高的生长率归因于食物中高含量的异养成分, 但后生动物, 而非桡足类为这些快速生长磷虾的异养食物来源。Töbe等[59]利用量化PCR手段辨认并量化了拉扎列夫海冬季磷虾仔体的摄食对象为浮游植物、原生动物和中型浮游动物等。
2 摄食方式与选食机制
2.1 摄食方式
很明显, 浮游植物夏季暴发季节, 磷虾主要以其为食[20,21]。有关磷虾摄食行为方面的研究[60—62]已对其摄食机制做了较为详细的描述, 而其摄食装置也因此得以阐明[61,63,64]。磷虾有两种主要的摄食模式[61]。第一种为“泵吸式滤食”, 即胸足形成的滤食篮周期性张合, 从而将食物直接送入口中, 通常食物尺寸相对较大, 此种摄食方式在实验室暂养过程中被观察到[61—63], 野外调查中也发现到该行为[65]。第二种为“压缩摄食”, 即胸足伸长压迫水体通过滤食篮, 当水体过滤后, 食物颗粒便存留在刚毛上[60,63,66]。滤食篮以1—1.5 Hz的频率“填满”并压缩。滤网与潜在食物对象之间的关系如图 1所示。这种滤食机制会拒绝30 µm 以上的颗粒, 并保留大于 1 µm的颗粒, 包括细菌(图1)。尽管磷虾依外界条件会在不同的时间内采取不同的摄食方法[61,67], 但总的来讲, 磷虾主要的摄食方式还是利用食物篮滤食[60—62]。因此, 食物篮的微结构, 尤其是滤网大小, 对可过滤颗粒大小有着非常显著的影响[61,62,68]。
磷虾的六对胸足形成一个“V”形滤食篮。胸足的前两节覆有长刚毛, 而这些长刚毛上面又覆有较细的短刚毛。短刚毛上长出的三级刚毛形成过滤网, 网目尺寸不足1.0 µm。胸足末端附有梳状刚毛, 这些刚毛基部有一个梳子状的装置。刚毛排列基本上有两种类型, 由此产生两种不同的过滤网: (1)非常紧密的网(网目尺寸为1—4 µm), 过滤刚毛形成面积相对较大的过滤网; (2)较为松疏的网(网目尺寸为 25—40 µm), 梳状刚毛基部形成面积相对较小的过滤网(图 1)。
Hamner等[60]曾详细描述了磷虾摄食时的胸足运动状态: 摄食时, 磷虾胸足展开形成腹侧和两侧封闭的食物篮包裹水和藻类。在食物篮充分展开时, 相邻内肢的刚毛重叠, 形成狭缝带。在开始摄食时, 胸足外肢停止机械摆动, 翻转90度侧向压住狭缝(图2)。指节向后弯曲, 与内肢长刚毛重叠。水体中添加荧光染料表明, 食物篮不透水,当磷虾内肢快速压缩排水时, 藻类被过滤、收集到食物篮的刚毛上, 外肢像苍蝇拍一样, 水平举起, 水流从食物篮侧面穿过刚毛平行射出。磷虾每秒可重叠摄食1—1.5次。当口部形成大食物团时, 摄食停止, 大颚须将食物压向大颚, 随之进行吞食。
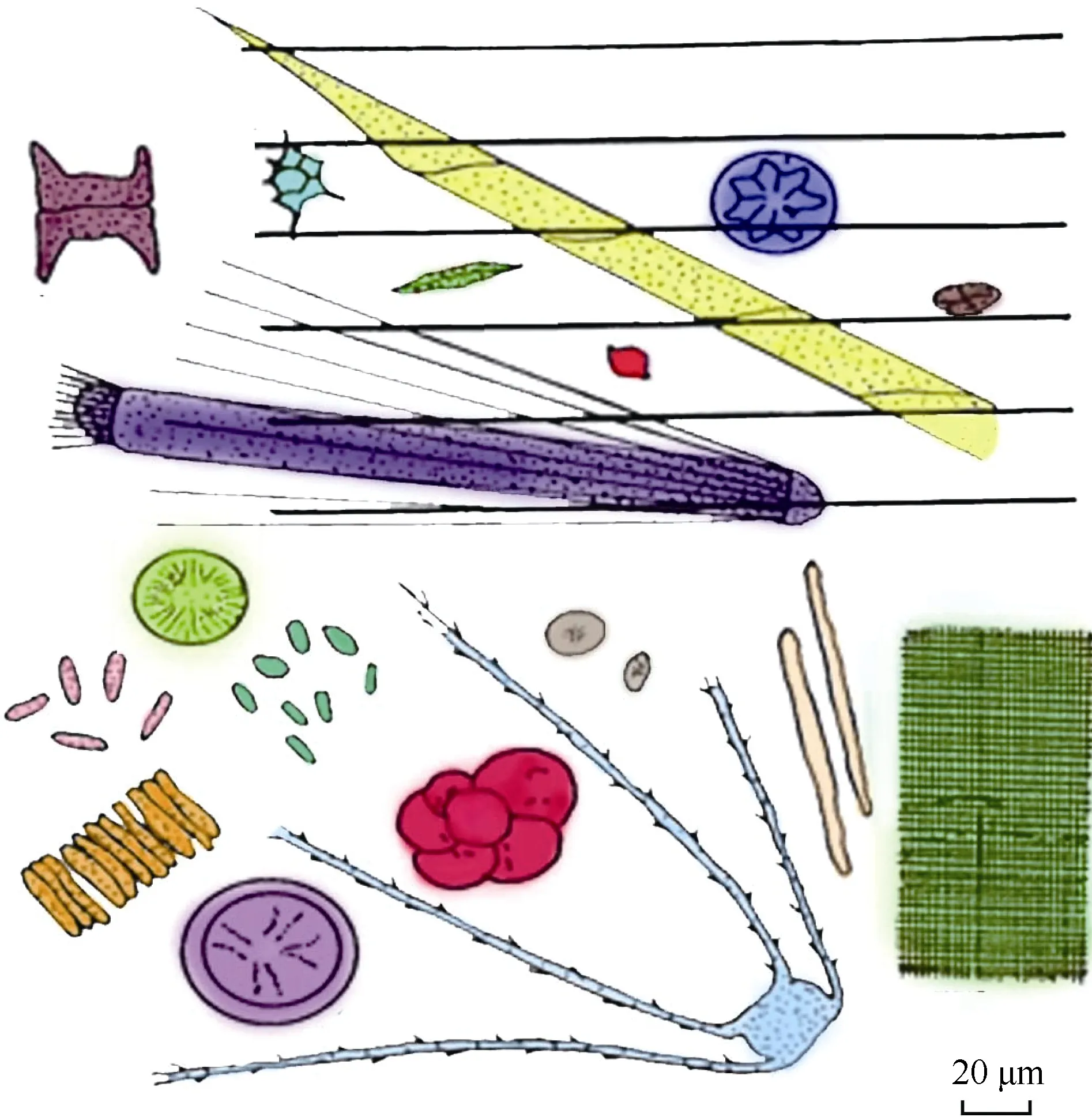
图1 南极磷虾滤食网与食物对象之间的尺寸关系(仿自Kils[61])Fig. 1 Size relationship between ambient food organisms and the filtering nets of Euphausia superb (Reproduced from Kils 1983)

图2 南极磷虾摄食篮的开启和闭合过程(顺时针方向)(仿自Boyd, et al.[62])Fig. 2 Progression (clockwise) of opening and closing of feeding basket. (Reproduced from Boyd et al. [62])
Kils[61]注意到, 磷虾胸足足节呈耙状结构, 其形状与正常的刚毛有着较大的差别, 这些足节非常坚硬, 且直径自顶部至基部逐渐增加。因此, 这些足节非常适合于从海冰或其他表面刮食藻类。Hamner等[60]就曾在实验室中观察到磷虾利用足节刮取冰藻进入滤食篮的过程, 而其他一些研究人员也在不同的环境中观察到这种现象[26,28]。Stretch等[26]发现, 磷虾附于大块浮冰下索饵时, 会展示出两种不同的行为模式。受到融冰藻类释放的刺激, 它们会显示区域增强的索饵模式, 该行为的主要特征为游速较快, 转身迅速, 同时伴随着滤食篮的快速张合。此行为之后, 磷虾通常会呈现另一种索饵行为, 即冰下刮食行为; 这时, 磷虾通常已确定冰下藻类的位置, 并利用足节刮擦海冰表面, 以此摄取冰面的冰藻[69]。
磷虾与桡足类的摄食机制和食物绝对尺寸均存在差异。磷虾利用压缩过滤同时吸收许多颗粒[66], 而桡足类则倾向于积极吸收单个颗粒[70]。因此, 磷虾类对摄食对象的选择性并不同于桡足类。磷虾很少有效地摄取小颗粒, 尤其是球形半径不足10 µm的颗粒[62,64,71]。
2.2 选食机制
目前关于磷虾的选食机制问题尚有不同意见, 少数学者, 如 Pavlov[72]认为, 磷虾仅摄食数量最多的浮游植物, 没有选食能力, 且与饵料的种类、大小及形状无关。但多数学者仍认为, 磷虾具有摄食选择性。对比磷虾与浮游植物的分布情况, Kawamura[22]表示, 磷虾选择性摄食某些硅藻种类(Nitzschia kerguelensis, Coscinodiscus sp.,Synedra satula和Actinocyclus sp.)。另一方面, Pavlov[72,73]及Meyer和El-Sayed[74]则表示, 在大多数情况下, 磷虾的肠含物主要有小型硅藻组成, 因为小型硅藻细胞壳较硬,难消化, 而大型硅藻, 如Rhizosolenia和Chaetoceros等的细胞壳则比较脆, 因而肠含物中很少发现到。Nishino和Kawamura[29]的结果也证实了这点。
磷虾的摄食对象随性成熟度不同发生变化。幼体为杂食性, 更高成熟阶段的磷虾则表现为植食性。事实上, 幼体摄食大型浮游动物的频率要高于成体。Schnack[75]显示,磷虾随体长的增大而选择性摄食菱形藻, 但其并未在报告中提及具体的体长。
依据最优摄食理论, 摄食实验中磷虾获得的总碳浓度可能会影响磷虾摄食行为的选择性程度[76], 当碳浓度较高时, 磷虾对食物的选择程度较高, 因此少有食物来源的仔体可能不会有过多的能量去选择摄食。Habermann等[77]发现, 当磷虾摄食以隐芽植物为主的天然浮游植物群落时, 磷虾成体对所有浮游植物的牧食率剧烈下降。但当硅藻充足的情况下, 磷虾对隐芽植物的摄食量相对较低。相对于以硅藻为主的群落而言, 以隐芽植物为主的群落被认为是磷虾相对较差的食物来源, 一旦出现这种情况, 表示磷虾可能会寻找更好的食物来源。
3 摄食率
3.1 摄食率
磷虾摄食率包括滤食率和捕食率, 而以前者研究为多。滤食率由多方面所确定, 如饲养磷虾和自然浮游植物的密闭容器中的叶绿素 a消耗速率[74]; 包含磷虾的饲养池出入口的海水中叶绿素a的差异[63]; 在流通或密闭系统中,磷虾消耗自然浮游植物数量的变化[62,78]。
在一系列密闭实验中, Quetin和Ross[78]发现, 磷虾最大滤食率与所摄食的浮游植物物理尺寸有关, 细胞大小可能是影响最大滤食率最重要的参数。其他一些研究表明,磷虾对所有尺寸的浮游植物并不存在等效摄食[62,74]。Boyd等[62]发现, 浮游植物直径大于12 µm时保持有效摄食最大,细胞直径6 µm时有 50%的保留效率。Quetin和 Ross[78]测得的最大滤食率为357 mL/h, Boyd等[62]对全长45 mm的磷虾进行了测量, 得出其滤食率为500 mL/h, 而Antezana等[63]的实验结果为210 mL/h。
在流通系统中, Price等[18]对磷虾杂食性摄食行为进行实验后发现, 滤食率由初始的浮游植物浓度 0.1 µg Chl. a/L时的约300 mL/h增加到最大浓度13 µg Chl. a/L时的800 mL/h。但其他学者得出与之矛盾的结果, 这可能是由于细胞种类和尺寸及测量时其浓度范围不同所产生的偏差。Holm-Hansen和 Huntley[79]认为, 在大多数渔场条件下, 除发生藻类暴发时, 藻类浓度较少会超过 13 µg Chl. a/L, 一般情况下会相当低, 大约为0.6 µg Chl. a/L。
在实验室观察中, 一些学者针对培养冷冻浮游植物的冰块[60], 正处于融化阶段的培养浮游植物的冰块和自然海冰生物[26]等情况下磷虾的摄食情况进行了研究。Marschall[28]分析了成体(35—45 mm)摄食玻璃载片上培养的浮游植物情况, 但未量化研究食物消化情况。事实上,当时尚无研究量化冰面摄食的磷虾摄食率情况。
通过饵料浓度差减法、肠色素法等多种途径可获得磷虾的摄食率, 并进而确定其食物偏好以及各种食物来源的相对重要性。磷虾摄食选择性依赖于食物浓度, 因此,其摄食率的测量十分重要。值得一提的是, 采用饵料浓度差减法需要注意培养容器对磷虾摄食的影响, 如Price等[19]发现培养容器为50 L时, 磷虾滤食率为(474.9±43.1) mL/(ind.· h), 超过5 L培养容器滤食率一个数量级。另外, 肠色素法也存在低估(或高估)磷虾摄食率的问题, 如叶绿素a在肠道内的降解产物除了脱镁叶绿酸a外, 还可能进一步降解为非荧光物质, 而且肠排空实验中动物由于干扰会加速排粪或因停止摄食而延缓排粪, 这些均会对摄食率产生影响[31]。针对磷虾摄食活动的现场测量显示, 磷虾的摄食率较实验室内获得数据高出1.5—6.0倍[80]。
3.2 研究方法及应用
目前, 研究浮游动物摄食率的主要方法有四种, 分别为饵料浓度差减法, 肠道色素法, 稀释法和色素收支法[81],这些方法也在不同程度上应用于磷虾摄食率研究上。
饵料浓度差减法 饵料浓度差减法为一种广泛应用的测定方法, 即在培养实验动物时, 依据培养前后饵料浓度的变化估算对象的摄食率, 其摄食强度主要按Frost[82]公式计算。Price等[19]用饲养实验研究了不同饥饿持续时间和实验容积体积等条件对磷虾摄食率及清除率的影响。结果显示, 在培养容器为50 L时, 相比在较小容器体积中, 磷虾的摄食率较高。磷虾摄食率随着饵料浓度的升高而增加, 当饵料达到一定浓度时, 磷虾摄食率不再增加, 呈现摄食饱和现象。磷虾滤食率和摄食率与浮游植物浓度之间存在着线性相关关系。
肠道色素法 肠道色素法的最初概念由Mackas和Bohrer[83]以及Nemoto[84]提出, 它假设动物肠道内含物是摄食和排泄平衡的结果。所以, 若知道动物的肠道内含物的数量和排泄速度, 就可求出摄食率。该方法可以避免许多室内培养实验中人为因素的干扰。仲学锋[85]用肠道荧光法现场测定了磷虾的肠道排空率和肠道内含物色素水平, 并据此计算自然状况下磷虾的摄食率, 其结果显示,磷虾的肠道排空率为0.43/h。次成体(平均体重为168.8 mg干重)和成体(平均体重为274.3 mg干重)的摄食率分别为(180.6±19.2) ng Chl.a/h 和(464.4±28.3) ng Chl.a /h。自然状况下磷虾的摄食率与现场测定的 100 m以上水层平均叶绿素a浓度的相关性不大。
稀释法 稀释法用来研究微型浮游动物(小于200 μm)的摄食。这些浮游动物包括大量无脊椎动物的幼体、原生动物和异养的鞭毛虫。肠道色素法研究结果显示, 大于200 μm浮游动物仅摄食浮游植物部分生物量和生产力。同时, 微食物环的研究也强调了小型浮游动物摄食的重要性。1982年, Landry和Hassett首先提出用稀释法估计小型浮游动物的摄食[86]。Tsuda和Kawaguchi[87]用稀释法研究南大洋表层水中微型浮游动物摄食时, 发现微型浮游动物的摄食率与浮游植物的生长率间具有相关性, 两者之间存在着相互耦合关系。
色素收支法 色素收支法的前提是叶绿素 a先降解为脱镁叶绿酸a, 然后继续降解为非荧光物质。但叶绿素a也可能同时降解为脱镁叶绿酸a和非荧光物质。至于是这两种途径的哪一种, 尚没有定论。色素收支法同时假设浮游植物被摄食后叶绿素 a立即全部降解, 实际上并不可能。大型浮游动物的粪便中常含有大量的叶绿素 a,这也是产生误差的原因之一。色素收支法适用于比较深的海区, 沉积物捕捉器位于真光层以下, 但不受海底沉积物再悬浮的影响。
4 结语
我国对南极浮游动物的研究起始于20世纪80年代。1984—1985年, 我国首次南极科学考察对南极半岛海域和长城站外磷虾、桡足类等的种类、分布和生物学等进行了研究[88]; 之后研究主要集中在磷虾负增长和年龄鉴定方面, 对于磷虾的摄食活动研究较少, 如何准确、有效地分析磷虾的食物组成及其摄食史, 并进而掌握其食性,将成为磷虾摄食生态研究的关键科学问题。研究磷虾摄食的目的之一就是获得其摄食率, 从而推算自然水体中磷虾的摄食压力和海洋生态系统能量物质输送的途径与效率, 但摄食率由多种因素所确定, 许多学者测得的结果也有所不同, 如何减小使用不同方法得出摄食率的偏差,也将是我们所面临的问题。随着新技术(如: 稳定同位素法、脂肪酸法及PCR法等)、新仪器(如: 电子显微镜、高速显微摄影机等)的应用, 这些问题可能会在不同程度上得以解决, 特别是基于研究物种摄食对象 DNA测定的PCR法被认为是摄食研究最有前景的方法。随着用于研究磷虾食性的方法不断增多, 测量的可靠性也在逐步增加, 今后其摄食生态研究将不断发展, 由此可找出最适合的研究方法, 进一步深入了解磷虾摄食的各种问题。可以预见, 磷虾的食物组成、影响因素及摄食率仍会是今后一段时间内研究的重点。
