斑点叉尾源维氏气单胞菌对四环素类抗生素的耐药性及耐药基因的检测
2014-11-05汪开毓陈德芳黄凌远王浩丞
赵 敏 汪开毓, 王 均, 陈德芳 黄凌远, 王浩丞
(1. 四川农业大学鱼病研究中心, 雅安 625014; 2. 四川农业大学动物疫病与人类健康四川省重点实验室, 雅安 625014)
维氏气单胞菌(Aeromonas veronii)为气单胞菌属(Aeromonas)的一种, 亦被称为维罗纳气单胞菌、凡隆气单胞菌和维隆气单胞菌, 存在于水体和淤泥等环境中[1], 能够感染斑点叉尾(Ictalurus punctatus)[2,3]、锦鲤(Cyprinus carpio L.)[4]、西伯利亚鲟(Acipenser baerii)[5]、鲱形白鲑(Coregonus clupeaformis)[6]、华鲮(Sinilabeo rendahl)[7]、框镜鲤(Cyprinus carpio)[8]等多种鱼类。其中, 斑点叉尾感染维氏气单胞菌近几年才被发现, 其发病率可达 30%以上, 病鱼死亡率在 50%以上, 给养殖户造成了巨大的经济损失, 也严重制约了斑点叉尾养殖业的健康发展[2,9]。
目前, 在鱼病的防治过程中, 养殖业者为减少损失,首先采用的对策就是使用抗菌药物, 但由于水产病原菌日趋严重的耐药性, 使得抗菌药难以达到预期的治疗效果[10—12], 从而又给鱼病的防治带来了巨大的困难。其中,四环素类药物为一种广谱抗生素, 通过干扰细菌蛋白质的合成起到抑菌作用[13], 可用于防治鱼类的多种细菌性疾病, 而因临床上对该类抗生素的不合理使用, 使得鱼类病原菌对此类抗生素的耐药性变的尤为突出[10—12]。
2006—2011年, 我实验室先后从四川地区人工养殖的斑点叉尾病样中, 分离得到维氏气单胞菌共 42株。本试验以这些菌株作为研究对象, 旨在分析四川地区斑点叉尾源维氏气单胞菌对四环素类抗生素的耐药状况以及相关耐药基因, 为临床合理用药以及进一步研究维氏气单胞菌的耐药机制提供部分参考依据。
1 材料与方法
1.1 菌株
1.2 主要试剂
药敏纸片(四环素 30 µg/片, 强力霉素 30 µg/片)和MH培养基购自杭州微生物试剂有限公司, 细菌基因组DNA提取试剂盒(DP302-2)、2×Taq Master Mix和感受态细胞 DH5α购自天根生物科技有限公司, 克隆载体pMD19-T、DNA Marker及 DNA纯化回收试剂盒购自TaKaRa公司, 氨苄青霉素钠购自上海生工生物技术有限公司, 琼脂糖购自广州英韦创津生物科技有限公司, 盐酸四环素(98.5%)和盐酸多西环素(98%)由四川省民生药业有限责任公司惠赠。
1.3 菌株培养及药物敏感性试验
在无菌条件下, 取低温保存的维氏气单胞菌和质控菌株大肠杆菌ATCC25922接种于MH肉汤中, 28℃恒温摇床120 r/min振荡培养过夜后, 采用麦氏比浊法调整菌液浊度为0.5麦氏比浊管浊度。然后, 参照CLSI[13]推荐的纸片扩散法和微量肉汤稀释法(药物浓度由 128 µg/mL 2倍稀释至0.25 µg/mL)对所有菌株进行药物敏感性分析; 结果参照2008年版 CLSI抗微生物药物敏感性试验执行标准进行判定。
1.4 tet基因片段获得与分析
按照天根细菌基因组 DNA提取试剂盒(DP302-2)的操作说明提取菌体基因组DNA, –20 ℃保存备用。四环素类耐药基因的引物序列参照Nawaz, et al.[14]的报道, 详见表 1。引物由上海生工生物技术有限公司合成。 以维氏气单胞菌基因组DNA为模板, 分别用相应的引物扩增目标基因tet A、tet B、tet C、tet D和tet E; PCR反应体系为 50 µL: 2×Taq Master Mix 25 µL, DNA 模板 2.0 µL,上、下游引物各 1.0 µL, 无菌超纯水 21 µL。反应条件:94℃预变性2min, 94℃ 20s, 53℃10s, 65℃ 45s共30个循环, 最后 65℃延伸 4min。PCR扩增后的产物在 1%琼脂糖凝胶中进行电泳。采用DNA纯化回收试剂盒回收各个基因的阳性扩增产物(每个基因随机选取其中的 5个, 不足 5个则全部回收), 相关操作参照试剂盒说明进行。构建pMD19-T-tet重组质粒, 然后提取质粒, 采用对应引物进行PCR鉴定, 将鉴定为阳性的质粒送往公司进行测序。测序结果使用DNAMAN软件进行序列间相似性分析, 再利用 NCBI中的 Blastn系统进行序列的相似性搜索, 并使用Clustal X 2.0和Mega 4.0软件对tet基因构建系统发育树。
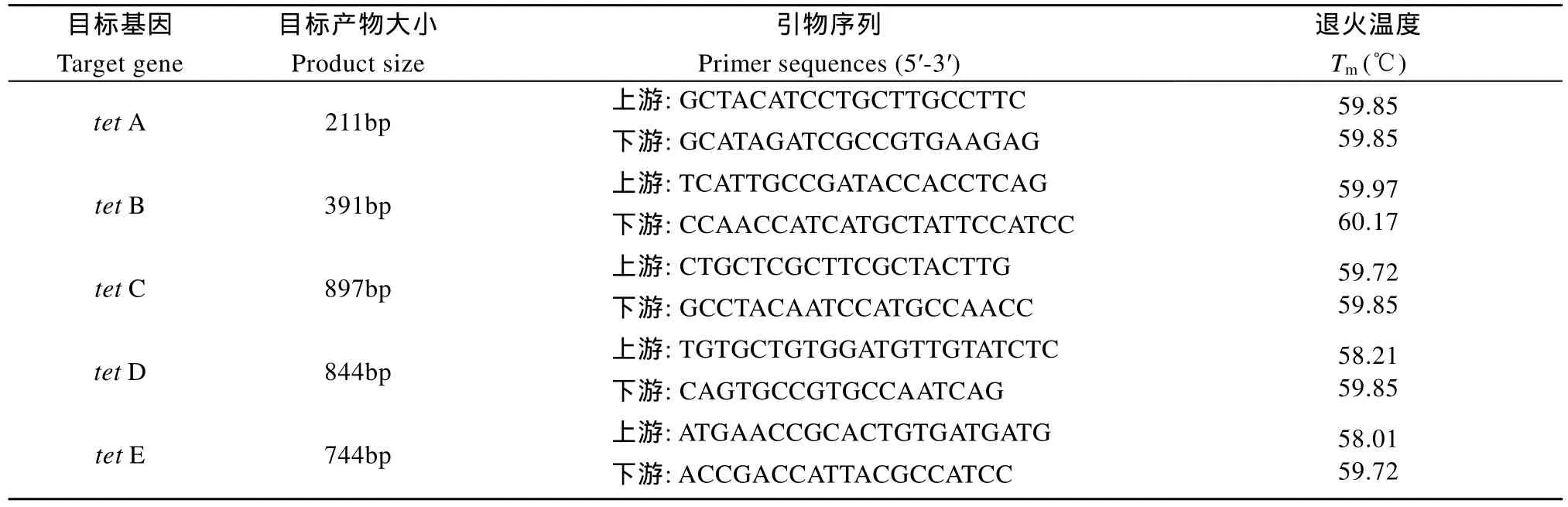
表1 四环素耐药基因扩增引物Tab. 1 Sequences of the primers used in the study
2 结果
2.1 药物敏感性测试结果
在本试验中同时采用了纸片扩散法和微量肉汤稀释法来测定维氏气单胞菌的药物敏感性, 参照吴俊伟[16]所描述的方法, 以纸片扩散法中抑菌圈的大小作为评价维氏气单胞菌药物敏感性的主要依据, 在进行耐药水平最终结果判定的时候, 对抑菌圈显示为中介, 而 MIC值较大的菌株判定为耐药, 对抑菌圈远大于标准而 MIC值偏大的菌株判定为敏感。最终得出42株维氏气单胞菌对四环素类的药物敏感性结果(表2、表3)。
2.2 PCR扩增结果
2.3 tet基因的克隆与分析
经测序, tetA、tetB、tetC和tetE基因片段大小分别为 211、391、891和 744 bp, 与预期结果相符。使用DNAMAN软件分别对5个tetA、2个tetB、4个tetC和2个 tetE基因片段进行多序列比对分析, 结果显示其一致性均为100%。然后将上述4类基因片段序列在NCBI中的 Blastn系统进行序列同源性分析, 结果显示: tetA、tetB、tetC和tetE基因片段分别与GenBank中登陆的多个tet基因的同源性为100%。

图1 tetA基因系统发育树Fig. 1 Phylogenetic tree of tetA gene

图2 tetB基因系统发育树Fig. 2 Phylogenetic tree of tetB gene
在GenBank中分别下载多个tet A、tet B、tet C和tet E基因用于构建系统发育树(图1-4)。结果显示tetA基因与存在于点状气单胞菌(Aeromonas punctata)pFBAOT6质粒(GenBank登录号: 51492513)中的tetA基因, 大肠杆菌O69 (Escherichia coli serotype O69)质粒介导的tetA基因(GeneBank登录号: 227434002)、大肠杆菌Q19中的tetA基因(GeneBank登录号: 393195318)、肺炎克雷伯菌(Klebsiella pneumoniae)pKPI-6质粒(GenBank登录号:394557614)中的tetA基因、蜡样芽胞杆菌(Bacillus cereus)中的 tetA基因(GenBank登录号: 242277425)聚为一簇;tetB基因与来自福氏志贺氏菌(Shigella flexneri)中质粒介导的 tetB基因(GenBank登录号: 12054718)、大肠杆菌pTC1质粒中的tetB基因(GenBank登录号: CP000913.1)、多杀巴斯的杆菌(Pasteurella multocida)中的 tetB基因(GenBank登录号分别为: 336087901、EU252517.1)、沙门氏菌(Salmonella enterica)质粒介导的 tetB基因(GenBank登录号:353467616、HQ331538.1)等聚为一簇;tetC基因与大肠杆菌中的 tetC基因(GenBank登录号分别为: 190887129、190887131、190887127、190887125)、沙门氏菌中的tetC基因(GenBank登录号: GU987054.1)以及plPO2T质粒中的 tetC基因(GenBank登录号:21735067)聚为一簇; tetE基因则与来自杀鲑气单胞菌(Aeromonas salmonicida)中的 tetE基因(GenBank登录号分别为: 113129387、145301211)聚为一簇。
3 讨论
在本研究中, 采用了纸片扩散法和微量肉汤稀释法对 42株维氏气单胞菌进行了药物敏感性测试, 两种方法所得出的结果并不完全一致, 为了能够确定最终的结果, 因此参考吴俊伟[15]所提出的方法, 以纸片扩散法中抑菌圈的大小作为评价菌株耐药性的主要依据, 参考MIC值进行评判, 对抑菌圈中介, 而MIC值较大的菌株判定为耐药, 对抑菌圈远大于标准而MIC值偏大的菌株判定为敏感。最终得出受试菌株对四环素耐药的共有28株, 耐药率为66.67%; 对强力霉素耐药的共有24株, 耐药率为57.14%,明显低于四环素。但从敏感菌株来看,对四环素和强力霉素敏感的菌株均为10株, 敏感率为23.80%, 两者没有差别, 这说明了四川地区的维氏气单胞菌对于四环素和强力霉素的耐药性已经达到了非常严重的水平。
在革兰氏阴性菌中, 细菌对四环素类药物的耐药机制主要有两种, 一种是核糖体保护蛋白, 该蛋白能保护核糖体免受四环素类药物的作用从而产生耐药[16]; 另一种是主动外排作用, 通过外排蛋白将四环素排出胞外,细胞内的药物浓度因此降低, 核糖体因此受到保护, 从而产生了耐药性, 这是最早被研究的一种耐药机制[17],也是本研究中被证明存在于维氏气单胞菌中的一种耐药机制。外排蛋白属于主要异化超家族(Major facilitatorsuperfamily, MFS)中的一员[18]。目前, 已有超过 20种不同的四环素外排蛋白被发现, 这些蛋白被分为 6个不同的类群[17], tetA、tetB、tetC、tetD和tetE基因所编码的外排蛋白属于该6个类群中的第1类群[19], 均发现于革兰氏阴性菌中[17,19]; 该类群蛋白具有12个跨膜α-螺旋, 其四环素抗性蛋白具有 41%—78%的氨基酸同源性, 而它们的四环素阻抑蛋白具有 37%—88%的氨基酸同源性[20]。在气单胞菌中, tetA、tetB、tetC、tetD和tetE基因已经先后被证实存在于该属中, 并且发现tetE基因在该5种耐药基因中检出率最高[21—24], 说明该基因是介导气单胞菌分离株对四环素类药物耐药的优势基因。Nawaz, et al.[14]对分离自鲶鱼的 81株耐四环素的维氏气单胞菌进行了相关研究, 发现tetA、tetB、tetC、tetD和 tetE检出率分别为 3.70%(3/81)、28.40%(23/81)、2.47%(2/81)、2.47%(2/81)、90.12%(73/81), 其中 tetE基因的检出率显著高于其他 4个基因, 为其优势基因, 符合上述观点。然而,Jacobs, et al.[25]在对37株分离自南非水产养殖环境中的气单胞菌的研究中, 以及 Kim, et al.[26]对8株分离自韩国的耐四环素杀鲑气单胞菌的研究中都发现tetA基因在这些菌株中检出率最高。在本研究中, 同样发现四环素耐药的菌株 tetA基因检出率最高, 且明显高于其他 4个基因, 而 tetE基因仅在 2株菌中被检测到, 与最初的研究结果存在差异; 这说明在维氏气单胞菌中, 四环素类耐药基因的流行存在地域性差异。

表2 42株维氏气单胞菌对四环素类抗生素的敏感性试验结果Tab. 2 Susceptibility to tetracycline antibiotics of 42 Aeromonas veronii strains
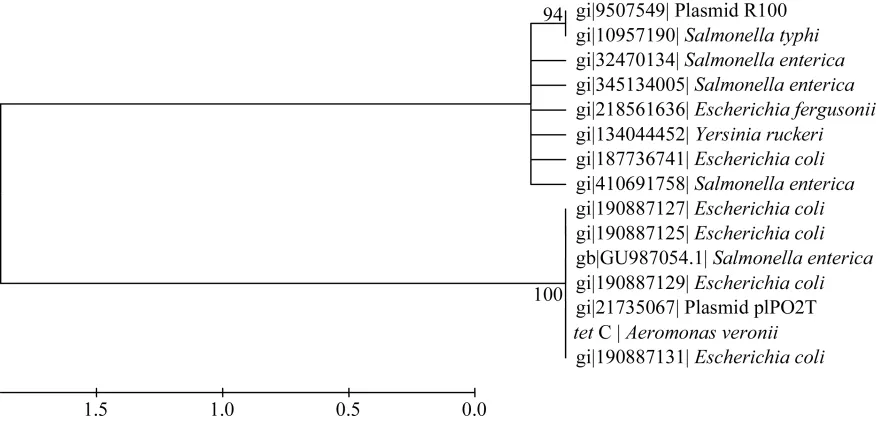
图3 tetC基因系统发育树Fig. 3 Phylogenetic tree of tetC gene

图4 tetE基因系统发育树Fig. 4 Phylogenetic tree of tetE gene
同时, 本研究还发现在 16和 29号菌株中同时检测到tetA和tetC, 在8号菌株中同时检测到tetA、tetB和tetC; 关于一株菌中同时检测出几种四环素类耐药基因的情况, 在Nawaz, et al.[15], Schmidt, et al.[23]以及 Čížek A, et al.[25]各自的研究中已有报道。此外, 我们的研究还发现在耐药菌株4、10、12中并未检测到上述5种耐药基因, 说明在维氏气单胞菌中可能还存在其他的四环素耐药机制, 有待进一步研究。

表3 42株维氏气单胞菌对四环素类抗生素的敏感性试验结果Tab. 3 Susceptibility to tetracycline antibiotics of 42 Aeromonas veronii strains

表4 各基因的检出率Tab. 4 The positive rate of the gene
在本研究中, 首次在国内维氏气单胞菌分离株中检测到tetA、tetB、tetC和tetE基因, 为进一步研究我国境内的维氏气单胞菌的耐药机制提供了一定的理论依据;同时, 本研究的结果也突出了目前我国水产病原菌耐药性的严重性。因此, 如何防止水产病原菌耐药性的产生和传播, 以及在鱼病的防治过程中如何应对因病原菌耐药性而造成的困难值得广大学者共同关注。
